铁皮石斛SPL膜结合(STM)转录因子的全基因组鉴定及表达分析
2023-07-17杨乐聂聪龙小琴何基泽颜超越朱乾坤王万军
杨乐 聂聪 龙小琴 何基泽 颜超越 朱乾坤 王万军
摘 要: SPL转录因子广泛参与植物生长发育、胁迫响应等过程。目前,没有关于铁皮石斛SPL膜结合(SPL with transmembrane motif)转录因子即STM转录因子的研究。为了探究STM转录因子在铁皮石斛生长发育及胁迫响应等方面的作用,该文在铁皮石斛全基因组水平鉴定出4个STM转录因子,并對DoSTM基因家族成员进行生物信息学分析,又利用逆转录PCR研究了DoSTM在不同组织部位及不同逆境处理下的表达情况。结果表明:(1)DoSTM1-4为亲水蛋白,均具有SBP保守结构域和一些激素响应位点。(2)4个DoSTM在根茎叶中均有表达,DoSTM2在叶中的相对表达量最低;DoSTM1/3/4的相对表达水平均无明显差异。(3)DoSTM1-4在低温、高温、干旱胁迫下的相对表达水平都有显著变化,DoSTM1/3/4的表达量降低最为明显,故推测DoSTM与植物体内激素响应、温度变化响应及抗旱性有关。这些结论为后续进一步开展铁皮石斛STM转录因子的研究提供了参考。
关键词: 铁皮石斛, STM转录因子, 基因鉴定, 功能分析, 基因表达
中图分类号: Q943 文献标识码: A 文章编号: 1000-3142(2023)06-1041-10
Genome-wide identification and expression analysis of SPL with transmembrane motif (STM) transcription factor in Dendrobium officinale
YANG Le, NIE Cong, LONG Xiaoqin, HE Jize, YAN Chaoyue, ZHU Qiankun, WANG Wanjun*
( School of Life Science and Engineering, Southwest Jiaotong University, Chengdu 610031, China )
Abstract: SPL transcription factors are widely involved in plant growth and development, stress response and so on. At present, there is no study on the STM (SPL with transmembrane motif) transcription factor in Dendrobium officinale. In order to explore the role of STM in the growth, development and stress response of D. officinale, four STM transcription factors were identified at the whole genome of D. officinale, and bioinformatics analysis of DoSTM gene family members were carried out. The expression of DoSTM in different tissue parts and different stress treatments were studied by reverse transcription PCR. The results were as follows: (1)DoSTM1-4 were hydrophilic proteins with SBP conserved domains and some hormone response sites. (2)Four DoSTM were expressed in root, stem and leaf, and the relative expression of DoSTM2 was the lowest in leaf; there was no significant differences in the relative expression level of DoSTM1/3/4. (3)The relative expression level of DoSTM1-4 changed significantly under low temperature, high temperature and drought stress, and the expression of DoSTM1/3/4 decreased most significantly. Therefore, it is speculated that DoSTM is related to hormone response, temperature change response and drought resistance in plants. These conclusions provide the reference for the further research on STM transcription factor of D. officinale.
Key words: Dendrobium officinale, STM transcription factor, gene identification, functional analysis, gene expression
石斛主要分布在东南亚和大洋洲的热带及亚热带地区,喜生长在温暖潮湿的环境中,附着在树干或岩石上 (罗凯等,2021)。铁皮石斛(Dendrobium officinale)为兰科石斛属多年生草本植物,具有极高药用价值,是一种药食两用中药材,其成分主要包括多糖类、生物碱类、黄酮类以及酚酸类等,在抗肿瘤和增强免疫力等方面具有功效 (唐文文等,2021)。近年来由于过度挖采导致野生资源大量减少,故从分子水平研究铁皮石斛的生长发育对其保育有重要意义 (曾丹琦等,2021)。
SPL(squamousa promoter binding protein like)基因家族作为植物特有的一类转录因子,主要通过结合下游基因启动子区的顺式作用元件来调控下游基因表达。SPL转录因子在植物的生长发育、信号传导、胁迫响应等方面有着重要的作用 (吴艳等,2019)。这类转录因子最早在金鱼草中被发现(Huijser et al., 1992)。之后有更多研究发现SPL转录因子在植物生长发育以及在胁迫响应中起着重要作用 (Yu et al., 2015; Xu et al., 2016)。在甘蓝型油菜的愈伤组织、根、茎、叶、芽、花和角果中有大量BoSPL表达,并且这些基因可能在甘蓝耐寒性中起重要作用 (Shan et al., 2021)。据最近报道,拟南芥SPLs可能参与其从幼年到成年的营养转化、生殖期的形态变化、花青素生物合成和防御胁迫 (Jiang et al., 2021)。其中,SPL3在花序和花器官的发育中发挥重要作用 (Gandikota et al., 2007),在各种低磷胁迫反应以及低磷条件下磷饥饿诱导基因表达中都有SPL1的参与介导 (雷凯健等,2016)。
转录因子的研究是植物分子生物学的重要内容,在植物抗逆等方面起着重要作用。转录因子和基因顺式作用元件的相互作用激活了相关抗逆基因的表达,提高了植物的抗逆性。有一类特殊的转录因子存在,因其含有一段跨膜区被称为膜结合转录因子,可直接整合在细胞内的膜结构上 (如细胞质膜、内质网膜、核膜等),一般处于休眠状态,当受到外界环境变化刺激后,膜结合转录因子便从膜上释放,转变为激活状态,并转运到细胞核内行使功能 (王楠等,2016)。SPL转录因子中也有这类膜结合转录因子,且目前并没有专门研究SPL膜结合转录因子的报道,因此,本研究通过BLASTP在铁皮石斛全基因组中鉴定出4个SPL膜结合转录因子,命名为DoSTM (SPL with transmembrane motif)转录因子,并进行后续生物信息学及表达分析。
1 材料与方法
1.1 材料
将铁皮石斛幼苗分别置于1/2MS培养基、含100 mmol·L-1 NaCl的1/2MS液体培养基、含5 μmol·L-1脱落酸的1/2MS液体培养基、质量分数为10% PEG的1/2MS液体培养基、40 ℃ 1/2MS液体培养基、4 ℃ 1/2MS液体培养基中处理6 h,吸干水分后将幼苗按200~300 mg装入1.5 mL离心管中,并做好标记,迅速置于液氮中1 min,取出放入-80 ℃冰箱保存待用。以盆栽铁皮石斛幼嫩的根茎叶组织作为原材料,进行根茎叶差异表达分析。
1.2 试剂
RNAprep Pure多糖多酚植物总RNA提取试剂盒(北京擎科)、琼脂糖(北京擎科)、2×TSINGKE Master Mix(北京擎科)、RNA无酶水(北京擎科)、PrimeScriptTM II 1st Strand cDNASynthesis Kit试剂盒(宝生物)、50×TAE(上海生工)。
1.3 方法
1.3.1 铁皮石斛STM蛋白的理化性质及亚细胞定位分析 从NCBI数据库中下载拟南芥STM蛋白序列,将物种限定在铁皮石斛(Dendrobium officinale)并进行BLAST搜索,下载搜索到的铁皮石斛的STM蛋白序列,去除冗余序列,利用TMHMM(http://www.cbs.dtu.dk/services/TMHMM-2.0/)预测跨膜结构域,最终选取XP_020685848、XP_020681923、XP_020672795、XP_020688542这4个蛋白进行研究,并分别命名为DoSTM1、DoSTM2、DoSTM3、DoSTM4。利用ProtParam(https://web.expasy.org/protparam/)分析铁皮石斛STM蛋白家族的理化性质。用Plant-mPLoc(http://www.csbio.sjtu.edu.cn/bioinf/plant/) (Chou & Shen, 2007)对DoSTM蛋白家族进行亚细胞定位分析。
1.3.2 铁皮石斛STM家族的系统进化树分析 从NCBI数据库中下载野蕉 (Musa balbisiana)、铁皮石斛 (Dendrobium officinale)、拟南芥 (Arabidopsis thaliana)、蝴蝶兰 (Phalaenopsis equestris)、毛白杨 (Populus tomentosa)、扇形文心兰 (Erycina pusilla)、玉米 (Zea mays)、水稻 (Oryza sativa)、生姜 (Zingiber officinale)的STM蛋白序列Fasta格式。用MEGA-X邻近法構建进化树,序列比对采用ClustalW,选择Bootstrap method,Bootstrap replications选择500,Model选择p-distance,Gaps/Missing Data Treatment选择Partial deletion,Site Coverage Cutoff设定为50,进行建树。建树结果在ITOL(https://itol.embl.de/)中进行美化。
1.3.3 铁皮石斛STM蛋白质二级结构预测 利用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)在线网站对铁皮石斛STM蛋白质的二级结构进行分析,参数为默认值。
1.3.4 铁皮石斛STM蛋白质序列比对及保守基序分析 将4个DoSTM蛋白导入MEME (Bailey & Elkan et al., 1994)在线网站(https://meme-suite.org/meme/tools/meme)进行分析,将motifs的数量设定在10,其他参数默认,进行分析。将铁皮石斛STM蛋白序列Fasta格式导入MEGA-X中进行构树,序列比对采用ClustalW,选择Bootstrap method,Bootstrap replications选择500,Model选择p-distance,Gaps/Missing Data Treatment选择Partial deletion,Site Coverage Cutoff设定为50,进行构树。从NCBI数据库中下载铁皮石斛STM蛋白的CDD,利用TBtools (Chen et al., 2020)对DoSTM保守基序、保守结构域、进化树进行绘图。将铁皮石斛STM蛋白的ClustalW比对结果导入ESPript 3.0在线网站(https://espript.ibcp.fr/ESPript/cgi-bin/ESPript.cgi)进行分析。
1.3.5 铁皮石斛STM基因结构及顺式作用元件分析 从NCBI数据库中下载铁皮石斛的基因组信息,用TBtools进行基因结构绘制,同时获得启动子上游2 000 bp的序列信息,获得的序列信息用PlantCARE (Lescot et al., 2002)网站(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)进行顺式作用元件预测,并用TBtools进行绘图。
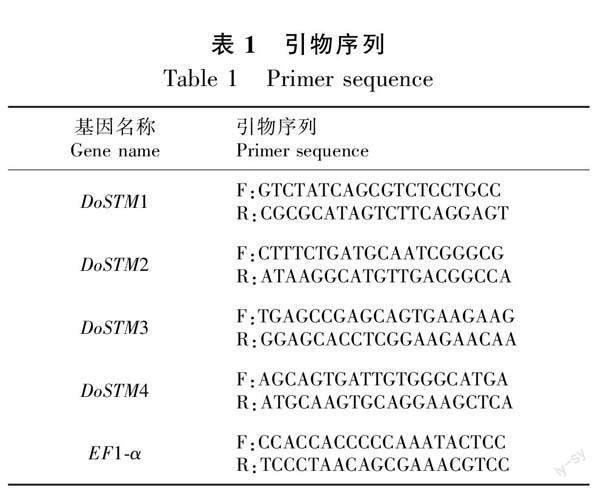
1.3.6 引物设计 利用4个DoSTM的cDNA序列,将所得的cDNA序列用Primer-BLAST进行引物设计,引物大小设定为18~22 bp,PCR产物大小设定为400~800 bp,其他参数均为默认参数,在输出的引物中选择靠近3′端的作为试验所用引物,选用EF1-α做内参,相应的引物序列如表1所示。
1.3.7 铁皮石斛STM基因表达分析 将铁皮石斛幼苗分别置于1/2MS液体培养基、含100 mmol·L-1 NaCl的1/2MS液体培养基、含5 μmol·L-1 脱落酸的1/2MS液体培养基、含10%PEG的1/2MS液体培养基、40 ℃ 1/2MS液体培养基、4 ℃ 1/2MS液体培养基中处理6 h,迅速置于液氮中1 min,取出放入-80 ℃冰箱保存待用。首先,用RNAprep Pure多糖多酚植物总RNA提取试剂盒提取6种处理的铁皮石斛幼苗的RNA和铁皮石斛幼苗根茎叶的RNA,并用PrimeScriptTM Ⅱ 1st Strand cDNA Synthesis Kit进行cDNA第一链的合成。然后,以cDNA第一链为模板,2×TSINGKE Master Mix及引物进行PCR扩增。PCR反应程序:98 ℃预变性2 min;98 ℃变性15 s,55 ℃退火15s,72 ℃延伸1 min,变性-退火-延伸30个循环;72 ℃继续延伸10 min。最后,进行1%凝胶电泳,拍照记录电泳条带。
1.3.8 数据处理及分析 用ImageJ测定电泳条带的灰度值,Excel对所得灰度值进行处理,将处理后的数据导入GraphPad Prism 5中进行分析及作图,分析方法选用Students t-test,显著水平均设为0.05。
2 结果与分析
2.1 铁皮石斛STM蛋白家族理化性质及亚细胞定位分析
DoSTM蛋白家族的理化性质分析结果表明,DoSTM1-4的氨基酸数目分别为1 025、977、1 104、830,相对分子质量分别为113.53、109.09、121.67、93.177;等电点pI在6.07~8.06之间;不稳定系数在44.37~58.41之间,较为不稳定;脂肪系数在78.15~83.04之间;总平均亲水系数均为负数,在-0.405~-0.335之间,表明DoSTM蛋白均为亲水蛋白质(表2)。亚细胞定位预测结果显示DoSTM1-3定位在细胞核,DoSTM4定位在叶绿体。将筛选到的铁皮石斛STM蛋白DoSTM1-4进行跨膜结构域预测 (图1),结果显示跨膜结构域位于C末端22个氨基酸残基处。
2.2 铁皮石斛STM基因家族的系统进化分析
系统进化分析显示9个物种的34个STM蛋白聚为4组 (A-D)(图2),A组的STM蛋白共有3个,B组的STM蛋白共有6个,C组的STM蛋白共有9个,D组的STM蛋白共有16个。其中,DoSTM1-2蛋白共同聚类在B组,有可能是较近发生的基因复制事件所造成;DoSTM4聚类在C组;DoSTM3蛋白聚类在D组。
2.3 铁皮石斛STM蛋白的二级结构
对DoSTM蛋白质的二级结构进行分析,二级结构占比如表3所示,二级结构图如图3所示。结果表明,铁皮石斛STM蛋白的二级结构包括α螺旋、伸展链、β转角和无规卷曲,其中,铁皮石斛STM蛋白的α螺旋占比为28.62%~33.76%,伸展链占比为11.68%~14.70%,β转角占比为4.09%~4.78%,无规卷曲占比为49.56%~55.34%。
2.4 铁皮石斛STM家族蛋白结构分析
对4个DoSTM蛋白进行多序列比对 (图4),结果显示DoSTM1-2蛋白序列同源性较高。DoSTM蛋白的保守基序分析结果表明4个DoSTM蛋白均有SBP保守结构域,而DoSTM1/3还同时包含Ank_2 superfamily,DoSTM2则还包含ANKYR (图5)。同源的DoSTM1与DoSTM2含有motif 1-10,而DoSTM3与其相比缺少motif 7/10,DoSTM4不仅缺少motif 7/10,还缺少motif 3/4 (图5)。表明4个DoSTM的蛋白结构并不高度保守。
2.5 铁皮石斛STM基因结构及顺式作用元件分析
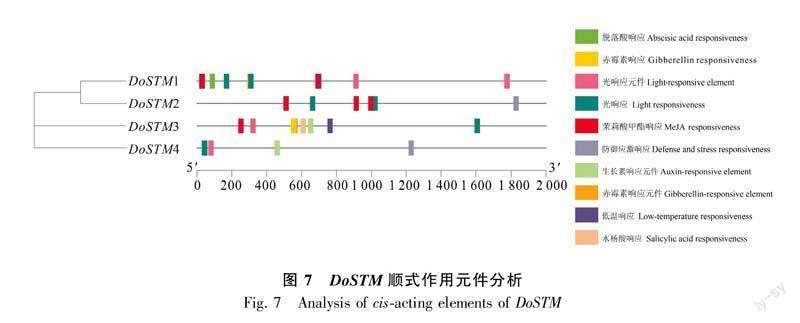
DoSTM基因结构分析如图6所示,发现4个DoSTM均有10个编码区(由于gff3未注释UTR,故未标识非编码区)。顺式作用元件分析发现4个DoSTM中均有光响应区和光响应元件,其中DoSTM1-3共同包含茉莉酸甲酯响应区,而防御应急响应只在DoSTM2/4中具備,除此之外DoSTM4还含有生长素响应元件(图7)。而DoSTM1则可以对脱落酸作出响应,DoSTM3作为包含顺式作用元件最多的STM蛋白,它还可以对赤霉素、水杨酸、生长素及低温作出响应。
2.6 铁皮石斛STM的表达分析
2.6.1 铁皮石斛STM在根茎叶中的表达情况
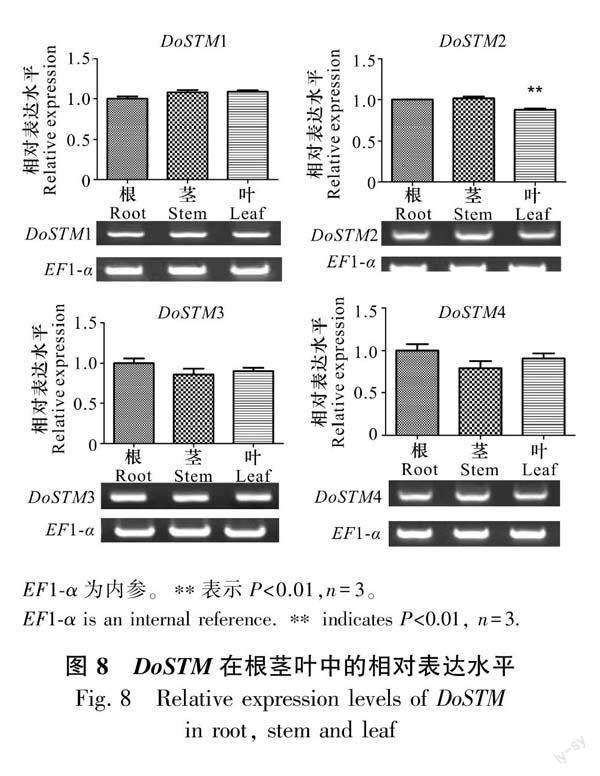
我们对DoSTM在根茎叶3个不同器官的相对表达水平进行了分析 (图8)。本研究发现,DoSTM在根茎叶中均有表达,DoSTM2在叶中的相对表达量显著降低,而在茎中的表达水平则无明显差异,DoSTM1/3/4的相对表达水平均无明显差异,DoSTM1在茎和叶中的表达量相差无几,但略高于根,而DoSTM3-4则在叶中的相对表达水平高于茎,且都低于根。
2.6.2 铁皮石斛STM在胁迫处理下的表达情况 铁皮石斛多生长在悬崖峭壁,会受到多种非生物胁迫,STM转录因子也有被报道参与多种抗逆反应 (王楠等,2016),故本研究进一步分析了DoSTM在不同胁迫条件下的表达情况 (图9)。结果表明,DoSTM1在4 ℃低温、40 ℃高温和10% PEG胁迫处理下的相对表达水平低于对照组,而在ABA胁迫处理下的相对表达水平无显著差异,但NaCl胁迫处理下,表达量略有降低;DoSTM2在4 ℃低温和40 ℃高温胁迫处理下的相对表达水平与对照组相比显著降低,在脱落酸、NaCl、10%PEG胁迫处理下无明显差异;DoSTM3在NaCl、4 ℃低温和40 ℃高温胁迫处理下的相对表达水平与对照组相比显著降低,在脱落酸和10%PEG胁迫处理下与对照组相比稍有差异;与DoSTM3相似的是,DoSTM4在4 ℃低温和40 ℃高温胁迫处理下有显著变化,在脱落酸胁迫处理下也发生显著变化,但在NaCl胁迫处理下并无明显差异。
3 讨论与结论
本研究从铁皮石斛基因组上鉴定出4个STM蛋白序列,对4个STM编码的蛋白进行生物信息学分析。结果表明,4个DoSTM蛋白均为亲水蛋白质;DoSTM1/3/4的等电点均小于7,DoSTM2则大于7,这一点与大部分STM蛋白家族成员的理论等电点大于7有出入 (张晓红等,2016;刘闯等,2017;祁香宁等,2018)。SPL基因家族蛋白含有1个高度保守的SBP-BOX结构域,它是SPL蛋白和DNA分子特异性结合所必需的。这与我们在保守结构域预测时的发现一致。
李豆等 (2021)将白桦BpSPL6基因启动子驱动GUS基因在转基因拟南芥营养生长期的根尖及根的其他部位表达,发现在营养生长时期其在根部的表达也随植物的生长逐渐增加,与前人研究一致,故他推测BpSPL6基因可能在植物的根发育过程中起作用。这与我们测得DoSTM2-4在根中的相对表达水平略高一致,推测DoSTM可能参与根的发育。
激素参与了植物生长发育的各个方面,已有多项研究表明SPL基因参与植物的激素响应过程。对白桦BpSPL6基因启动子的顺式作用元件分析表明 (李豆等,2021),其启动子区含有10种激素响应元件 (生长素、赤霉素、水杨酸、脱落酸等)。这与我们得到的DoSTM顺式作用元件分析结果类似,并且与在脱落酸胁迫条件下DoSTM3-4的相对表达水平发生显著变化一致。利用RNA-seq研究发现拟南芥SPL10对茉莉酸、水杨酸和生长素等激素响应过程有广泛影响。AtSPL10通过调节生长素的生物合成抑制根的再生 (Ye et al., 2020)。赤霉素通过调节茎分生组织中的AtSPL3-5基因促进开花 (Galvo et al., 2012)。在DoSTM启动子上也发现了多种激素响应元件,故推测DoSTM可能参与多种激素响应。
大量研究表明SPL基因能够响应低温、高温等非生物胁迫的信号。如Stief等 (2014)发现在高温条件下,SPL2/9/11基因被miR156-f和miR156-h调控使其表达降低,进而延长植物对高温胁迫的耐受性。除高温条件外,葡萄对低温条件也较敏感,在低温条件下 (5 ℃),体内的VvSBP3和VvSBP5表达均被上调,而VvSBP4和VvSBP7表达明显被下调,表明VvSBP3和VvSBP5参与葡萄的低温胁迫反应 (吴艳等,2019)。这与DoSTM1-4在低温、高温胁迫条件下的相对表达量发生显著变化一致。
对白桦BpSPL6转基因拟南芥进行了NaCl和PEG胁迫实验,发现受到胁迫后,其表达量有下降(李豆等,2021),与我们观测到的在PEG胁迫条件下,DoSTM的相对表达水平显著下调一致,推测DoSTM很可能参与植物的干旱胁迫响应。崔扬等 (2019)发现玉米遭受干旱胁迫时,ZmSPL16在根中的表达量显著上调,这与DoSTM4结果一致,但与DoSTM1/3不一致,具体原因有待进一步研究。
本研究在铁皮石斛全基因组水平鉴定出4个STM,生物信息学分析显示他们均为亲水蛋白,大部分定位在细胞核,都具有高度保守的SBP结构域以及与激素响应有关的顺式作用元件。表达分析显示他们在根中的表达量略高于茎和叶,胁迫分析显示其在低温、高温及干旱胁迫下相对表达水平显著变化,且部分DoSTM可以对脱落酸作出响应。以上研究结果为进一步研究DoSTM转录因子的生物学功能奠定了基础。
参考文献:
BAILEY TL, ELKAN C, 1994. Fitting a mixture model by expectation maximization to discover motifs in biopolymers [J]. Proc Int Conf Intell Syst Mol Biol: 28-36.
CHOU KC, SHEN HB, 2007. Large-scale plant protein subcellular location prediction [J]. J Cell Biochem, 100(3): 665-78.
CHEN CG, CHEN H, ZHANG Y, et al., 2020. TBtools: An integrative toolkit developed for interactive analyses of big biological data [J]. Mol Plant, 13(8): 1194-1202.
CUI Y, FENG YH, CHEN ZF, et al., 2019. Cloning and functional identification of maize transcription factor ZmSPL16 [J]. Mol Plant Breed, 17(20): 6583-6589. [崔揚, 冯彦辉, 陈众峰, 等, 2019. 玉米转录因子ZmSTM16的克隆与功能鉴定 [J]. 分子植物育种, 17(20): 6583-6589.]
GALVO VC, HORRER D, KTTNER F, et al., 2012. Spatial control of flowering by DELLA proteins in Arabidopsis thaliana [J]. Development, 139(21): 4072-4082.
GANDIKOTA M, BIRKENBIHL RP, HOHMANN S, et al., 2007. The miRNA156/157 recognition element in the 3′UTR of the Arabidopsis SBP box gene SPL3 prevents early flowering by translational inhibition in seedlings [J]. Plant J, 49(4): 683-693.
HUIJSER P, KLEIN J, LNNIG WE, et al., 1992. Bracteomania, an inflorescence anomaly, is caused by the loss of function of the MADS-box gene squamosa in Antirrhinum majus \[J\]. EMBO J, 11(4): 1239-1249.
JIANG XW, CHEN P, ZHANG XW, et al., 2021. Comparative analysis of the SPL gene family in five Rosaceae species: Fragaria vesca, Malus domestica, Prunus persica, Rubusoccidentalis, and Pyrus pyrifolia [J]. Open Life Sci, 16(1): 160-171.
LUO K, LI ZS, BAI YB, et al., 2021. Current situation of diversity utilization and protection of Dendrobium [J]. Heilongjiang Agric Sci, (8): 85-89. [罗凯, 李泽生, 白燕冰, 等, 2021. 石斛兰多样性利用及保护现状 [J]. 黑龙江农业科学, (8): 85-89.]
LEI KJ, REN J, ZHU YY, et al., 2016. Arabidopsis SPL1 gene is involved in regulating rhizosphere acidification under low phosphorus conditions [J]. Acta Bot Sin, 51(2): 184-193. [雷凯健, 任晶, 朱园园, 等, 2016. 拟南芥SPL1基因参与调节低磷条件下的根际酸化反应 [J]. 植物學报, 51(2): 184-193.]
LESCOT M, DEHAIS P, THIJS G, et al., 2002. Plant CARE, a database of plant cis-acting regulatory elements and a portal to tools for in silico analysis of promoter sequences [J]. Nucl Acids Res, 30(1): 325-7.
LI D, SU GB, HU XQ, et al., 2021. Cloning and expression analysis of BpSPL6 gene promoter of Betula platyphylla [J]. J Beijing For Univ. https://kns.cnki.net/kcms/detail/ 11.1932.S.20210610. 0948.001.html. [李豆, 苏功博, 胡晓晴, 等, 2021. 白桦BpSPL6基因启动子的克隆及表达分析 [J]. 北京林业大学学报. https://kns.cnki.net/kcms/detail/ 11.1932.S.20210610.0948.001. html.]
LIU C, 2017. Identification of 18 Betula platyphylla STMs genes and functional analysis of BpSPL8 gene [D]. Harbin: Northeast Forestry University. [刘闯, 2017. 18个白桦STMs基因的鉴定及BpSPL8基因的功能分析 [D]. 哈尔滨: 东北林业大学.]
QI XN, 2018. Identification, evolution and expression analysis of Actinidia sinensis SBP-box transcription factor gene [D]. Yangling: Northwest A & F University. [祁香宁, 2018. 猕猴桃SBP-box转录因子基因的鉴定、进化及其表达分析 [D]. 杨凌: 西北农林科技大学.]
SHAN X, ZHANG W, HUANG JX, et al., 2021. Identification and characterization of SPL transcription factor family reveals organization and chilling-responsive patterns in cabbage (Brassica oleracea var. capitata L.) [J]. Agronomy, 11(7): 1445-1445.
STIEF A, ALTMANN S, HOFFMANN K, et al., 2014. Arabidopsis miR156 regulates tolerance to recurring environmental stress through SPL transcription factors [J]. Plant Cell, 26(4): 1792-1807.
TANG WW, XIA JL, CHEN Y, 2021. Functional components, antioxidant activity and correlation of stem, leaf and flower of Dendrobium officinale [J]. Food Mach, 37(7): 45-50. [唐文文, 夏俊丽, 陈垣, 2021. 铁皮石斛茎、叶、花功能性成分、抗氧化活性及其相关性 [J]. 食品与机械, 37(7): 45-50.]
WANG N, XIANG FN, LI S, 2016. Advance in plant membrane-bound transcription factors and stress response [J]. Chin Bull Life Sci, 28(7): 799-806. [王楠, 向凤宁, 李朔, 2016. 植物膜结合转录因子与胁迫响应 [J]. 生命科学, 28(7): 799-806.]
WU Y, HOU ZH, CHENG Q, et al., 2019. Research progress of SPL transcription factors [J]. Soybean Sci, 38(2): 304-310. [吴艳, 侯智红, 程群, 等, 2019. SPL转录因子的研究进展 [J]. 大豆科学, 38(2): 304-310.]
XU ML, HU TQ, ZHAO JF, et al., 2016. Developmental functions of miR156-regulated SQUAMOSA PROMOTER BINDING PROTEIN-LIKE (SPL) genes in Arabidopsis thaliana [J]. PLoS Genet, 12(8): e1006263.
YE BB, SHANG GD, PAN Y, et al., 2020. AP2/ERF transcription factors integrate age and wound signals for root regeneration [J]. Plant Cell, 32(1): 226-241.
YU ZX, WANG LJ, ZHAO B, et al., 2015. Progressive regulation of sesquiterpene biosynthesis in Arabidopsis and patchouli (Pogostemon cablin) by the miR156-targeted SPL transcription factors [J]. Mol Plant, 8(1): 98-110.
YANG ZT, XIONG ML, JIAN Y, et al., 2018. Research progress on the activation mechanism of membrane-bound transcription factors in endoplasmic reticulum stress [J]. Mol Plant Breed, 16(24): 8028-8033. [杨正婷, 熊孟连, 简燕, 等, 2018. 内質网应激中膜结合转录因子的活化机制研究进展 [J]. 分子植物育种, 16(24): 8028-8033.]
ZENG DQ, ZHANG MZ, HE CM, et al., 2021. Identification and analysis of WOX transcription factors in Dendrobium officinale [J]. J Trop Subtrop Plants, 29(3): 301-310. [曾丹琦, 张明泽, 何春梅, 等, 2021. 铁皮石斛WOX转录因子的鉴定和分析 [J]. 热带亚热带植物学报, 29(3): 301-310.]
ZHANG XH, 2016. Functional study and regulatory analysis of flowering related genes in upland cotton [D]. Yangling: Northwest A & F University. [张晓红, 2016. 陆地棉开花相关基因的功能研究及调控分析 [D]. 杨凌: 西北农林科技大学.]
(责任编辑 周翠鸣)
收稿日期: 2022-01-02
基金项目: 国家自然科学基金(31900164); 中央高校基本科研业务费(2682021CX121); 西南交大个性化实验项目(GX2021160027)。
第一作者: 杨乐(1997-),硕士,主要从事植物生长发育与次生代谢研究,(E-mail)2295402195@qq.com。
*通信作者: 王万军,博士,教授,主要从事植物生长发育与次生代谢研究,(E-mail) wanjunwang@home.swjtu.edu.cn。
