2型糖尿病合并骨质疏松症患者血清N-MID、TP1NP、β-CTX水平与冠状动脉钙化的相关性
2023-07-15向省平刘琳陈艳陈雪媛刘蕊李林英林翼泽
向省平,刘琳,陈艳,陈雪媛,刘蕊,李林英,林翼泽
(西藏自治区人民政府驻成都办事处医院检验科,四川 成都 610041)
2型糖尿病(type 2 dibetes mellitus,T2DM)多发生于≥40岁成年人。患者大多肥胖,起病隐匿[1]。而骨质疏松本身与糖尿病密切相关,糖尿病由于血糖过高,容易引起骨质疏松[2]。血糖中氧含量的缺乏不仅会造成血管损伤,还容易造成骨骼损伤。糖尿病病人骨质疏松的发生率是正常人的数倍[3]。骨质疏松症由骨桥素、骨连接素与骨钙素平衡紊乱引起[4]。冠状动脉钙化是指钙质沉积在冠状动脉内壁上,引起冠状动脉的僵硬[5]。骨质疏松患者体内的骨桥素、骨连接素与骨钙素平衡发生紊乱,导致体内钙离子沉积在血管内壁,进而引起冠状动脉钙化[6]。N端骨钙素(N-terminal osteocalcin,N-MID)是由成骨细胞产生并分泌的,当骨更新率加快时,血中N-MID升高[7]。总Ⅰ型胶原氨基端延长肽(total type 1 collagen amino terminal proleptin,TP1NP)在血循环中的含量主要反映I型胶原的合成速率及骨转换情况[8]。β-I型胶原蛋白的C端肽(β-type I collagen carboxyterminalpeptide,β-CTX) 在患者体内的降低反映骨质流失的增加[9-10]。因此,N-MID、TP1NP、β-CTX可用于糖尿病合并骨质疏松症的风险评估[11]。本研究拟探讨T2DM合并骨质疏松症患者血清N-MID、TP1NP、β-CTX水平与冠状动脉钙化的相关性。
1 资料与方法
1.1 一般资料
选取2020年1月至2022年1月西藏自治区人民政府驻成都办事处医院收治的102例T2DM合并骨质疏松症患者作为研究对象。纳入标准:(1)T2DM诊断符合2017年世界卫生组织的诊断标准[12];(2)骨质疏松症诊断符合《原发性骨质疏松症诊疗指南(2017)》中的诊断标准[13]。排除标准:(1)脑卒中患者;(2)自身免疫性疾病患者。
1.2 检测方法
抽取静脉血5 mL置于肝素抗凝管中,采集后立即以3 000 r/min 离心 10 min,留取上清血浆,采用电化学发光法测定血清N-MID、TP1NP、β-CTX水平。冠状动脉病情诊断:采用CT血管造影,钙化病变在冠状动脉CT血管造影上表现为白色、高密度影像,CT值>120 HU的病变为钙化病变。钙化分级:采用Agatston积分[14]。0分:无钙化;1~99分:轻度钙化;≥100分:中重度钙化。
1.3 统计学分析
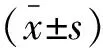
2 结果
2.1 骨质疏松症组与非骨质疏松症组患者血清N-MID、TP1NP、β-CTX水平比较
骨质疏松症组患者N-MID、TP1NP均高于非骨质疏松症组(P<0.05);β-CTX低于非骨质疏松症组(P<0.05)。见表1。

表1 骨质疏松症组与非骨质疏松症组血清N-MID、TP1NP、β-CTX水平比较
2.2 钙化组与非钙化组患者N-MID、TP1NP、β-CTX水平的比较
钙化组患者的N-MID、TP1NP的数值均高于无钙化组(P<0.05);β-CTX均低于无钙化组(P<0.05)。见表2。

表2 钙化组与非钙化组N-MID、TP1NP、β-CTX水平的 比较
2.3 不同程度钙化组N-MID、TP1NP、β-CTX的比较
不同程度钙化组N-MID、TP1NP值随钙化程度升高而升高,β-CTX值随钙化程度升高而降低,差异均有统计学意义(P<0.05)。见表3。
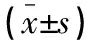
表3 不同程度钙化组N-MID、TP1NP、β-CTX比较
2.4 T2DM合并骨质疏松症患者冠状动脉钙化影响因素分析
对不同预后组间存在统计学差异的因素进行Logistic 多因素分析显示,N-MID、TP1NP、β-CTX都是影响冠状动脉钙化的相关危险因素(P<0.05)。见表4。
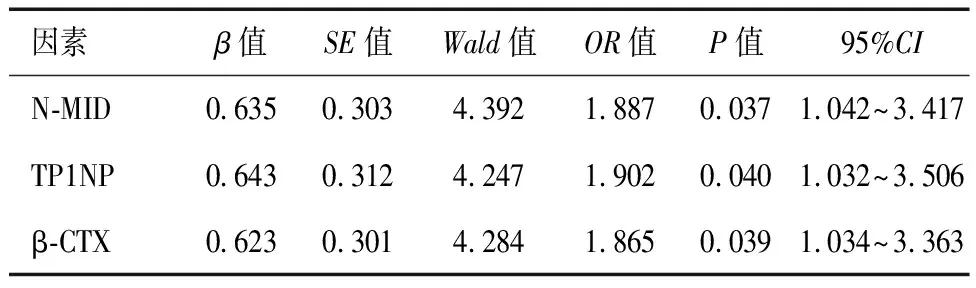
表4 T2DM合并骨质疏松症患者冠状动脉钙化影响因素的多因素分析
2.5 T2DM合并骨质疏松症患者血清N-MID、TP1NP、β-CTX水平与冠状动脉钙化程度相关性
冠状动脉钙化程度与N-MID、TP1NP呈正相关,与β-CTX呈负相关(P<0.05)。见表5。
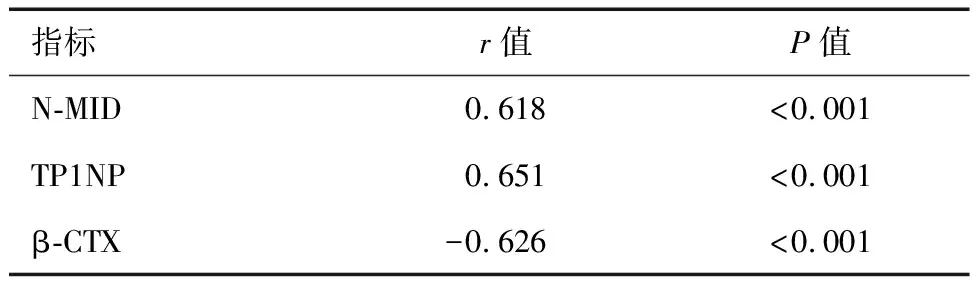
表5 T2DM合并骨质疏松症患者血清N-MID、TP1NP、β-CTX水平与冠状动脉钙化程度的相关性比较
2.6 T2DM合并骨质疏松症患者血清N-MID、TP1NP、β-CTX水平与冠状动脉钙化的ROC分析
N-MID、TP1NP、β-CTX中N-MID诊断冠状动脉钙化的效能较高,N-MID约登指数最大时对应截断值为11.22 ng/mL,ROC曲线下面积(AUC)为0.855,敏感度、特异度分别为95.96%、81.00%;N-MID、TP1NP、β-CTX联合诊断冠状动脉钙化的AUC为0.866,敏感度、特异度分别为96.62%、73.30%。见表6。
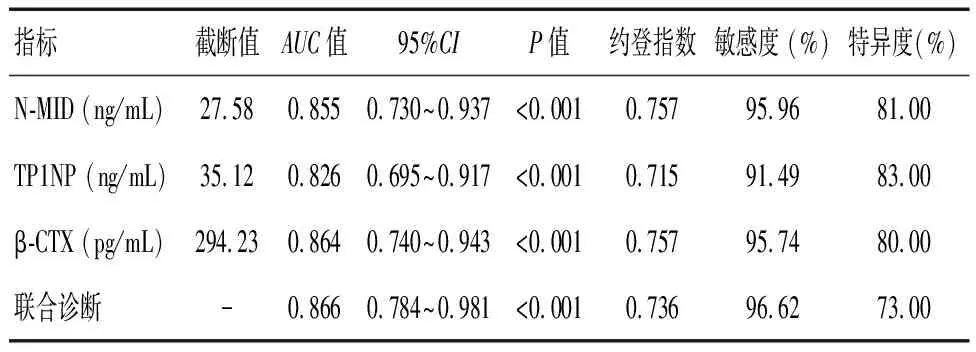
表6 T2DM合并骨质疏松症患者血清N-MID、TP1NP、β-CTX水平与冠状动脉钙化的ROC曲线分析
3 讨论
骨质疏松症患者与非糖尿病合并骨质疏松症患者相比,冠状动脉钙化进展的风险显著升高。本研究显示,骨质疏松症组N-MID、TP1NP均高于非骨质疏松症组(P<0.05),β-CTX低于非骨质疏松症组(P<0.05),提示N-MID、TP1NP、β-CTX与骨质疏松症存在关联性,这可能因为N-MID、TP1NP、β-CTX是骨质疏松预后的常见指标,其在血液中的稳定性高,浓度改变能够准确反映机体骨代谢状态[14]。临床骨钙素N端中分子的临床检测多用于判断血液中骨钙素含量,反映体内成骨能力[15]。N-MID是反映骨生成的特异度指标,其值的异常上升代表骨转化率升高,骨生成降低,进而增加骨质疏松风险。TP1NP反映Ⅰ型胶原的沉积情况,作为一项骨形成标志物,其值的异常上升代表骨细胞活性较差。β-CTX是骨组织细胞外基质Ⅰ型胶原羧基端降解产物,是反映骨转移或骨吸收的特异度指标。骨质疏松患者体内β-CTX异常降低,与其病情程度存在一定关联[16]。
本研究显示,钙化组患者的N-MID、TP1NP的数值均高于无钙化组(P<0.05),β-CTX均低于无钙化组(P<0.05),提示N-MID、TP1NP、β-CTX与患者冠状动脉钙化存在一定关联。N-MID能够促进机体血管钙化,导致骨质疏松患者发生心血管疾病的风险较高。骨钙素主要存在于向冠状动脉钙化发展的血管平滑肌细胞之中,其参与了动脉粥样硬化形成的调节,因此骨钙素在动脉粥样硬化的发生过程中具有重要作用。TP1NP本质上是一种氨基端肽链,在骨形成期间主要由I型前胶原进行转化时可被特异性蛋白酶所切除,其含量的高低代表I型前胶原合成量的程度,进而可以用来评估患者机体骨形成的状况。当TP1NP含量较高时,代表患者体内游离钙离子较多[17],而冠脉钙化与患者体内游离钙离子增多有关,故其可能与骨质疏松患者冠状动脉钙化存在一定的关联。β-CTX在脂肪、心脏中均有表达,能够调控心肌纤维化、血管新生等过程[18]。β-CTX可通过激活 ROSERK1/2-Runx2 信号通路,上调机体骨标志物的表达,进而促进血管钙化[19]。本研究提示糖尿病合并骨质疏松症可能造成成骨细胞活性降低,骨质疏松的风险增加,发生冠状动脉钙化钙化的风险增加。因此N-MID、TP1NP值越高,β-CTX值越低,患者的冠状动脉钙化病情也越严重。
本研究显示,N-MID、TP1NP、β-CTX联合诊断冠状动脉钙化的的准确度高于单一指标检测,究其原因可能为:当2型糖尿病合并骨质疏松症患者病情较为严重时,N-MID、TP1NP释放增多,可抑制成骨细胞合成I型胶原,诱导骨原细胞产生白细胞介素1(IL-1)、IL-6等炎性介质,促进破骨细胞生长,加速骨吸收,使得体内游离钙离子增多,进而附着于内壁,使得患者产生冠状动脉钙化[20]。其值特异性上升代表患者冠状动脉钙化越严重。N-MID、TP1NP的上升及β-CTX的降低能够用于预测冠状动脉钙化情况[21]。
综上,2型糖尿病合并骨质疏松症患者存在一定程度的冠状动脉钙化现象,均与患者的病情存在一定关联性,与N-MID、TP1NP值异常上升及β-CTX值异常降低有关,联合预测冠状动脉钙化的效能较好,具有一定的临床推广价值。
