敲低CASC9表达对食管鳞癌细胞增殖、迁移和侵袭的影响
2023-07-15李倩倩唐茂林赵世圣胡为民
李倩倩,唐茂林,赵世圣,胡为民
(川北医学院基础医学与法医学院免疫学教研室,四川 南充 637000)
食管癌是一个全球的重大健康挑战。最新的全球统计数据显示,食管癌是导致癌症相关死亡的第六大原因,也是全球第七大常见癌症[1]。在我国,尤其是川东北地区发病率及死亡率居高不下。长链非编码核糖核酸(long noncoding ribonucleic acid,lncRNA)是近十多年来肿瘤研究的新热点,部分lncRNA与肿瘤的密切相关性被越来越多的认识,其可在染色体重构、转录、转录后和表观遗传学水平上发挥重要调控作用,影响肿瘤细胞的增殖、迁移、侵袭、转移、耐药、复发等过程,在不同肿瘤中可表现出抑癌或促癌作用[2]。目前已发现癌症易感候选蛋白9(cancer susceptibility candidate 9,CASC9)与口腔鳞癌、胃癌、结直肠癌、肝癌、肺鳞癌等不同肿瘤的发生发展及耐药、预后都存在密切相关性[3]。本研究拟探讨CASC9对相关分子RAS同源家族成员A(RAS homolog family member A,RhoA)的表达调控情况,为进一步厘清食管鳞癌的病机开拓思路,亦可为临床诊断、治疗、预后判断找到更为安全有效的靶点。
1 材料与方法
1.1 材料
人食管鳞癌细胞系Eca109、TE-1、Kyse150购自中国科学院典型培养物保藏委员会细胞库。RPMI 1640培养基(Gibco);胎牛血清(四季青);无脂肪酸牛血清白蛋白(FAF-BSA,Sigma);RNA提取试剂盒SV Total RNA Isolation System(Promega);逆转录试剂盒(Perfect Real Time)、荧光定量PCR试剂盒(大连宝生物工程有限公司);Lipofectamine 2000(Invitrogen公司);兔抗人RhoA多克隆抗体(Proteintech公司);RIPA、BCA蛋白浓度测定试剂盒、ECL化学发光试剂盒(碧云天公司)。引物由上海生工生物工程有限公司合成,其他试剂均为进口或国产分析纯。
1.2 方法
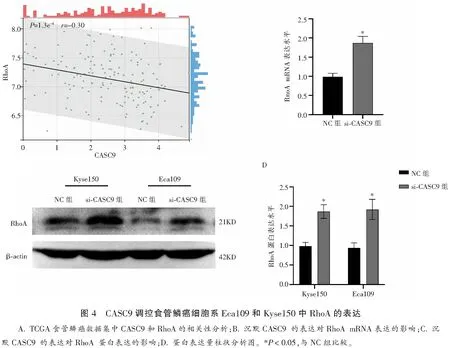
1.2.1 细胞生物信息学分析 从TCGA数据库中下载食管癌数据集,提取CASC9表达信息,分析数据集中CASC9在ESCC癌组织、癌旁组织和正常组织中的表达差异。使用TCGA数据进行CASC9与RhoA进行相关性分析,相关性采用Pearson系数检验。
1.2.2 细胞培养 Eca109、TE-1、Kyse150细胞常规培养于含10%胎牛血清、100 U/mL青霉素G和100 U/mL链霉素的RPMI 1640培养液中,置于37 ℃、5% CO2培养箱孵育中饱和湿度培养。
1.2.3 RT-qPCR检测si-CASC9的沉默效率及RhoA的mRNA表达水平 si-CASC9由上海吉玛制药技术有限公司合成,靶序列为:5′-GCCUGUGAUAGCAGAACAATT-3′。阴性对照(negative control,NC)序列为5′-UUCUUCGAACGUGUCACGUTT-3′。取CASC9高表达细胞株接种于6孔板(2×105个/孔),次日细胞融合度达50%时,用LipofectamineTM2000作为转染试剂,将NC和si-CASC9瞬时转染Eca109和Kyse150细胞,培养48 h后提取总RNA。反转录后采用RT-qPCR检测CASC9表达情况和RhoA的mRNA表达水平。见表1。

表1 RT-qPCR引物序列
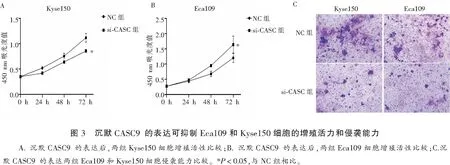
1.2.4 CCK8检测细胞活性 取对数生长期细胞消化并计数,接种于96孔板(10 000个/孔),次日细胞融合度达50%时,NC和si-CASC9瞬时转染Eca109和Kyse150细胞,每孔设置4个复孔,置于培养箱中培养,分别于转染后0、24、48、72 h按10 μL/孔加入CCK-8溶液,轻敲混匀,培养箱培养 2 h 后在酶标仪中检测 450 nm 波长下的吸光度。连续检测4 d后,绘制细胞生长曲线。实验重复3次。
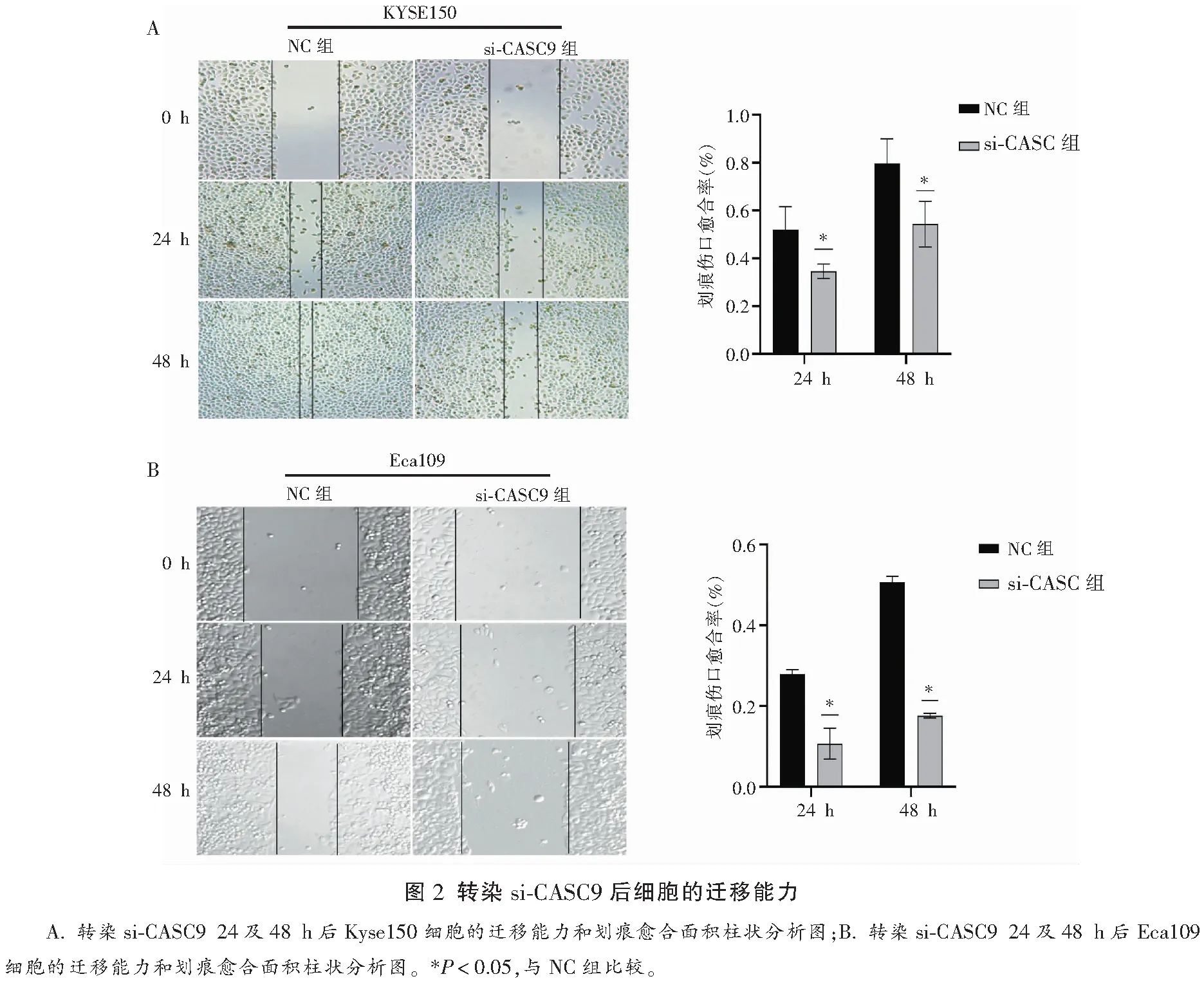
1.2.5 细胞划痕实验 接种细胞前在12孔板背面标记两条直线。将对数生长期的Kyse150细胞以2.5×105个/孔浓度接种入12孔板。24 h后用100 μL无菌枪头垂直于两条记号线划痕,磷酸缓冲盐溶液(PBS)润洗两次,倒置显微镜拍照记录0 h的划痕宽度。随后将NC和si-CASC9瞬时转染Eca109和Kyse150细胞,分别于转染后24 h、48 h再次拍摄划痕愈合情况,Image J软件分析划痕愈合百分比。实验重复3次,根据收集图片数据分析实验结果。
1.2.6 细胞侵袭实验 将NC和si-CASC9瞬时转染Eca109和Kyse150细胞,转染48 h后消化收集洗涤细胞,含0.1%BSA的1640培养液调整细胞密度为 1×106个/mL ,以100 μL/孔接种于铺胶后的Traswell上室,下室为完全培养基,培养箱培养24 h,固定后用结晶紫染色后计数拍照。实验重复3次。
1.2.7 Western blot 将si-CASC9组及NC组Eca109细胞瞬时转染72 h后收集细胞,提取总蛋白,取上清进行BCA总蛋白浓度测定。蛋白变性处理后SDS-PAGE电泳分离(每孔40 g等体积上样),半干转至PVDF膜(15 V,23 min),5%脱脂牛奶室温封闭2 h,一抗(1∶1 000)4 ℃摇床孵育过夜,二抗(1∶1 000)室温孵育60 min,ECL化学发光显色,用Image J图像分析软件进行数据分析。
1.3 统计学分析
2 结果
2.1 RT-qPCR检测3种食管鳞癌细胞株中CASC9的表达水平及si-CASC9的沉默效率
利用来自TCGA食管鳞癌数据集中CASC9表达量绘制箱型图,结果显示ESCA和ESCC组织中SAA1的表达高于正常组织。以2-△△Ct比较3种食管鳞癌细胞株中CASC9表达量,Kyse150表达量最高,TE-1中的表达量最低。3种细胞株间CASC9表达水平有统计学差异(P<0.05)。故选择Kyse150和Eca109两株细胞系进行后续实验。瞬时转染Kyse150和Eca109两株细胞后,荧光定量PCR检测NC组和si-CASC9组中CASC9的相对表达量。与NC组比较,si-CASC9组中CASC9表达量下降,两者比较差异有统计学意义(P<0.05)。见图1。

2.2 沉默CASC9对Eca109和Kyse150迁移能力的影响
Kyse150和Eca109细胞系si-CASC9组划痕愈合百分比在24及48 h均小于NC组,差异均有统计学意义(P<0.05)。见图2。

2.3 沉默CASC9对Eca109和Kyse150细胞体外增殖活力和侵袭能力的影响
si-CASC9组的Kyse150和Eca109细胞体外增殖活力低于NC组,差异有统计学意义(P<0.05)。si-CASC9组穿膜细胞数低于NC组,差异具有统计学意义(P<0.05)。见图3。
2.4 沉默CASC9后RhoA的mRNA和蛋白的表达情况
来自TCGA食管鳞癌数据集相关性分析显示CASC9与RhoA表达量呈负相关,差异有统计学意义(P<0.05)。RT-qPCR检测显示,与NC相比,si-CASC9 组中 RhoA mRNA及蛋白表达水平均上调,差异有统计学意义(P<0.05)。见图4。
3 讨论
lncRNA占据人类基因组的90%,虽然不具有蛋白质编码潜力,但可通过调节转录和表观遗传等过程,在个体生长发育、细胞增殖分化、肿瘤的发生发展等生理病理过程中均发挥重要的调控作用,是细胞功能的重要参与者[4],尤其是lncRNA与食管癌的相关研究颇受关注[5-8]。CASC9在肝癌、肺鳞癌、口腔鳞癌、胃癌、卵巢癌等不同肿瘤中均存在显著过表达,并且参与调控多种肿瘤恶性生物学行为、癌症复发、化疗耐药等过程[9-11]。Wu等[5]研究显示,CASC9 在食管鳞癌组织中的表达水平是癌旁组织的355倍,且CASC9表达量与肿瘤大小、TNM分期正相关,干扰CASC9表达可抑制癌细胞的侵袭和转移能力;Pan等[6]也提示,ESCC中CASC9的表达情况与肿瘤细胞分化程度相关,并通过下调CASC9的表达发现其可降低肿瘤细胞的转移能力;Liang等[7]也证实了CACS9在食管鳞癌中促进了肿瘤细胞的转移。
本研究显示,在3种不同食管鳞癌细胞株中CASC9表达水平存在差异,分化程度最低的Kyse150表达水平远高于另外两种高分化细胞株,表明CASC9的高表达与ESCC的低分化有关。而一般认为肿瘤细胞的分化程度与其增殖和转移能力呈负相关,而肿瘤转移潜能与肿瘤细胞在体内或体外的迁移能力呈正相关。本研究通过合成特异性siRNA成功干扰CASC9在Eca109和Kyse150中的表达后发现,肿瘤细胞的增殖、迁移和侵袭能力受到明显抑制,说明CASC9对肿瘤细胞的增殖、迁移和侵袭发挥重要的调控作用,可促进肿瘤细胞的恶性生物学行为,与Pan等[6]研究结果一致。Gramantieri等[10]在肝细胞癌的体外研究中同样采用干扰CASC9表达的方法,但肿瘤细胞的增殖率并没有出现明显差异;同时,干扰CASC9的表达反而促进了肿瘤细胞的迁移。究其原因可能是由于非编码RNA在不同的肿瘤和不同肿瘤亚型中表达情况不一致,调节模式亦存在不同。因此,CASC9在不同的肿瘤类型中发挥致癌或抑癌功能需要具体讨论,而lncRNA的这种调节特点在同为非编码RNA的microRNAs中已得到了广泛的证实。
Rho GTPases家族在细胞的迁移中发挥重要作用,RhoA是Rho GTPases家族中研究较多的分子之一。近年研究[12-14]显示,RhoA可能是一种抑癌基因。Lawson等[12]在小鼠乳腺癌模型的相关研究中发现RhoA基因敲减后增加了乳腺癌淋巴结和肺转移,提示RhoA在乳腺癌中具有潜在的肿瘤转移抑制能力;Alkasalias等[13]研究结果也发现敲除RhoA的成纤维细胞在体外失去了正常的抑制能力,在体内诱导肿瘤生长,在体外诱导肿瘤细胞迁移和增殖;Rodrigues等[14]指出RhoA失活导致肿瘤细胞迁移显著增加,且R8hoA蛋白水平降低与肿瘤分化不良相关。本研究发现,CASC9沉默表达后,通过上调RhoA的表达显著抑制Kyse150细胞的增殖和迁移能力,与上述研究[14]结果相似。CASC9的表达与食管鳞癌Eca109和Kyse150细胞的增殖、迁移和侵袭能力密切相关,且可能通过调节RhoA的表达来实现。
综上,CASC9是一种重要的致癌因子,沉默CASC9在Eca109和Kyse150中的表达能明显抑制肿瘤细胞的增殖和迁移和侵袭能力,可能与调节RhoA的表达相关。
