新型H3N3亚型禽流感病毒对鸡致病性与传播性研究
2023-07-15孙洪磊余海莉韩琪祺常昊宇屈亚锦刘思当刘金华
孙洪磊 佟 琪 余海莉 韩琪祺 李 涵 常昊宇 屈亚锦 徐 杰 刘思当 刘金华*
(1.中国农业大学 动物医学院/农业农村部禽流感等家禽重大疾病防控重点实验室,北京 100193;2.山东农业大学 动物科技学院,山东 泰安 271018)
禽流感病毒(Avian Influenza Virus,AIV)属于正粘病毒科A型流感病毒属,病毒基因组由8个单股负链RNA片段组成。当两种流感病毒共感染同一宿主细胞时,可能发生病毒基因片段的交换,又称基因重排,产生出新亚型或新基因型病毒,新型流感病毒对养禽业或人健康可能造成严重威胁。因此,及时发现新型流感病毒,开展病原流行病学调查及生物学特性研究,具有重要的现实意义。
H9N2亚型AIV是鸡群中最常见的病毒,具有多个进化谱系,其中BJ/94谱系H9N2病毒是我国鸡群中优势流行的病毒谱系[1-2]。2010年之后,BJ/94谱系的G57基因型H9N2病毒在我国鸡群中形成优势流行[3],该基因型病毒不仅对鸡的致病性增强,更为重要的是其可以作为基因供体为其他亚型流感病毒提供内部基因,产生出H7N9、H10N3、H10N8和H5N6等多种新型病毒[4]。2022年,我国鸡群中出现新型H3N8 AIV,这种病毒是由水禽源H3基因、北美野鸟源N8基因以及H9N2病毒内部基因三源重排形成[5]。该新型病毒可在鸡呼吸系统高水平复制,造成严重的病理损伤,并且由于鸡群普遍缺乏针对H3亚型AIV的特异性抗体,这种新型病毒迅速在我国鸡群中流行扩散[6-8],对养鸡业造成了较大经济损失。不同亚型低致病性AIV在我国鸡群中的共流行,有可能进一步发生基因重排而产生新型病毒,所以,开展我国鸡群AIV的病原学监测是科学防控禽流感的重要环节。
多年来,本研究团队高度关注新型流感病毒的出现与流行演化相关研究。临床调查发现,自2022年12月,在我国华东、华北、东北等地区发生产蛋下降的鸡群中检测出新型H3N3亚型AIV,经病毒全基因序列分析显示,该病毒为H3N8病毒与H10N3病毒重排产生。为揭示新型H3N3病毒对鸡的致病性与传播性特征,本研究将分离毒株进行了SPF鸡回归试验,并评价了病毒在SPF鸡群间的空气传播性,以期为该病的科学防控提供理论依据。
1 材料与方法
1.1 新型H3N3亚型病毒分离和鉴定
1.1.1病料采集及处理
2022—2023年对我国家禽养殖大省家禽养殖场开展AIV监测。对临床表现呼吸道症状、产蛋下降等典型流感发病特征的发病鸡采集口咽拭子,死亡鸡剖检取气管、肺脏等组织样品,置于含1 mL无菌PBS(含抗生素)的离心管中,低温运送至中国农业大学农业农村部禽流感等家禽重大疾病防控重点实验室进行病毒分离与鉴定。
1.1.2新型H3N3亚型病毒核酸鉴定
取口咽拭子重悬液或组织样品研磨液200 μL,RNA提取试剂盒提取核酸,实时荧光定量RT-PCR方法分别检测A型流感病毒(AIV)、新城疫病毒(NDV)和传染性支气管炎病毒(IBV)。
1.1.3新型H3N3亚型病毒分离鉴定
实时荧光定量RT-PCR检测流感病毒核酸阳性样品接种9日龄SPF鸡胚,35 ℃孵育48 h,4 ℃过夜收取尿囊液,通过血凝(HA)和血凝抑制(HI)试验检测流感病毒的HA亚型;提取尿囊液RNA,以流感病毒通用引物unit12反转录为cDNA,霍夫曼引物进行病毒全基因组测序[9]。
1.1.4新型H3N3亚型病毒基因遗传进化分析
将毒株全基因序列在GISAID数据库进行Blast序列比对,将各基因片段参考相关序列,使用FastTree 2.1.11软件绘制最大似然法基因进化树,Shimodaira-Hasegawa (SH)方法计算分支支持值,设置1 000次重复。
1.2 新型H3N3亚型病毒对鸡致病性和传播性试验
1.2.1试验设计
1)SPF鸡致病性试验:每组4周龄SPF鸡8只,将病毒以106EID50/0.2 mL剂量滴鼻感染,每日观察临床症状。感染后4 d剖检3只接种鸡,观察剖检变化,并取脏器进行病理组织学检测和病毒滴度测定。感染鸡于接种后1~14 d每天采集口咽拭子、泄殖腔拭子,进行病毒滴度测定。第14天采集鸡血,HI试验检测血清转阳情况。
2)SPF鸡空气传播性试验:每组4周龄SPF鸡10只,将病毒以106EID50/0.2 mL的剂量滴鼻感染5只鸡,24 h后将5只鸡放入隔壁笼饲养,两笼间隔30 cm,空气气流由攻毒组鸡向空气传播组鸡方向流动。每日观察临床症状,攻毒组、空气传播组鸡于接种后1~16 d每天采集口咽拭子、泄殖腔拭子,进行病毒滴度测定。第21天采集鸡血,HI试验检测血清转阳情况。
1.2.2组织病理切片及免疫组化
取致病性试验中剖检的SPF鸡鼻甲、气管、肺脏等组织置于4%多聚甲醛溶液中固定,制作石蜡切片,进行HE染色和免疫组化染色。免疫组化一抗为A型流感病毒NP抗体。
1.2.3病毒载量测定
口咽拭子、泄殖腔拭子加入1 mL含抗生素的无菌PBS,涡旋振荡后低速离心,取上清液进行10倍梯度稀释备用。取致病性试验中攻毒后4 d的SPF鸡鼻甲、气管、肺脏、肝脏、脾脏、肾脏、脑、十二指肠、胸腺、法氏囊和哈德氏腺,按照0.1 g/mL加入无菌PBS(含抗生素),组织匀浆机中充分研磨,低速离心,取上清液进行10倍梯度倍比稀释,将样品以0.2 mL/胚接种10日龄SPF鸡胚,每个稀释度接种3枚鸡胚,接种后于35 ℃孵育48 h,4 ℃过夜后收取鸡胚尿囊液测定血凝效价,按Reed-Muench法计算病毒滴度。
1.2.4统计分析
采用GraphPad Prism 9进行数据整理和作图,数据间显著性检验用SPSS Statistics 26.0进行分析。
2 结果与分析
2.1 新型H3N3亚型禽流感病毒的流行病学调查
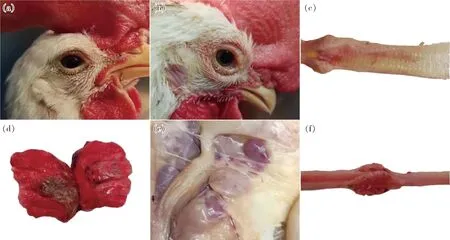
自2022年12月,陆续在我国华东、华北、东北等地区商品蛋鸡、肉种鸡、蛋种鸡等产蛋鸡群发生以呼吸道症状、产蛋急性下降为典型发病特征的传染性疾病。该病传播迅速,同一养殖场内不同栋舍鸡群一周以内均可发病。鸡群发病率高,死亡率低,约死亡1%~5%,主要引起产蛋率急性下降。发病鸡典型症状为眼结膜肿胀、张口呼吸,有呼吸啰音,产蛋率一周内急剧下降10%~40%,蛋壳质量差。剖检可见眼睑肿胀出血,鼻腔内有大量脓性分泌物,口腔黏膜潮红,腭裂内有大量黏液,气管弥漫性出血(图1(a)),黏膜层附着大量黏液(图1(b)),肺脏淤血实变(图1(c))、细支气管内有黄色纤维素性渗出(图1(d)),卵泡充血、出血、液化、破裂,形成卵黄性腹膜炎(图1(e)和(f)),输卵管黏膜充血,有分泌物渗出。病程持续时间超过1个月,产蛋率恢复较慢,后期死淘比例与饲养管理及控制继发感染密切相关。

(a)气管弥漫性出血;(b) 气管黏膜层附着大量黏液;(c) 肺脏淤血、实变;(d) 黄色干酪样渗出物堵塞细支气管;(e)(f) 卵泡充血、液化变形。(a) Trachea mucosa membrane bleeding;(b) Mucus in tracheal;(c) Pulmonary congestion;(d) Bronchioles blocked by exudate;(e) (f) Follicles congestion and rupture.
2.2 新型H3N3亚型病毒分离鉴定及基因遗传进化分析
H3N3亚型病毒最早检出时间为2022年12月,在华东地区发生产蛋下降的商品蛋鸡群中检出,随后陆续在华北、东北等多个地区发病蛋鸡检测出。根据病毒分离时间、地点,选择代表性毒株进行全基因测序,基因进化分析结果显示:H3N3病毒的HA基因属于欧亚禽分支,与2022年我国鸡群中流行的H3N8病毒处于同一进化分支,与同分支H3N8病毒基因相似性为96.9%~99.3%(图2);N3属于欧亚禽分支,与我国华东地区鸡群中流行的H10N3病毒处于同一进化分支,与同分支H10N3病毒基因相似性为96.9%~99.0%(图2)。测序毒株的6个内部基因均来源于我国鸡群中流行的G57基因型H9N2亚型病毒。所有H3N3病毒的HA裂解位点均为PEKQTR/GLF,无多碱性裂解位点插入。此研究表明,新型H3N8病毒在鸡群流行中与H10N3、G57基因型H9N2病毒发生了基因重排,产生出新型H3N3亚型病毒。

本研究测序毒株标记为红色,H3N8病毒标记为蓝色,H10N3病毒标记为绿色,用于鸡致病性和传播性试验的毒株标记星号。The H3N3 viruses isolated in the present study are indicated in red.H3N8 viruses are indicated in blue.H10N3 viruses are indicated in green.The viruses used in chicken experiment are marked with asterisk.
2.3 新型 H3N3病毒对SPF鸡致病性
本研究选择A/chicken/Eastern China/F1225/2022(EC/F1225)和A/chicken/Northern China/F2341/2023(NC/F2341)2株H3N3病毒进行SPF鸡致病性试验。结果显示:在14 d试验期内2株H3N3病毒感染鸡均未出现死亡,表明H3N3病毒为低致病性AIV。但2株病毒感染鸡均表现出明显的临床症状,如炸毛、缩颈、采食量下降等,部分鸡出现眼睛肿胀、流泪、出血病变(图3(a)和(b))。攻毒后4 d,每组取3只感染鸡进行剖检,可见鸡眼结膜红肿、哈德氏腺出血,鼻甲内有黏液渗出,气管黏膜潮红,有出血点及黏液分泌物(图3(c)),肺脏淤血、出血,并有局灶性实变(图3(d)),肾脏肿大,胸腺出血(图3(e))、盲肠扁桃体肿胀出血(图3(f))。病理组织学观察可见眼结膜上皮细胞坏死脱落,黏膜下层血管充血,大量炎性细胞浸润;鼻甲黏膜上皮细胞脱落,黏膜下层淋巴小结增生,大量炎性细胞浸润,毛细血管扩张充血(图4(a));气管黏膜上皮细胞纤毛坏死脱落,黏膜下层炎性细胞浸润,血管充血(图4(c));肺脏充血、出血,大量炎性细胞浸润,导致部分肺房实变(图4(e))。免疫组化病原原位检测可见鼻甲黏膜下层细胞(图4(b))、气管纤毛上皮细胞(图4(d))和肺脏终末细支气管上皮细胞(图4(f))有大量流感病毒抗原阳性信号。
(a)(b)眼睑肿胀;(c)气管出血;(d)肺脏淤血,局灶性实变;(e)胸腺出血;(f)盲肠扁桃体肿胀、出血。(a) (b) Eyelid swelling;(c) Trachea mucosa membrane bleeding;(d) Pulmonary congestion;(e) Thymic hemorrhage;(f) Cecal tonsil hemorrhage.
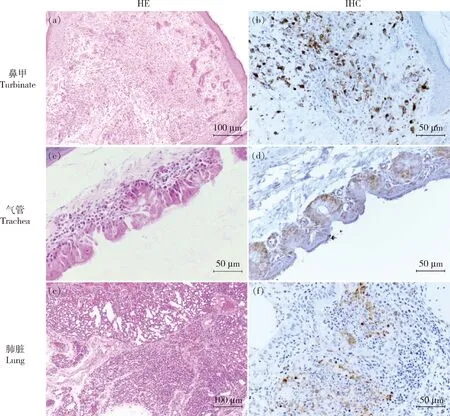
左侧为HE染色,右侧为流感病毒免疫组化染色。(a)(e)放大倍数为200倍,(b)(c)(d)(f)放大倍数为400倍。(a)鼻甲黏膜下层炎性细胞浸润;(b)鼻甲黏膜下层细胞阳性;(c)气管上皮细胞坏死脱落;(d)气管上皮细胞阳性;(e)肺脏实变;(f)肺脏终末细支气管上皮细胞阳性。Left is HE staining,and right is immunohistochemical (IHC) staining.Magnification of (a) (e) is 200×and (b) (c) (d) (f) is 400×.(a) Infiltration of inflammatory cells in submucosa of turbinate;(b) Extensive influenza viral NP distribution in the turbinate;(c) Necrosis of tracheal epithelial cells;(d) Extensive influenza viral NP distribution in the tracheal;(e) Severe interstitial pneumonia and bronchopneumonia;(f) Extensive influenza viral NP distribution in the lung epithelial cells.
脏器病毒分布及载量检测结果显示(图5),2株H3N3病毒均可在鸡的呼吸系统高效复制,其中鼻甲、气管中的病毒滴度显著高于肺脏中的病毒滴度(P<0.05),表明H3N3病毒更易在鸡的上呼吸道复制。此外,哈德氏腺、胸腺、脑等肺外脏器也可检测到病毒,说明H3N3病毒对鸡具有广泛的组织嗜性,可引起全身系统性感染。此结果表明,新型H3N3病毒可在鸡呼吸系统高水平复制,引起鸡呼吸系统严重病理损伤。
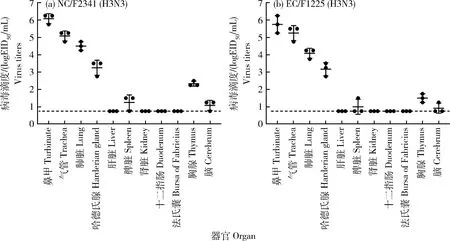
与X轴平行的虚线代表最低病毒检出量。Dashed lines parallel to X axis indicate the lower limit of virus detection.
2.5 新型H3N3亚型流感病毒在SPF鸡群中的空气传播性分析
流感病毒具备在动物群体间的空气传播能力是其能够形成优势流行的关键因素。本研究评价了H3N3亚型AIV在鸡群中的空气传播能力,同时以2株H3N8病毒A/chicken/Henan/F0316/2022(HN/F0316)和A/chicken/Anhui/FE12/2022(AH/FE12)作为对照。结果显示,2株H3N3病毒与2株H3N8病毒的排毒情况相似,2种病毒的攻毒组鸡口咽拭子和泄殖腔拭子中均可检测到排毒,口咽的排毒量显著高于泄殖腔(P<0.05),排毒期最长为7 d,排毒高峰在2~5 d(图6)。在21 d的试验周期内,2株 H3N8病毒的空气传播组鸡既未检出排毒也没有发生血清抗体转阳,表明H3N8病毒不能在鸡群中有效空气传播。值得注意的是,H3N3病毒EC/F1225在感染后7 d开始发生空气传播,第8天,2株H3N3病毒空气传播组的鸡均出现排毒,排毒时间持续6~8 d,HI抗体检测结果显示2株H3N3病毒传播组鸡均为HI抗体阳性。此结果表明新型H3N3亚型病毒主要通过鸡口腔排毒,且具备鸡群间空气传播的能力,这可能导致其在鸡群中快速流行扩散。
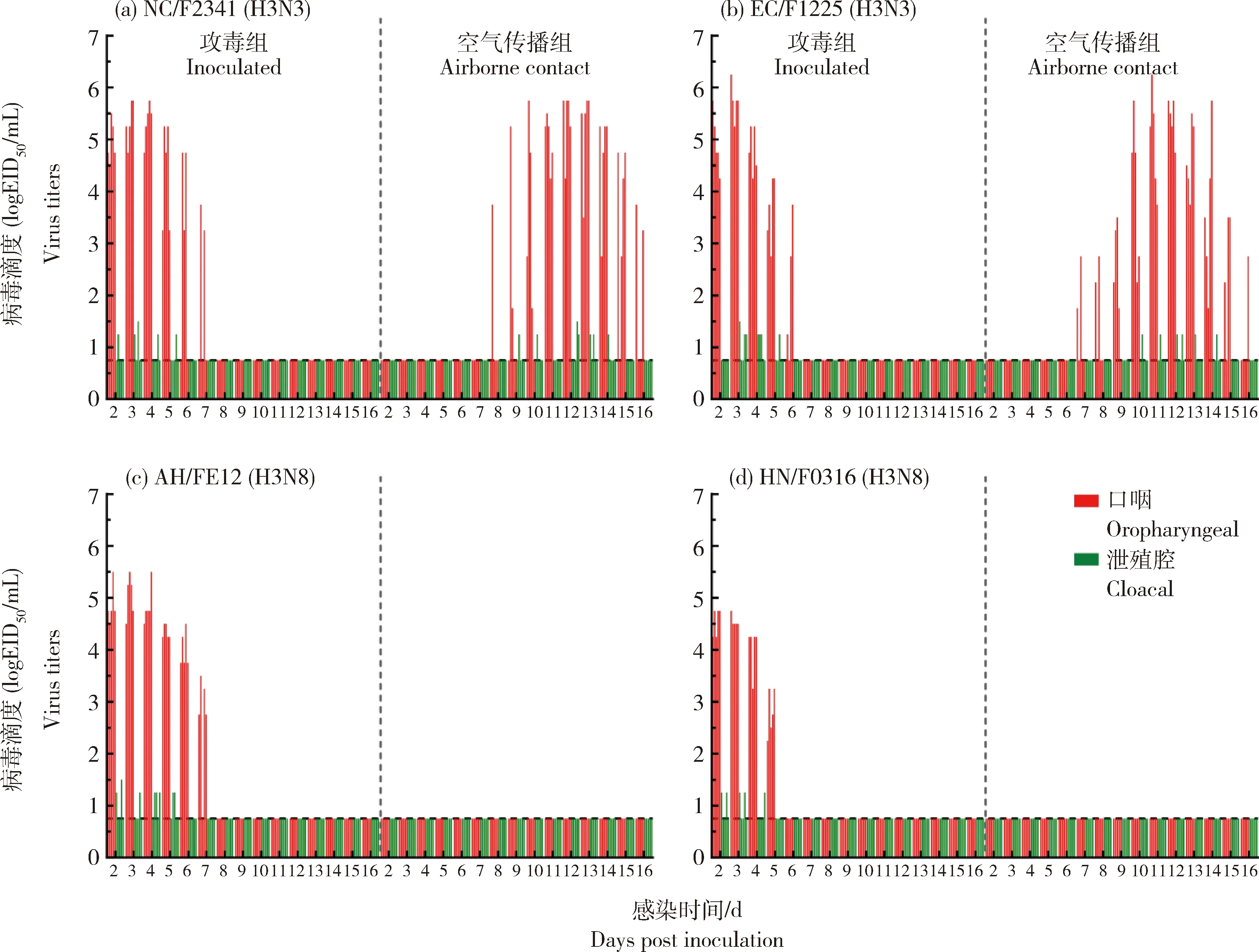
与X轴平行的虚线代表最低病毒检出量,攻毒组与空气传播组鸡样品由与Y轴平行的虚线分隔。Dashed lines parallel to X axis indicate the lower limit of virus detection,dashed lines parallel to Y axis separate inoculated and airborne contact groups of each virus.
3 讨 论
本研究通过对我国鸡群疫病监测,发现一种新型H3N3病毒,该病毒为我国鸡群中流行的H3N8病毒与H10N3病毒重排产生,内部基因来源于H9N2病毒。H3N3病毒可在鸡呼吸系统高水平复制、排毒,引起呼吸系统病变,更为重要的是H3N3病毒具备在鸡之间空气传播的能力,这种传播能力的提升有可能促使H3N3病毒在鸡群中快速扩散,形成流行。
基因重排是产生新型流感病毒的重要方式,2022年在我国发病鸡群中发现了新型H3N8流感病毒,这种新型AIV为水禽源H3Ny病毒、野鸟源HxN8病毒与G57基因型H9N2病毒三源重排组成[5]。由于携带了H9N2病毒的6个内部基因,H3N8病毒可在鸡呼吸系统有效复制、排毒,并引起感染鸡临床发病[6]。自出现后,H3N8病毒由南向北在鸡群中快速流行散播,并与不同地区鸡群中流行的H9N2病毒内部基因动态重排,产生出多种基因型病毒[5-8]。本研究中检测到的H3N3病毒HA基因来源于H3N8病毒,NA基因来源于H10N3病毒,H10N3病毒主要在华东地区鸡群中地方性流行[10],推测H3N8病毒在流行过程中与H10N3病毒在鸡宿主中发生共感染,重排产生出新型H3N3病毒。由于我国鸡群中存在H9N2、H10N3、H10N8和H7N9等多种亚型流感病毒流行,因此病毒之间相互重排产生出新基因型、新亚型病毒的几率很大,需要高度关注出现的新型病毒。
本研究中检测出的H3N3病毒多数来源于产蛋期蛋鸡,推测可能与产蛋鸡生理和体内激素水平变化导致对流感病毒易感性增加有关。致病性结果显示,虽然新型H3N3病毒不能致死SPF鸡,但病毒可引起鼻甲、气管、肺脏、眼结膜严重的病理损伤,造成呼吸系统黏膜完整性的破坏。H3N3病毒感染产蛋鸡直接造成的组织损伤以及细菌、支原体等病原继发感染都会引起剧烈的炎症反应,出现体温急剧升高,造成卵泡充血、液化、破裂,最终形成卵黄性腹膜炎,不仅短时间内造成鸡群产蛋率急性下降,而且预后恢复时间长,造成较大的经济损失。应注意的是,H3N3病毒引起鸡群的发病表现与H9N2等低致病性AIV类似,尚需对临床上表现呼吸道症状的肉鸡、育成期蛋鸡持续监测,掌握H3N3病毒在不同品种鸡群中的流行和致病情况。
空气传播和直接接触传播是流感病毒的主要传播方式。流感病毒在野生水禽宿主间主要通过粪-口途径直接接触传播,不同亚型流感病毒在鸡群间的传播能力差异很大。H5Ny、H7N9亚型高致病性流感病毒虽然对鸡致病性强,但其主要通过直接接触传播,不能在鸡之间有效空气传播,因此扩散速度慢[11-12]。多数H9N2病毒可在鸡群中有效空气传播,这是其能够在鸡群中形成优势流行的重要原因。研究发现,HA-K363和PA-L672变异是决定H9N2病毒空气传播的关键因素[13]。本研究中发现,虽然H3N3和H3N8病毒都重组了H9N2病毒的内部基因,均具有PA-L672变异,但其NA基因的差异导致病毒的传播特性明显不同,H3N3病毒可在鸡群中发生空气传播,而H3N8病毒不能在鸡群中有效空气传播。NA蛋白具有神经氨酸活性,在病毒感染过程中可以切割呼吸道上皮细胞表面的黏蛋白和糖蛋白分子上的唾液酸,促进病毒感染;在病毒出芽释放过程中切割宿主细胞表面以及新生病毒粒子表面的唾液酸,促进病毒释放[14]。因此,NA蛋白对于流感病毒的致病性、传播性、跨种传播能力具有重要作用。相比于野鸟源的N8蛋白,鸡源N3蛋白显然更适应鸡宿主,不同亚型NA蛋白导致病毒传播性差异的分子机制尚需要深入研究。
总之,鉴于新型H3N3病毒对鸡群具有较强的致病性和传播性,急需开展系统的病原学和血清学监测,掌握病毒的流行区域和感染宿主范围,研发快速诊断方法和疫苗,制定科学合理的防控措施,及早将这种新型流感病毒控制在流行初期。
4 结 论
本研究发现新型H3N3流感病毒是由鸡群中流行的H3N8病毒与H10N3病毒重排产生,内部基因来源于H9N2病毒。新型H3N3流感病毒在我国鸡群中已形成流行趋势并主要引起蛋鸡临床发病,病毒可在鸡呼吸系统有效复制,造成严重的病理损伤,且可在鸡群中有效空气传播,有可能成为鸡群中新的优势流行病毒,对我国家禽养殖业威胁较大,需要进一步开展其防控研究。
