肺炎克雷伯菌肝脓肿与非肺炎克雷伯菌肝脓肿的特征比较研究*
2023-07-14张吟眉鲁敏仪郑佳佳
徐 彤,张吟眉,鲁敏仪,郑佳佳
北京大学第三医院检验科,北京 100191
肝脓肿是由多种病原微生物引起的临床上较为常见的肝脏感染性疾病,临床上以细菌引起的细菌性肝脓肿(BLA)较为常见[1-2]。既往研究表明,在美国和欧洲国家引起BLA的主要病原菌是大肠埃希菌和链球菌属[3-4]。肺炎克雷伯菌(KP)是近年来引起社区获得性血流感染的常见条件致病菌,并逐渐成为BLA的主要致病菌[5]。而在肺炎克雷伯菌肝脓肿(KPLA)患者标本中分离出的高毒力肺炎克雷伯菌(hvKP)又成为KPLA的主要病原菌。hvKP还可以引起除BLA外其他部位的转移性感染[6]。本研究收集并分析了本院2016年1月至2020年12月收治的215例肝脓肿患者的临床资料及实验室检查结果,比较KPLA患者和非肺炎克雷伯菌肝脓肿(NKPLA)患者,以及KPLA患者中合并糖尿病、胆道疾病、胃肠道疾病各亚组的临床特征及实验室检查指标结果,为KPLA的诊断与治疗提供参考依据。
1 资料与方法
1.1一般资料 回顾性分析本院在2016年1月至2020年12月收治的215例肝脓肿患者的临床资料。BLA诊断标准:(1)患者常出现以发热、畏寒或寒战、肢体乏力为主的临床表现或以肝区叩痛为主的体征;(2)腹部超声等影像学检查发现患者肝部有脓肿病灶;(3)患者的血培养或脓肿部位引流出的穿刺液细菌培养结果为阳性;(4)经抗菌药物治疗后患者的症状有所减轻;(5)经穿刺引流或手术后证实为肝脓肿;(6)排除其他相关疾病和其他类型肝脓肿[7]。糖尿病的诊断参照《中国2型糖尿病防治指南(2020年版)》中糖尿病诊断标准[8]:典型糖尿病症状加上随机血糖≥11.1 mmol/L,或加上空腹血糖≥7.0 mmol/L,或加上口服葡萄糖耐量试验(OGTT)2 h血糖≥11.1 mmol/L,或加上糖化血红蛋白(HbA1c)≥6.5%。
1.2方法
1.2.1资料收集及分组 查阅215例肝脓肿患者的完整病历资料,结合KPLA患者病历信息,汇总分析其基本资料(年龄、性别)、临床表现(发热、寒战或畏寒、腹痛等)、基础疾病(是否患糖尿病、肝胆疾病、胃肠道疾病等)、有无并发症;收集患者实验室检查指标[白细胞计数(WBC)、血红蛋白(Hb)、血小板计数(PLT)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、γ-谷氨酰转肽酶(GGT)、中性粒细胞绝对值(NEUT#)、葡萄糖(GLU)、淋巴细胞绝对值(LYMPH#)]结果、治疗方式、抗菌药物药敏试验结果、治疗时间及患者的预后情况等信息。患者按照病原学检测结果分为KPLA组和NKPLA组。治疗效果划分如下:(1)好转为病原学结果阴性及全身感染症状消失、脓肿病灶缩小、炎症指标水平下降;(2)死亡;(3)其他(未愈/转院等)。
1.2.2细菌培养、鉴定及药敏试验 使用BD BACTEC FX全自动血培养仪对血液标本进行培养,将血培养阳性瓶中的血液接种于中国蓝平板上以分离细菌,使用VITEK2 Compact全自动微生物分析系统及BD-Bruker MALDI Biotyper微生物质谱快速分析系统对分离出的菌种进行鉴定。采用微量肉汤稀释法(VITEK2 Compact全自动微生物分析系统)检测常用抗菌药物的最低抑菌浓度(MIC),采用纸片扩散法检测抑菌环直径。依据美国临床和实验室标准协会(CLSI)相关文件对KP的药敏试验结果进行判断,将细菌的药敏试验结果分为敏感、中介和耐药。

2 结 果
2.1患者基本资料 本研究收集的215例肝脓肿患者:98例病原学检测结果阳性,即诊断为BLA,其中72例临床标本细菌培养结果为KP阳性,26例为其他致病菌阳性;84例病原学检测结果阴性;33例未做相关病原学检查。肝脓肿患者平均年龄(57.66±16.06)岁,其中男140例,女75例。72例KPLA患者的平均年龄为(57.64±13.95)岁,其中男42例,女30例;26例NKPLA患者的平均年龄为(58.15±17.08)岁,其中男19例,女7例。KPLA组与NKPLA组的年龄与性别比较,差异无统计学意义(P>0.05)。
2.2肝脓肿患者病原学特征及KPLA药敏试验结果 215例肝脓肿患者中164例进行血培养,阳性59例(35.98%);75例进行引流液/穿刺液/脓液培养,阳性51例(68.00%);有12例患者血培养和引流液/穿刺液/脓液培养同时阳性。两种样本的阳性率差异有统计学意义(P<0.01)。72例KP阳性患者所分离的菌株对大部分β-内酰胺类、喹诺酮类、大环内酯类抗菌药物敏感率较高,而其中有2株KP具有较高的耐药性,KPLA患者分离的菌株药敏试验结果见表1。其他致病菌阳性有26例,包括:大肠埃希菌9例、奇异变形杆菌1例、舟形梭杆菌1例、具核梭杆菌1例、人葡萄球菌1例、粪肠球菌1例、戊糖片球菌1例、鹑鸡肠球菌D群1例、鸟肠球菌1例、金黄色葡萄球菌2例、屎肠球菌1例、咽峡炎链球菌1例、中间链球菌3例、格氏链球菌1例、微小小单胞菌1例。

表1 72株KPLA患者分离的KP药敏试验结果[n(%)]
2.3KPLA组与NKPLA组的临床特征及实验室检查结果比较 与NKPLA患者相比,KPLA患者多合并糖尿病,且患者临床表现中畏寒或寒战、乏力的比例较高(P<0.05),NKPLA患者多合并胆道疾病(P<0.05)。两组患者治疗方法、治疗时间和治疗效果比较,差异无统计学意义(P>0.05)。对KPLA组与NKPLA组的实验室检查结果进行比较,KPLA组的Hb、GLU、AST水平高于NKPLA组(P<0.05)。见表2、3。
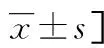
表2 KPLA组与NKPLA组的临床特征比较[n(%)或
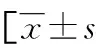
表3 KPLA组与NKPLA组的实验室检查结果比较或M(P25,P75)]
2.4KPLA组不同合并症患者的临床特征分析 本研究中,72例KPLA患者中合并糖尿病的患者有37例(51.39%),合并胆道疾病的患者有11例(15.28%),合并胃肠道疾病的患者有11例(15.28%)。合并糖尿病的KPLA患者的治疗时间相比未合并糖尿病的KPLA患者延长(P<0.05)。合并胆道疾病的KPLA患者治疗后好转的比例低于未合并胆道疾病的KPLA患者(P<0.05)。合并胃肠道疾病的KPLA患者年龄大于未合并胃肠道疾病的KPLA患者(P<0.05),二者治疗时间及效果差异无统计学意义(P>0.05)。见表4~6。
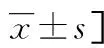
表4 合并糖尿病与未合并糖尿病KPLA患者的临床特征比较[n(%)或
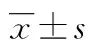
表5 合并胆道疾病与未合并胆道疾病KPLA患者的临床特征比较[n(%)或或M(P25,P75)]
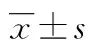
表6 合并胃肠道疾病与未合并胃肠道疾病KPLA患者的临床特征比较[n(%)或或M(P25,P75)]
2.5不同合并症情况KPLA患者的实验室检查结果比较 KPLA患者中,合并糖尿病患者的GLU、WBC、NEUT#高于未合并糖尿病患者(P<0.05),AST水平低于未合并糖尿病患者(P<0.05);合并胆道疾病的KPLA患者的PLT及GGT水平高于未合并胆道疾病的患者((P<0.05))。合并与未合并胃肠道疾病的KPLA患者实验室指标比较,差异均无统计学意义(P>0.05)。见表7~9。
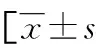
表7 合并糖尿病与未合并糖尿病KPLA患者的实验室检查结果比较或M(P25,P75)]
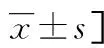
表8 合并胆道疾病与未合并胆道疾病KPLA患者的实验室检查结果比较[M(P25,P75)或
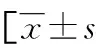
表9 合并胃肠道疾病与未合并胃肠道疾病KPLA患者的实验室检查结果比较或M(P25,P75)]
3 讨 论
近30年来,KP已经成为BLA的主要致病菌[9],本研究结果显示,本院2016年1月至2020年12月的98例BLA患者中73.47%(72/98)由KP引起,26.53%由其他致病菌引起,与既往多数研究结果一致[5,10]。
本研究中72例KPLA患者中有51.39%合并糖尿病,与NKPLA患者相比,比例显著升高,这与以往的研究结果一致[11]。糖尿病患者容易感染KP、引起BLA的原因可能是机体长期处于高血糖状态,使血液中的白细胞抗感染的趋化作用和吞噬作用被部分抑制,患者机体的免疫系统功能减弱,增加了机体感染细菌的风险[12]。实验室检查结果显示,合并糖尿病的KPLA患者的WBC和NEUT#高于未合并糖尿病的患者,提示合并糖尿病患者的炎症反应更为明显。BLA患者可能发生应激性血糖升高,从而加重糖尿病病情[13];同时也有研究发现合并糖尿病的BLA患者隐源性感染率高于胆管感染率和血源感染率[12],以上原因可能导致合并糖尿病的KPLA患者治疗时间延长。因此,对于合并糖尿病的KPLA患者,在治疗期间更要注意控制患者的血糖水平。
本研究中,合并胆道疾病的KPLA患者比例显著低于NKPLA患者。有研究发现,目前大肠埃希菌仍是引起胆道感染的主要致病菌[14]。最初认为BLA的致病菌可能来自胆道感染。当胆道或胆囊等部位发生炎症感染时,引起胆道感染的细菌可以随血液沿着胆管上行至肝脏,从而引起BLA[13]。将合并胆道疾病与未合并胆道疾病KPLA患者进行比较,发现合并胆道疾病患者的PLT及GGT水平更高。
近年来从KPLA患者血液或穿刺液标本中分离出的KP大多是hvKP。目前认为携带rmpA和气杆菌素基因的KP通常具有高毒力,但是否为hvKP还需要结合患者的临床症状加以分析。
KP的肠道定植也是引起KPLA的可能致病因素。通过对比BLA患者使用抗菌药物前的粪便标本与健康人的粪便标本,发现部分患者粪便中分离的KP与健康人粪便中的KP具有相同的血清型和基因型,且同时具有毒力,表明健康人的肠道中也存在hvKP的定植[15]。目前已有动物模型证明了hvKP能够从胃肠道易位到其他无菌部位,从而导致脓肿发生[16],但并不是所有定植于肠道的hvKP都可以引起以KPLA为首发症状的侵袭综合征,常见的可能致病因素有是否患胃肠道疾病,是否有手术史等侵袭性操作。有研究发现,胃镜等检查可能会增加BLA的患病风险[17],KP定植数量增加及机体的免疫功能下降等因素可能在这一过程中发挥了作用。本研究将合并胃肠道疾病的与未合并胃肠道疾病的KPLA患者的临床资料进行对比发现,合并胃肠道疾病的KPLA患者除年龄较大(P=0.034)外,其余方面差异无统计学意义(P>0.05),其具体的致病机制还需要进一步探究。
KPLA的常见治疗方式有针对病原菌的抗菌药物治疗、液化后的脓肿穿刺引流和外科手术治疗。发病初期还未明确病原菌时,临床常选择广谱抗菌药物,脓肿符合穿刺引流条件后可及时对脓肿进行穿刺引流,并将穿刺液或脓液进行细菌培养以明确致病菌。本研究分离出的72株KP中,大部分菌株对除氨苄西林外其他常见抗菌药物敏感,有2株(2.8%)依据药敏试验结果判断为耐碳青霉烯类肠杆菌科细菌(CRE)。目前临床常用第2代、3代头孢菌素对轻症的BLA患者进行治疗,重症患者可采用碳青霉烯类药物治疗。近20年来,CRE的产生对全世界的公共卫生构成了严重威胁。有研究表明,感染CRE的患者预后差,病死率高[18]。近期研究发现hvKP的检出率呈上升趋势[19-20],因此在治疗过程中应时刻关注细菌耐药性的变化,避免耐药株的流行。
综上所述,合并糖尿病的KPLA患者炎症反应更为明显,在治疗时应同时注重控制患者的血糖水平。未合并胆道疾病的KPLA患者的治疗效果好于合并胆道疾病的KPLA患者。使用抗菌药物治疗感染高耐药性菌株的KPLA患者时,需关注细菌耐药性的变化。
