eIF5A基因敲除MARC-145多克隆细胞系的建立及其对PRRSV增殖的影响
2023-07-14李华玮王旭英井汇源乔宏兴郭科威侯文静
李华玮 王旭英 井汇源 万 博 乔宏兴 郭科威 侯文静
(1.河南牧业经济学院 食品与生物工程学院,郑州 450046;2.河南牧业经济学院 畜产品质量安全技术研究院,郑州 450046;3.河南牧业经济学院 动物医药学院,郑州 450046;4.河南农业大学 动物医学院,郑州 450046)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)引起的猪繁殖障碍和呼吸系统的急性、高度接触性传染病[1]。PRRSV属于动脉炎病毒科、动脉炎病毒属,单股正链、不分节段的RNA病毒,有囊膜包裹,基因组全长为15.4 kb,编码 10个开放阅读框[2]。根据抗原的差异性PRRSV分为两种类型,即PRRSV I型和PRRSV II型,两种基因型间氨基酸的相似性78%~81%[3-4]。PRRS传染性强、流行范围广、危害持久,严重损害世界养猪业的健康发展[5-7]。PRRSV在我国不断变异、进化,多种毒株并存的局面让PRRS防控成为棘手问题。病毒没有自身的复制体系,必须通过劫持宿主的翻译系统完成自身复制,真核生物翻译起始因子(Eukaryotic translation initiation factors,eIFs)则是帮助病毒实现这一生物学过程的关键宿主蛋白。大量研究表明,eIFs与多种病毒存在直接或间接的相互作用[8-10]。病毒可以通过调控eIFs表达及修饰,抑制核糖体对宿主 mRNA招募或影响翻译起始复合体活性等方式,创造有利于自身复制的环境。
真核翻译起始因子5A(Eukaryotic translation initiation factor 5A,eIF5A)广泛存在于各种真核细胞中,是唯一包含羟脯胺酸修饰的蛋白[11-12]。羟脯胺酸修饰合成过程需要脱氧羟脯胺赖氨酸合酶和脱氧羟脯胺赖氨酸羟化酶2个关键酶参与[13]。只有经过羟脯胺酸修饰,eIF5A才具有活性。有研究表明eIF5A与病毒感染密切相关,人免疫缺陷病毒(Human immunodeficiency virus,HIV)辅助因子Rev蛋白能与eIF5A结合,eIF5A功能缺失突变体阻断了Rev蛋白核输出和HIV的复制[14]。酵母双杂交技术进一步发现HIV Rev蛋白通过eIF5A与核糖体蛋白L5形成复合物而获得病毒mRNA核输出路径,用核糖体蛋白L5抗体处理细胞会导致病毒mRNA不能正常运输至细胞质,HIV结构蛋白不能合成[15]。另有研究表明,埃博拉病毒(Ebola virus,EBOV)需要多胺和eIF5A羟脯氨酸修饰进行复制[16]。使用脱氧羟脯胺赖氨酸合酶的小分子抑制剂GC7处理细胞能有效地阻断EBOV复制,并使其滴度下降约30%[17]。eIF5A在登革热病毒感染时起到了防止细胞死亡的作用,促进登革热病毒在细胞中的持续性感染[18]。课题组前期研究表明,PRRSV感染PAMs后eIF5A等翻译相关蛋白显著下调[19],但eIF5A是否能调控PRRSV复制尚未可知。
CRISPR/Cas9系统首次在古生物和细菌中被发现,其作用是降解序列特异性DNA[20-25]。本研究利用CRISPR/Cas9系统构建敲除eIF5A基因的MARC-145多克隆细胞系,通过间接免疫荧光(IFA)、荧光定量PCR(Real-time PCR)、免疫印迹(Western blot)和病毒滴度(TCID50)测定来验证病毒在敲除eIF5A的MARC-145-△eIF5A多克隆细胞系的增殖情况。本研究为探索eIF5A调控PRRSV增殖的分子机制提供理论基础,也为抗PRRSV新药的筛选提供新思路。
1 材料与方法
1.1 试验材料
1.1.1细胞、病毒及载体
HEK293T和MARC-145细胞均由河南省非常规饲料资源创新利用重点实验室保存并稳定传代。PRRSV HN07-1毒株为河南农科院动物免疫学重点实验室惠赠(GenBank登陆号为KX766378.1)。慢病毒载体LentiCRISPR v2、辅助质粒Pmd2.G和psPAX2均购自Addgene公司。
1.1.2主要试剂
质粒提取试剂盒购自TIANGEN公司,限制性内切酶BsmbⅠ、DMEM细胞培养液购自Thermo Fisher;T4 DNA连接酶、T7E1酶购自NEB公司;DNA凝胶回收试剂盒、ECL发光试剂盒、嘌呤霉素、Lipo8000TM转染试剂、RIPA裂解液购自上海碧云天生物技术有限公司;胎牛血清购自杭州四季青有限公司;反转录试剂盒购自TaKaRa 公司;荧光定量检测试剂盒购自Roche公司;Trizol试剂购自Invitrogen公司;MTS试剂盒购自Promega公司;FITC标记的羊抗鼠IgG及羊抗兔IgG、HRP标记的羊抗鼠及羊抗兔IgG购自Abbkine公司;PRRSV N蛋白单克隆抗体购自VMRD公司;eIF5A蛋白单抗购自Cell Signaling公司。
1.2 试验方法
1.2.1sgRNA序列的设计与合成
利用NCBI(http:∥www.ncbi.nlm.nih.gov/)网站查阅猪基因组eIF5A序列(GenBank登陆号为XM_005655285.2),然后根据网站(http:∥crispr.mit.edu/)设计相关sgRNA基因序列(表1),分别命名为sgRNA1-4,经软件预测和预试验,sgRNA1 编辑效率最高,可用于做后续试验。
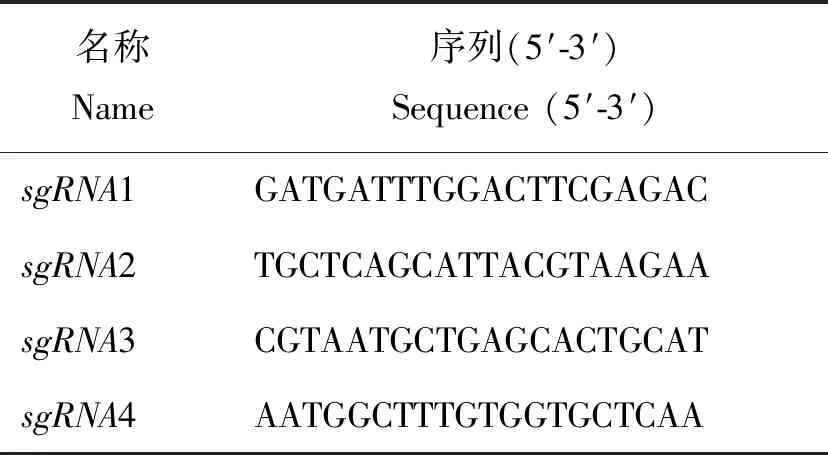
表1 sgRNA序列信息Table 1 Information of sgRNA sequence
1.2.2LentiCRISPRv2-sgRNA载体构建
使用BsmbⅠ限制性内切酶,在37 ℃的条件下对LentiCRISPR v2载体酶切。4 h后使用琼脂糖凝胶电泳检测并用DNA回收试剂盒纯化。利用T4 DNA连接酶,将回收产物与经退火形成双链的sgRNA1在16 ℃条件下连接。将连接产物转化至感受态细胞E.ColiTop10,随后涂布于氨苄抗性的固体LB平板并培养过夜,挑取单克隆震荡培养,并提取质粒。将重组质粒命名为LentiCRISPRv2-sgRNA1,挑取单个菌落进行基因测序鉴定,测序正确的质粒用于后续试验。
1.2.3eIF5A敲除多克隆细胞系的构建
将生长对数期的HEK293T细胞均匀接种至10 cm细胞培养皿,待细胞密度达80%左右时,将重组质粒LentiCRISPRv2-sgRNA1与慢病毒包装质粒pMD2.G、psPAX2按一定的比例(4∶3∶1)共转染HEK293T细胞,同时设立转入空载体的对照组细胞,2 d后收集慢病毒。将MARC-145细胞接种至12孔细胞板,待生长密度达到40%时,将MOI=1的慢病毒接种至MARC-145细胞。培养24 h,换用含有7 μg/mL的嘌呤霉素生长液。对照组细胞彻底死亡后,消化收集试验组细胞,转移至含有5 μg/mL嘌呤霉素生长液中扩大培养。获得的细胞使用有限稀释法进行筛选:用含有5 μg/mL嘌呤霉素生长液稀释细胞,将细胞悬液加入96孔细胞培养板中,每孔加0.1 mL(约5.5个细胞/孔)。使用含有5 μg/mL嘌呤霉素生长液作倍比稀释,直至使每孔含一个细胞。培养7~10 d后,选择单个克隆生长的阳性孔再扩大培养。
1.2.4eIF5A基因敲除多克隆细胞系的鉴定
1.2.4.1 Real-time PCR检测
收集对照组细胞和筛选得到的细胞,使用Trizol法提取细胞RNA并反转录,将得到的cDNA作为模板进行Real-time PCR检测,反应程序为:95 ℃ 5 min预变性,95 ℃ 15 s、65 ℃ 30 s、72 ℃ 1 min 重复50个循环,最后60 ℃ 1 min、95 ℃ 15 s完成检测。引物信息见表2。

表2 本研究中PCR引物序列信息Table 2 PCR primer sequences in the study
1.2.4.2T7E1核酸内切酶检测
以提取的基因组为模板,利用设计好的引物进行PCR扩增(表2),反应条件为:95 ℃ 30 s预变性,95 ℃ 15 s,65 ℃ 30 s,72 ℃ 30 s重复30个循环。扩增产物经琼脂糖凝胶电泳检测后,胶回收试剂盒对PCR产物进行纯化。使用T7E1酶,37 ℃ 孵育1 h后,通过琼脂糖凝胶电泳检测酶切产物。
1.2.4.3 Western blot检测
将筛选细胞均匀传代至平皿中,待细胞长满平皿80%后,消化收集至EP管,每管样品约107个细胞,用RIPA裂解液冰上超声细胞,加入5×上样缓冲液100 ℃煮沸5 min后进行SDS-PAGE,将条带转印至PVDF膜上,5%脱脂奶封闭1 h,然后以eIF5A兔源单抗作一抗(1∶1 000稀释使用),HRP标记的羊抗兔IgG为二抗(1∶5 000稀释使用)37 ℃孵育1 h,最后使用ECL化学发光试剂显影成像。
1.2.5eIF5A基因敲除后MARC-145细胞活性的影响
MTS法可用于检测细胞增殖活性和细胞毒性,利用活细胞中的线粒体脱氢酶将MTS 还原产生可溶性的褐黄色物质这一反应,测定490 nm 波长处OD值,推算出细胞的存活率。分别将筛选得到的细胞和对照组细胞,按每孔1×104的数量接种至96孔板中,每孔加入10 μL MTS试剂,轻微震荡混匀,然后于培养箱中37 ℃孵育4 h,用酶标仪于490 nm处测定OD值。
1.2.6eIF5A敲除对PRRSV滴度的影响
将筛选得到的细胞命名为MARC-145-△eIF5A细胞系,以转入空载体LentiCRISPR v2的MARC-145细胞为对照,分别将MARC-145-△eIF5A细胞系和对照组细胞接种到96孔培养板培养,细胞长至80%左右时,将PRRSV配制成10-1~10-1010个浓度梯度,分别接种到MARC-145-△eIF5A细胞孔中,37 ℃培养4~6 d后观察并记录CPE,通过Reed-Muench两氏法计算病毒的TCID50值。
1.2.7eIF5A敲除对PRRSV ORF7 mRNA表达的影响
将对照组细胞和MARC-145-△eIF5A细胞均匀传代至24孔板中,细胞密度达到80%后接种MOI=0.1的PRRSV,收集24 h的细胞,提取RNA并反转录成cDNA,通过Real-time PCR检测PRRSV在MARC-145-△eIF5A细胞的增殖情况。PRRSV的Real-time PCR检测方法及反应条件同1.2.4.1,使用引物信息见表2。
1.2.8eIF5A敲除对PRRSV N蛋白表达的影响
通过IFA法,将对照组细胞和MARC-145-△eIF5A细胞均匀传代至24孔板中,待细胞密度达到80%以上时,接种MOI=0.1的PRRSV,24 h后收获细胞,用预冷的95%甲醇固定细胞15~20 min,5%脱脂奶于37 ℃封闭1 h,PBST洗涤细胞3次,以PRRSV N蛋白单抗为一抗(1∶500稀释使用),FITC标记的羊抗兔IgG为二抗(1∶1 000稀释使用)于37 ℃各避光孵育1 h,避光环境下每孔覆盖DAPI显色液5 min,用PBST洗涤3~5次,在IX53型荧光倒置显微镜下观察结果。
Western blot试验方法同1.2.4.3,以PRRSV N蛋白单抗为一抗,HRP标记的羊抗鼠IgG为二抗,用ECL化学发光法显色并观察结果。
1.2.9数据统计
各试验均平行重复3次,采用Graphpad 8.0软件对试验数据进行t-test统计学分析。
2 结果与分析
2.1 LentiCRISPRv2-sgRNA载体构建
在37 ℃的条件下,用Bsmb Ⅰ对LentiCRISPR v2质粒线性化,4 h后使用琼脂糖凝胶进行电泳检测。目的片段用DNA胶回收试剂盒进行回收纯化,然后连接sgRNA,将连接产物转化入TOP10感受态细胞,构建重组质粒LentiCRISPRv2-sgRNA1。经过测序比对发现重组质粒LentiCRISPRv2-sgRNA1构建成功(图1)。

(a)构建模式图;(b)测序结果(a) Construction pattern diagram;(b) The results of sgRNA sequencing
2.2 MARC-145-△eIF5A多克隆细胞系的鉴定
收集对照组细胞和敲除eIF5A的细胞系,提取细胞总RNA反转录成cDNA,利用Real-time PCR方法检测eIF5A基因在MARC-145对照、MARC-145-△eIF5A细胞中表达量的变化。图2(a)MARC-145-△eIF5A细胞中eIF5A基因的mRNA相对表达量显著低于对照组细胞(P<0.05),表明设计的sgRNA具有较高的编辑效率,能够显著降低eIF5A表达。提取细胞基因组后,以其作为模板进行PCR扩增,PCR产物经纯化试剂盒纯化,按照T7E1核酸内切酶说明书对多克隆细胞基因组进行酶切,检测编辑效率。由图2(b)可知,第4条泳道出现了小分子量条带,表明sgRNA1能有效对eIF5A基因进行编辑。由图2(c)可知,收集对照组细胞和MARC-145-△eIF5A细胞的蛋白样品,进行Western blot检测。结果显示与对照组细胞相比MARC-145-△eIF5A细胞中eIF5A蛋白表达显著降低。综上,敲除eIF5A的MARC-145细胞系MARC-145-△eIF5A构建成功。

(a)Real-time PCR检测;(b)T7-E1酶切鉴定。1:DL 2 000 Marker;2:对照;3:sgRNA-eIF5A;4:对照+T7E1;5:sgRNA-eIF5A-T7E1;(c)Western blot鉴定。**P<0.01。(a) Detection of real-time PCR;(b) Restriction enzyme digestion.1:DL 2 000 Marker;2:Control;3:sgRNA-eIF5A;4:Control+T7E1;5:sgRNA-eIF5A-T7E1;(c) Western blot.
2.3 eIF5A基因敲除对MARC-145细胞活性的影响
将MARC-145细胞和MARC-145-△eIF5A传代培养,待细胞生长密度达到80%时,分别于0、6、12和24 h使用MTS试剂盒检测490 nm波长下的吸光度值。结果显示:MARC-145-△eIF5A细胞与对照组细胞MARC-145相比,490 nm波长下的吸光度值无显著差异,表明eIF5A基因的敲除对MARC-145细胞的增殖无显著影响(P>0.05)(图3)。

图3 eIF5A基因敲除对MARC-145细胞活性的影响Fig.3 Effect of eIF5A gene knockout on cell viability of MARC-145 cells
2.4 eIF5A敲除对PRRSV增殖的影响
用PRRSV分别感染MARC-145细胞和MARC-145-△eIF5A多克隆细胞系。设置12和 24 h 2个比较组,由Real-time PCR结果可知(图4(a)),与对照组相比PRRSV感染MARC-145-△eIF5A细胞系病毒ORF7 mRNA表达量显著降低(P<0.05),说明体外敲除eIF5A可显著抑制PRRSV复制。通过Western blot检测PRRSV感染12和24 h的细胞样品,结果显示MARC-145-△eIF5A细胞系PRRSV N蛋白的表达显著低于对照组(图4(b)),表明体外敲除eIF5A能够显著抑制PRRSV N蛋白的表达。通过IFA检测PRRSV感染MARC-145细胞和MARC-145-△eIF5A细胞24 h的细胞样品,以PRRSV N蛋白单抗为一抗,FITC标记的羊抗鼠抗体为二抗,在荧光显微镜下观察发现MARC-145-△eIF5A细胞系与对照组相比荧光均有不同程度的减少(图4(c)),说明体外敲除eIF5A可显著抑制PRRSV复制。用PRRSV分别感染MARC-145细胞和MARC-145-△eIF5A细胞系,从TCID50结果可知(图4(d)),MARC-145-△eIF5A细胞系PRRSV病毒滴度显著低于对照组(P<0.05),这表明体外敲除eIF5A可显著抑制PRRSV的滴度(P<0.01)。

(a)Real-Time PCR检测PRRSV ORF7 mRNA的表达量;(b)Western blot检测PRRSV N蛋白的表达;(c)IFA检测PRRSV N蛋白的表达;(d)TCID50检测PRRSV浓度。*P<0.05;**P<0.01;***P<0.001。(a) Identification of the mRNA expression of PRRSV N protein by real-time PCR;(b) Identification of the expression of PRRSV N protein by Western blot;(c) Identification of the expression of PRRSV N protein by IFA;(d) Identification of PRRSV titer by TCID50.
3 讨 论
PRRSV是危害我国生猪生产的重大流行病之一,由于PRRSV在猪体内增殖十分迅速,并且具有易变异和持续性感染等特点,使得当前PRRSV的防控具有较大难度,迫切需要寻找新药靶点,研制有效的治疗药物[26]。Wang等[27]研究发现OAS1b的过表达可抑制PRRSV的复制,而OAS1b RNA沉默导致病毒滴度增加。此外,OAS1b促进了干扰素的表达以及干扰素-β启动子的活性。TRIM(Tripartite motif,TRIM)家族成员是对抗病毒感染的先天免疫反应的重要效应物。Wei等[28]对猪的TRIM(pTRIM)家族进行了表征,并预测pTRIM5、14、21、25和38是抵抗PRRSV感染的宿主限制因子。pTRIM21过表达可以明显抑制PRRSV的复制,但不影响PRRSV附着和内吞作用。DDX21是DDX家族成员,除了调节细胞RNA代谢的功能外,DDX21还调节先天免疫,并参与一些病毒的复制周期。DDX21的过表达可促进PRRSV的复制,而DDX21敲除则抑制PRRSV的增殖,进一步研究发现敲除DDX21可激活PRRSV感染细胞的IFN-β信号通路,促进IFN-β的表达抑制PRRSV复制[29]。
课题组前期在PRRSV感染PAMs蛋白质组学研究中发现eIF5A在PRRSV感染细胞后显著下调,推测其是调控PRRSV复制的潜在药物靶点[19]。eIF5A也被称为eIF4D,是从未成熟的红细胞中分离出来的。它是一种分子质量为17 ku的酸性蛋白质,从酵母到人类高度保守。近年来,eIF5A在翻译过程中的功能得到了广泛研究,eIF5A与核糖体中翻译功能相关的区域结合,促进了多脯氨酸链的延伸。eIF5A也与真核mRNA的3′端多聚腺苷酸化尾结合,并在翻译终止中发挥重要作用。eIF5A另一个重要功能是介导mRNA的核质转运,保证mRNA在细胞核和细胞质中的平衡分布[30]。eIF5A及其羟脯氨酸修饰在HIV以及EBOV复制中的作用已被证实,而eIF5A对PRRSV复制的影响尚未见报道。本研究利用CRISPR/Cas9基因编辑技术首次在MARC-145细胞对eIF5A基因成功敲除,构建了MARC-145-△eIF5A多克隆细胞系,研究eIF5A对PRRSV感染的影响。通过IFA、Western blot证实eIF5A基因敲除可显著抑制PRRSV N蛋白的表达,Real-time PCR试验证实MARC-145-△eIF5A细胞系中PRRSV ORF7 mRNA的表达显著低于对照组,TCID50试验证实MARC-145-△eIF5A细胞系中子代病毒的滴度显著低于对照组。以上结果均说明体外敲除eIF5A对PRRSV复制有抑制作用。说明eIF5A是抑制PRRSV复制的潜在药物靶点。PRRSV RNA基因组的复制是一个十分复杂的过程,涉及到由病毒和细胞成分组成的复制和转录复合物的组装[31-33],推测宿主细胞中eIF5A的缺失有可能影响了PRRSV转录复制复合体的形成,从而抑制了PRRSV的复制。本研究为新型抗PRRSV药物的研发提供理论依据,也为PRRSV的防控提供新思路。但目前eIF5A对PRRSV复制的调控机制尚未明确,尚需要进一步深入研究。