高效液相色谱法测定鱼粉中色胺含量不确定度评定
2023-07-14潘灿盛温才洁蔡群娣
夏 冰 刘 军 潘灿盛 温才洁 蔡群娣 张 飞
(广东省科学院测试分析研究所(中国广州分析测试中心)广东省化学测量与应急检测技术重点实验室,广东 广州 510070)
鱼粉是常见的优质动物蛋白原料,广泛在家畜饲料和水产饵料应用[1]。鱼粉由一种或多种鱼类通过一系列操作加工而成。活鱼死后,鱼体内蛋白酶催化蛋白质水解成小肽物质和氨基酸,氨基酸脱羧酶又进一步催化氨基酸水解成生物胺[2],鱼体越腐败,生物胺含量就越高。若使用腐败变质的鱼肉制品或鱼粉保存不当均会导致鱼粉中生物胺含量升高[3-4],因此,鱼粉中生物胺的含量是评价鱼粉质量的一个重要指标[5]。色胺属于一种生物胺,是由色氨酸脱羧形成的胺,具有潜在毒性,含量过高可能会引起变态反应等不良后果[6]。
在日常检测中,鱼粉中色胺的检出率较高,部分样品中色胺的含量接近方法定量限,此时需要对影响色胺测定结果准确性的因素进行不确定度评定。不确定度评定可以提高色胺测量结果的准确度、有效性和科学性;提供测量结果的分散性[7],对色胺质量控制具有重要意义[8]。目前,关于鱼粉中色胺的不确定度评定未见报道。本研究依据《化学分析中不确定度的评估指南》(CNAS—GL06)[9]和《测量不确定度评定与表示》(JJF 1059.1—2012)[10]中规定的方法和程序,参照《动物源性饲料中生物胺的测定》(GB/T 23884—2021)[11],采用高效液相色谱法对鱼粉中色胺的含量进行测定,并建立数学模型,量化检测过程中各不确定度分量,得到合成标准不确定度及扩展不确定度,并分析影响不确定度的关键来源,找出影响检测不确定度的主要因素,为进一步提高鱼粉中色胺含量检测结果的准确度提供参考。
1 材料与方法
1.1 仪器与试剂
Agilent 1260高效液相色谱仪配紫外检测器购自美国Agilent 公司,Multi reax 多位试管涡旋振荡器购自heidolph 公司,BT125D 电子天平购自赛多利斯科技有限公司,PIFE 防腐型24 位氮吹仪购自ANPEL 公司,FE15067超声波机购自Fisherbrand公司。
色胺(98.3%)购自Chromadex 公司,乙腈(色谱纯)购自MERK,丹酰氯(分析纯)购自Sigma,高氯酸、氨水、碳酸氢钠、丙酮、氢氧化钠(分析纯)购自广州化学试剂厂,鱼粉购自市场。
丹磺酰氯溶液(10 g/L):称取0.5 g 丹磺酰氯于50.00 mL容量瓶,使用丙酮溶解并定容。
1.2 试验方法
按照《动物源性饲料中生物胺的测定》(GB/T 23884—2021)的要求测定鱼粉中色胺的含量[11]。
1.2.1 样品制备
称取1.0 g 于50 mL 离心管中,加入10 mL 0.4 mol/L高氯酸溶液,涡旋混匀,振摇提取10 min,4 000 r/min离心10 min,移出上清液,重复提取残渣一次,合并两次上清液;移取1 mL 上清液于10 mL 比色管中,依次加入2 mol/L 氢氧化钠溶液200 μL,饱和碳酸氢钠溶液300 μL和10 g/L丹磺酰氯溶液2 mL,涡旋混匀,45 ℃避光反应45 min,加入氨水100 μL 终止反应,静置15 min。45 ℃下用氮气吹除丙酮,乙腈定容至5 mL,过滤上机[11]。
1.2.2 标准工作溶液配制
准确称取5.54 mg 标准品于50 mL 容量瓶,使用0.1 mol/L盐酸溶液定容,得到108.9 mg/L溶液,逐级稀释为54.500、27.200、10.900、5.450、0.545、0.109、0 mg/L标准溶液。
1.2.3 色谱条件
色谱柱:Ultimate®XB-C18柱(4.6 μm×250 mm,5 μm);流动相A:乙酸铵溶液(5 mmol/L),流动相B:乙腈,梯度洗脱:0~5 min,60% B;5~12 min,60% B~75% B;12~20 min,75% B~95% B;20~21 min,95%B~60% B;21~25 min,60% B;流速:1.0 mL/min;柱温:30℃;检测波长:254 nm;进样量:10 μL。
1.3 数学模型和不确定度来源分析
1.3.1 数学模型
式中:X为试供试液中色胺的含量(mg/kg);c为由标准曲线得到的供试液质量浓度(mg/L);V为样品定容体积(mL);m为样品质量(g)。
1.3.2 不确定度来源分析
对试验过程和数学模型进行分析,鱼粉中色胺测定结果的不确定度来源见图1。

图1 鱼粉中色胺不确定度来源
2 结果与分析
2.1 测试液中色胺浓度c的不确定度分析
2.1.1 对照品纯度Urel(P)
色胺对照品纯度为98.3%,未标识不确定度。按矩形分布,对照品纯度引入相对标准不确定度为:。
2.1.2 标准品称量Urel(mstd)
对照品称样量为5.54 mg,精确至0.01 mg,根据标准《电子天平》(JJG 1036—2008)[12]平行测定6 次;称量时操作两次,计2 次不确定度,对照品称样量的不确定度见表1。

表1 对照品称样量的不确定度
2.1.3 系列标准工作溶液配制Urel(Cstd)
使用容量瓶配制108.900、54.500、27.200、10.900、5.450、0.545、0.109、0 mg/L 标准溶液,1.00、5.00 mL分度吸量管,20、200 μL 移液器,标准工作曲线配制方法见表2。根据《常用玻璃量器检定规程》(JJG 196—2006)[13]规定,在(20±5)℃进行操作,水膨胀系数2.08×10-4(1/℃),温差引起的体积分散区间半宽度。
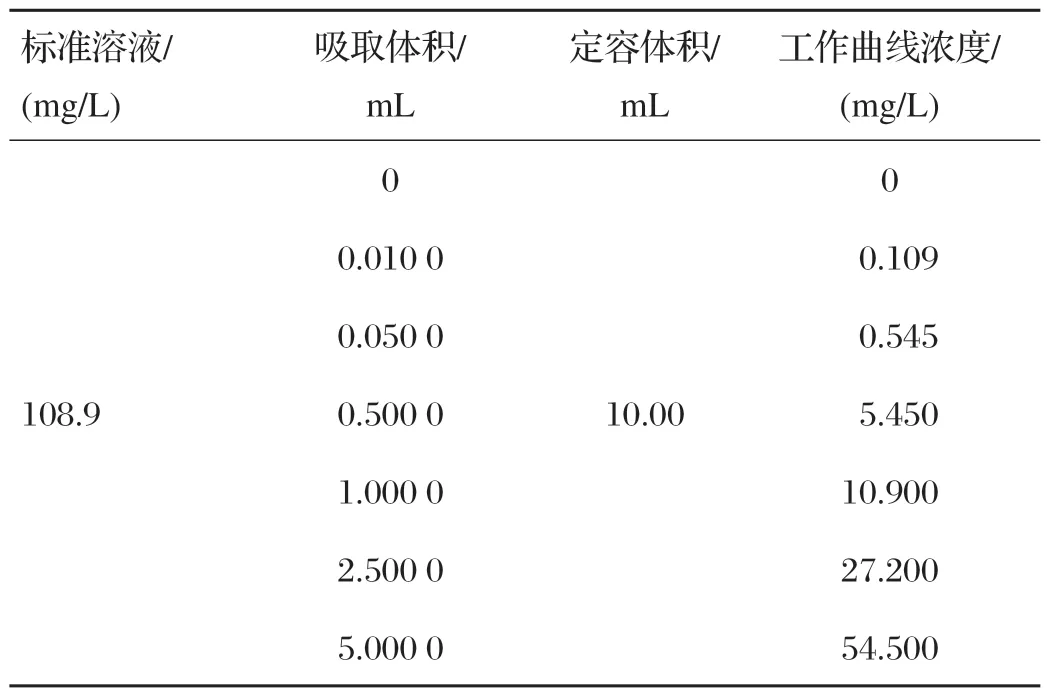
表2 标准工作曲线配制方法
50 mL 容量瓶:ΔV=50 mL×2.08×10-4℃-1×5 ℃=0.052 mL。
10 mL 容量瓶:ΔV=10 mL×2.08×10-4℃-1×5 ℃=0.010 mL。
取矩形分布,标液移取和定容引起的不确定度见表3。由此可知,标准溶液的配制引入的相对不确定度为:。

表3 标液移取和定容引起的不确定度
2.1.4 标准曲线引入的不确定度Urel(Cal)
使用最小二乘法对标准工作溶液进行拟合,绘制标准曲线,具体数据见表4。

表4 标液浓度及相应的峰面积和标准曲线
样品做两次平行测定,采用线性回归方程计算得出样品的平均质量浓度为0.092 0 mg/L。由标准曲线引入的标准不确定度为:。其中;=(0+0.109+0.545+5.45+10.9+27.2+54.5+108.9)/8=26.0 mg/L。
式中:SR为标准溶液峰面积残差的标准偏差;aˉ为回归方程斜率平均值,本试验aˉ=19.908;b为-99.11;cˉ为标准系列溶液的平均质量浓度;P为样品的平行测定次数,P=2;n为标准溶液测定次数,n=6;j为校正曲线级别。
c的相对标准不确定度为:,。
2.2 样品定容引入的不确定度Urel(V10)
样品做2次平行测定,使用10 mL单标线吸量管进行定容,根据JJG 196—2006[13]规定,样品定容引入的不确定度见表5。

表5 样品定容引入的不确定度
2.3 样品称量引入的不确定度Urel(m)
样品称样量为1.0 g,引入的不确定度见表6。

表6 样品称量引入的不确定度
2.4 重复性试验引入的不确定度Urel(Frep)
重复称取样品6次进行测定,测得含量分别为10.50、10.20、9.97、10.50、10.50 和10.40 mg/kg,平均值为10.3 mg/kg。
单次测量的标准不确定度使用贝塞尔公式计算[14]:。
在实际检测时通常做平行双样,平均值的标准不确定度为(n=2):。
2.5 加标回收引入的不确定度Urel(Rec)
在加标量为10 mg/kg 时,求得加标回收率为分别为102.1%、100.0%、101.2%、102.5%、102.1%、102.7%,平均值101.8%,回收率的标准不确定度URec为:。
则回收率Rec的相对标准不确定度为:。
2.6 合成测量不确定度的评定
2.6.1 合成标准不确定度
因各分量相互独立不相关,因此样品中色胺测定结果的合成相对标准不确定度为:
则合成标准不确定度为:U(ω)=0.033×10.3 mg/kg ≈0.34 mg/kg。
2.6.2 相对扩展不确定度
取包含因子k=2,则相对扩展不确定度为:Urel=2×3.3%=6.6%。
2.6.3 扩展不确定度
U=2×0.34=0.68mg/kg。
样品中鱼粉色胺含量为:10.3 mg/kg。样品中鱼粉色胺含量结果表示为:(10.30±0.68) mg/kg,k=2[10]。
2.7 相对标准不确定度
本研究对高效液相色谱法测定鱼粉中色胺含量的不确定度进行评定,量化各相对标准不确定度分量,见表7。由表7 可知,影响鱼粉中色胺测量不确定度的因素有测定液中色胺的浓度(标准曲线线性拟合和标准溶液配制)、定容体积、样品称量、样品重复性和样品前处理的回收率,其中测定液中色胺的浓度是主要因素,而样品称量过程引入的不确定度最小[14-15]。
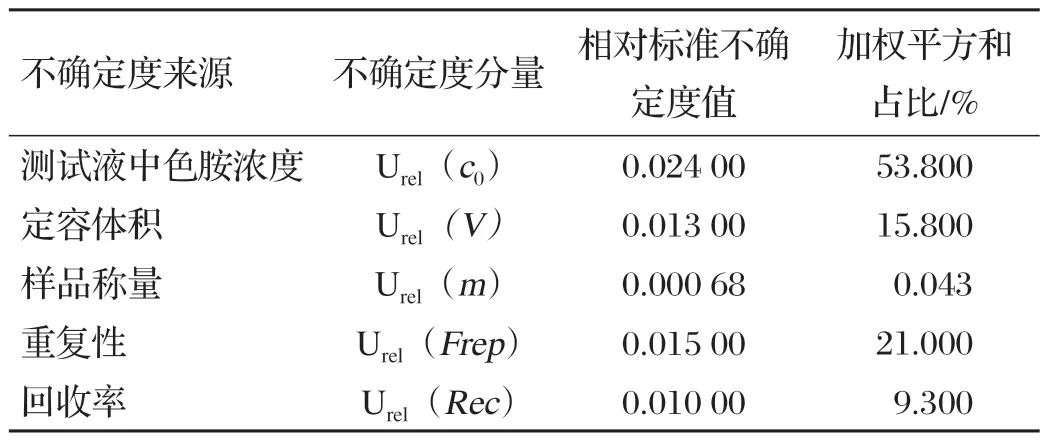
表7 相对标准不确定度
3 结论
本研究通过量化色胺检测结果中各不确定度分量,得到了影响结果不确定度的主次因素,为采取针对性的措施提供了参考,可以选购权威机构提供的有效期内、不确定度较小的有证标准物质,并且定期对标准物质进行期间核查;严格按照操作规范配制标准溶液,包括使用计量检定合格的移液器、移液管和容量瓶,定期对器皿进行校准和核查;选择适当的标准系列浓度点和测定次数;注意色谱峰面积积分细节的处理以减小最小二乘法线性拟合曲线的影响,使标准曲线相关系数≥0.999;设计合适的标准曲线,使供试液浓度位于标准曲线的中间;定期对仪器进行检定和核查,确保仪器处于最佳工作状态;定期开展人员比对,提高检测人员熟练水平;确保样品均匀性,尽量降低相关不确定度。
