不同分子分型乳腺癌中FGFR4和CD44蛋白的表达及临床意义
2023-07-14林洁黄云美王娟黄炳臣朱晓莹
林洁 黄云美 王娟 黄炳臣 朱晓莹

【摘要】 目的 探讨成纤维细胞生长因子受体4(FGFR4)和白细胞表面蛋白CD44在乳腺癌四种分子分型中的表达情况及其临床意义。方法 收集120例仅经手术切除的乳腺癌病例标本制成的组织蜡块,四种分子分型各30例;用免疫组化染色法(SP法)检测上述标本中FGFR4和CD44的表达情况,探讨两者在乳腺癌不同分子分型中的表达差异。结果 乳腺癌分子分型与肿瘤大小、组织学分级、淋巴结转移及TNM分期之间差异无统计学意义(P>0.05);不同分子分型患者年龄分布差异有统计学意义(P<0.05)。FGFR4在Luminal A型、Luminal B型、Her-2过表达型及基底细胞型乳腺癌中的阳性率分别为 53.3%(16/30)、50.0%(15/30)、83.3%(25/30)及83.3%(25/30),CD44的阳性表达率分别为43.3%(13/30)、40.0%(12/30)、73.3%(22/30)及80.0%(24/30)。FGFR4和CD44在乳腺癌四種分子分型的表达差异有统计学意义(P<0.01);其中FGFR4在Her-2过表达型乳腺癌和基底细胞型乳腺癌的表达高于Luminal B型乳腺癌(P<0.008),CD44在基底细胞型乳腺癌的表达高于Luminal A型、Luminal B型(P<0.008)。结论 FGFR4和CD44在Her-2过表达型和基底细胞型乳腺癌中的表达较高,提示它们可能影响乳腺癌的分子表型。
【关键词】 乳腺癌;成纤维细胞生长因子受体4;CD44;免疫组化;分子分型
中图分类号:R737.9 文献标志码:A DOI:10.3969/j.issn.1003-1383.2023.06.008
Expression and clinical significance of FGFR4 and CD44 protein in different molecular subtypes of breast carcinoma
LIN Jie1, 2, HUANG Yunmei1, 2, WANG Juan1, 2, HUANG Bingchen1, 2, ZHU Xiaoying1, 2
(1. Clinical Pathological Diagnosis and Research Center, Youjiang Medical University for Nationalities, Baise 533000, Guangxi, China; 2. Department of Pathology, Affiliated Hospital of Youjiang Medical University for Nationalities, Baise 533000, Guangxi, China)
【Abstract】 Objective To investigate the expression of fibroblast growth factor receptor 4 (FGFR4) and leukocyte surface protein CD44 in different molecular subtypes of breast carcinoma and its clinical significance. Methods Tissue wax blocks made from 120 cases of breast carcinoma who only underwent surgical resection were collected, with 30 cases in each of the four molecular types. Immunohistochemical staining (SP method) was used to detect the expression of FGFR4 and CD44 in the above-mentioned samples, and difference of their expressions in different molecular subtypes of breast carcinoma was explored. Results There was no statistically significant difference between molecular typing of breast carcinoma and tumor size, histological grade, lymph node metastasis and TNM stage (P>0.05). There was statistically significant difference in age distribution among patients with different molecular subtypes (P<0.05). The positive rates of FGFR4 in Luminal A, Luminal B, Her-2 overexpression type and basal-like breast carcinoma were 53.3% (16/30), 50.0% (15/30), 83.3% (25/30) and 83.3% (25/30), respectively, and the positive rates of CD44 in them were 43.3% (13/30), 40.0% (12/30), 73.3% (22/30) and 80.0% (24/30), respectively. The difference of the expressions of FGFR4 and CD44 in the four molecular subtypes was statistically significant (P<0.01). Among them, the expression of FGFR4 in Her-2 overexpression type breast carcinoma and basal-like breast carcinoma was higher than that in Luminal B breast carcinoma (P<0.008), and the expression of CD44 in basal-like breast carcinoma was higher than that in Luminal A and Luminal B (P<0.008).
Conclusion The higher expressions of FGFR4 and CD44 in Her-2 overexpression type and basal-like breast carcinomas suggest that they may influence the molecular phenotype of breast carcinoma.
【Key words】 breast carcinoma; fibroblast growth factor receptor 4 (FGFR4); CD44; immunohistochemistry; molecular subtypes
乳腺癌是全球女性发病率及病死率最高的恶性肿瘤,其发生发展是一个多基因、多种因素相互作用的复杂过程[1]。目前,乳腺癌在病理诊断及临床治疗方面取得了很大的进步,其中在诊断方面:乳腺浸润性癌根据免疫组化指标雌性激素受体(ER)、孕激素受体(PR)、人表皮生长因子受体(Her-2)、细胞增殖指数(Ki67)及各种细胞角蛋白的阳性表达结果分为不同的四种分子亚型[2],即Luminal A型(雌、孕激素受体阳性)、Luminal B型(雌、孕激素受体及Her-2均阳性)、Her-2过表达型(雌、孕激素阴性)及基底细胞型(雌、孕激素及Her-2均阴性)。根据此种分型可以进行个体化的综合指导治疗,让乳腺癌患者受益颇多,但乳腺癌发生发展的机制尚未完全明确,乳腺癌患者的总生存率仍不高,而HARRELL等[3]的一项研究发现同一分子亚型的乳腺癌存在异质性,因此研究乳腺癌的异质性,更有利于实施精准的治疗,延长患者的生命。成纤维细胞生长因子受体4(fibroblast growth factor receptor 4,FGFR4)参与组织的损伤并修复、新生血管的生成、組织的增殖等多方面的生理过程[4]。乳腺肿瘤的异质性在于肿瘤的细胞群中留存有肿瘤干细胞(cancer stem cells,CScs),其具有介导肿瘤的产生、复发和转移的功能;而白细胞表面蛋白CD44是肿瘤干细胞的标记物,是最早被判定出来的乳腺癌干细胞。FGFR4和CD44两者在不同分子分型的乳腺癌中的表达有没有差异,两者之间是不是存在协同关系,目前尚未有报道。本研究结合临床资料,采用免疫组化法检测不同分子分型的乳腺癌间的FGFR4和CD44的表达情况及与临床病理参数、预后的相关性,以便更好地提示乳腺癌的肿瘤异质性,为患者提供更为精准的治疗方案。
1 资料与方法
1.1 一般资料
收集右江民族医学院附属医院的腺体外科2019年1月至2021年1月经手术切除的乳腺癌石蜡标本,以免疫组化标记物:ER、PR、Her-2、Ki67的阳性表达情况把乳腺癌分为四个亚型即Luminal A型(ER、PR均阳性,Her-2阴性,Ki67<14%)、Luminal B型(ER阳性,PR低表达,Her-2阳性或阴性,Ki67≥14%)、Her-2过表达型(ER、PR均阴性,Her-2阳性)及基底细胞型(ER、PR、Her-2均阴性)。收集各亚型乳腺癌患者各30例,共120例。均为女性患者,年龄26~77岁,中位年龄44岁。肿瘤直径1.1~7.3 cm。患者手术前均没有进行其他方面的抗肿瘤治疗,大病理均诊断为浸润性癌,非特殊型。其中淋巴结出现转移癌的有17例,淋巴结没有出现转移癌的13例。
1.2 方法
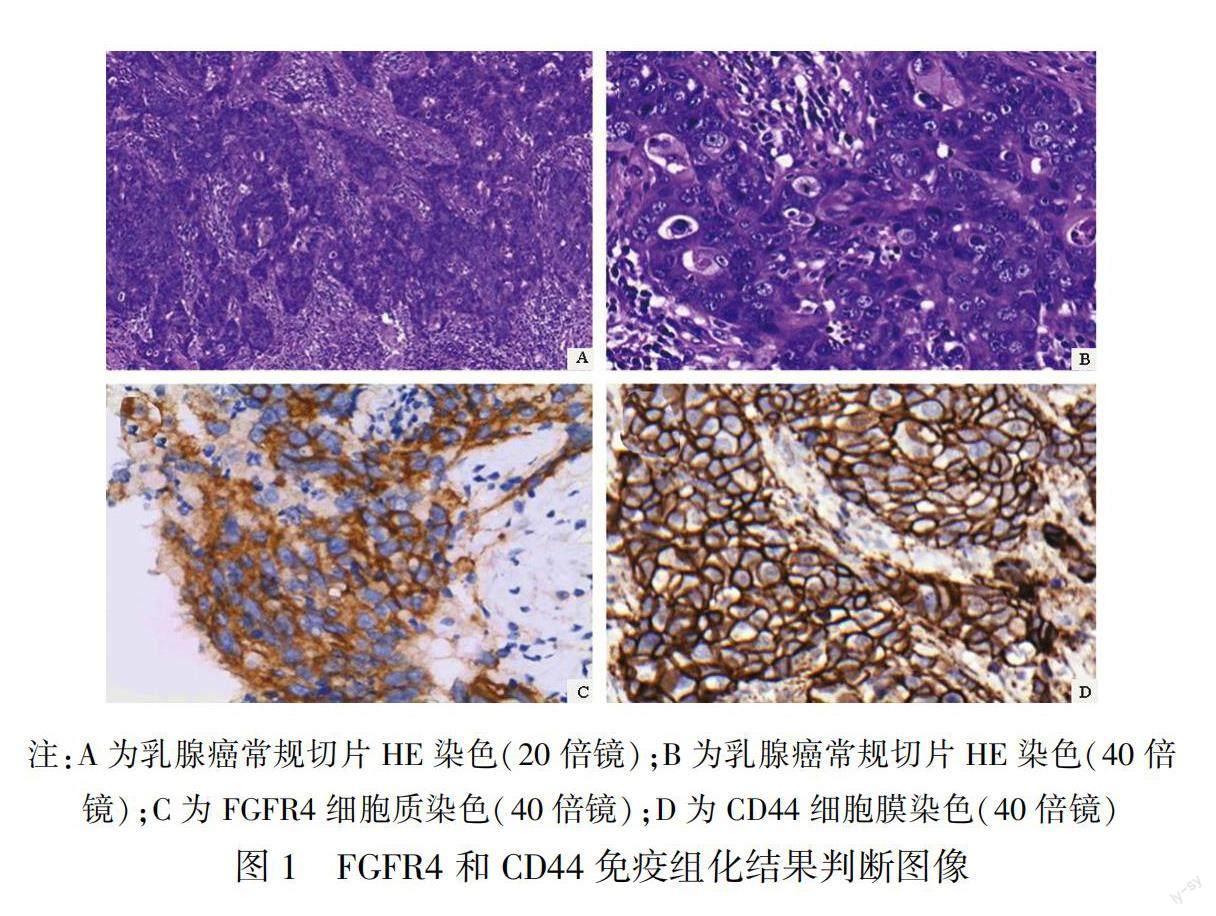
组织标本使用10%的中性甲醛经过常规的固定、包埋、切片及HE染色(图1-A、图1-B)进行诊断后,使用免疫组织化学技术二步法进行染色。所用试剂:一抗为兔抗人FGFR4多克隆抗体(浓缩液),CD44即用型抗体,所用到的二步法免疫组化的检测试剂盒及DAB试剂盒均购自福州迈新生物技术开发有限公司,按照试剂使用说明进行。
1.3 结果判读
免疫组化结果的判读,由两名资历较高的病理诊断医师,利用双盲方法进行判读。按肿瘤细胞上色的深浅、阳性细胞数目来计算给分。FGFR4阳性为棕色细胞质染色(图1-C),CD44阳性为棕色细胞膜染色(图1-D)。染色强度:阴性为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。阳性细胞数:<1%为0分,1%~25%为1分,26%~50%为2分,51%~75%为3分,76%~100%为4分。将两者相加得到总积分,0分记为(-),1~3分记为(+),4~5分记为(2+),6~7分记为(3+),总积分>3分记为阳性,≤3分记为阴性,以随机方式取5个不同的高倍镜视野求其平均积分。
1.4 统计学方法
运用SPSS 20.0软件进行数据处理,计数资料采用χ2检验,检验水准:α=0.05,双侧检验,组间比较采用 bonferroni 校正的检验水准α=0.05/6=0.008,双侧检验。
2 结果
2.1 各亚型的乳腺癌临床病理特征的相关性
不同分子分型的乳腺癌患者在肿瘤直径、组织学分级、淋巴结转移及TNM分期之间的差异均无统计学意义(P>0.05)。见表1。
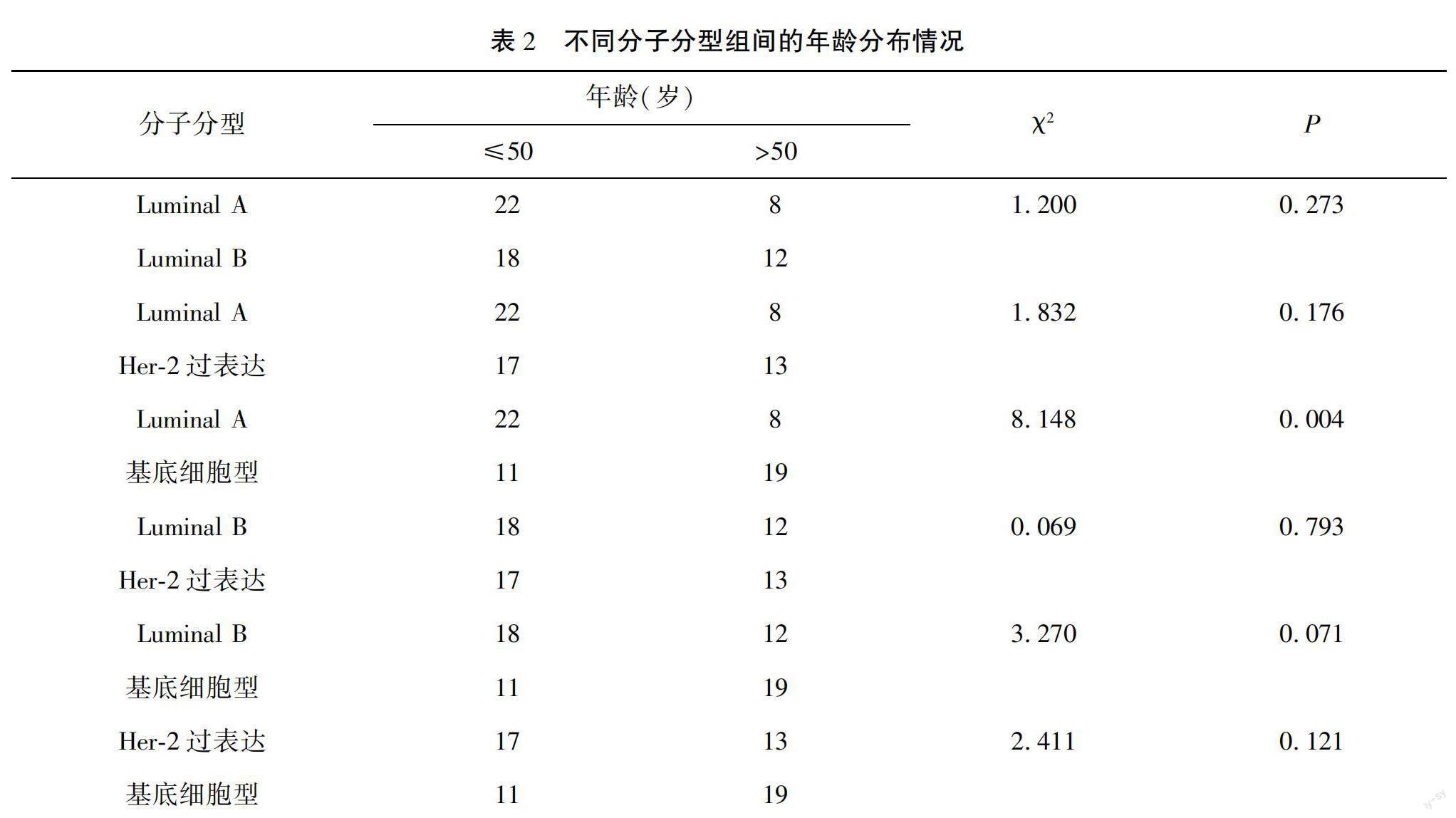
2.2 不同分子分型组间的年龄分布情况
各亚型的乳腺癌患者,在年龄方面比较差异有统计学意义,其中基底细胞型>50岁占比的例数高于Luminal A型(P<0.008)。见表2。
2.3 FGFR4和CD44在各亚型的乳腺癌组织和分子分型中的表达
FGFR4在Luminal A型、Luminal B型、Her-2过表达型及ER/PR/Her-2基底细胞型乳腺癌中的阳性率分别为 53.3%(16/30)、50.0%(15/30)、83.3%(25/30)及83.3%(25/30),CD44的阳性表达率分别为43.3%(13/30)、40.0%(12/30)、73.3%(22/30)及80.0%(24/30)。FGFR4和CD44在Luminal A型、Luminal B型、Her-2过表达型和基底细胞型乳腺癌间的表达差异有统计学意义(P<0.05),其中FGFR4在Her-2过表达型乳腺癌和基底细胞型乳腺癌间的表达相对高于Luminal B型乳腺癌(P<0.008),CD44在基底细胞型乳腺癌的表达相对高于Luminal A型、Luminal B型乳腺癌(P<0.008)。见表3、表4、表5。
3 讨论
现在对于乳腺癌的确诊及治疗方案日趋成熟,这得益于以ER、PR、Her-2和Ki67作为基础的乳腺癌的分子分型并对各亚型的乳腺癌患者的个体化治疗提供了精准的指导,患者的预后得到了明显的改善。然而治疗后出现复发和转移依旧是导致乳腺癌患者最终死亡的首要原因,且在临床治疗中发现具有不同分子分型的乳腺癌患者,在使用同一治疗方案后,出现了截然不同的治疗效果,这有可能是因为乳腺癌的高度异质性所引起的。要实现对乳腺癌患者的精准医疗,除了以ER、PR、Her-2和Ki67作为分子分型外,还需要更多的基因和蛋白表达谱,来寻找新的治疗靶点。
FGFR4是分布在多种细胞上的具有穿膜功能的酪氨酸激酶受体,在胚胎和组织修复时严格表达,出生后表达量明显下降,且主要分布于肾上腺和肺组织[5]。在病理状态下FGFR4与其配体FGFR19结合可进行二聚化和自磷酸化,通过激活磷脂酰肌醇3激酶/蛋白激酶B(PI3K/AKT)以及糖原合成酶激酶-3/β-链蛋白(GSK3β/β-catenin)等信号通路促进肿瘤细胞的增殖、促进上皮细胞-间充质转化(EMT),抑制肿瘤细胞的凋亡。因此FGFR4与其配体结合后调控的血管新生、细胞增殖等相关的信号通路轴是潜在的治疗靶点[6]。ZHAO等[7]的研究发现FGFR19与其受体FGFR4结合后可促进乳腺癌的增殖、侵袭能力,促进乳腺癌细胞的生长及转移。谢静静等[8]的研究发现FGFR4基因的多态性与Luminal 型乳腺癌的临床病理特征无明显相关性,但FGFR4中的某些基因型与Her-2过表达的情况较一致。尽管FGFR4基因的多态性并没有增加乳腺癌的环保风险,但会增加乳腺癌的恶性程度,促进淋巴结的转移等,且FGFR4基因的突变会降低患者对化疗的敏感性,出现极差的预后[9]。有研究发现FGFR4与其配体结合后可激活细胞的自分泌信号并介导基底细胞样乳腺癌细胞的增殖分化[10]。由此抑制此信号通路可明显降低乳腺癌细胞的增殖分化,降低其侵袭性。在本研究中,FGFR4在Her-2过表达型及基底细胞型乳腺癌中均呈高表达,且在这两种类型中的表达率都高于Luminal A型和Luminal B型乳腺癌。FGFR4在基底细胞型组与HER2过表达组中是高表达的,提示FGFR4与预后差的分子表型呈正相关 。乳腺癌复发转移率高的根本原因在于乳腺癌干细胞的存在[11],常规的抗肿瘤治疗只对处于增殖活跃的肿瘤干细胞有效,但对处于相对静止状态的肿瘤干细胞是无效的。若不能完全清除肿瘤干细胞,就会为复发埋下隐患。肿瘤干细胞是肿瘤出现侵袭转移的前提,当特殊的干细胞特性标记物如CD44高表达作用下可加速乳腺癌的转移。CD44表达于细胞表面,介导肿瘤细胞和细胞外基质之间的相互作用,CD44与其配体结合后可引起构象的改变,导致与细胞增殖和迁移的相关信号通路的激活。本研究中CD44在基底细胞型乳腺癌中的表达水平显著增高(80.0%),在Her-2过表达型的乳腺癌中的表达率为(73.3%)。ZOU等[12]的研究表明,有淋巴结转移的基底细胞型乳腺癌患者CD44的阳性率比无淋巴结转移的患者要高。90%以上的原发性乳腺癌在转移过程中都要经过细胞的重编程,包括上皮-间质的转化(EMT)。罗明华等[13]采用PT-PCR法研究发现CD44mRNA分子在基底细胞型乳腺癌中的表达水平高于激素受体阴性组织。这与基底细胞型乳腺癌的肿瘤细胞发生EMT相关联。在某些特定的微环境中可发生EMT,因为CD44能促进肿瘤细胞黏附到内皮屏障,并促进组织内的局部侵袭、定植。YANG 等[14]的研究也证实了在肿瘤微环境中,某些信号转导TGF-β可促进肿瘤细胞的上皮-间质的转化和出现侵袭转移的主要诱因。总之,CD44在增强上皮-间质转化和乳腺癌形成中的作用与上皮-间质转化获得促进干细胞特性是一致的。本研究中CD44在基底细胞型乳腺癌患者中的表达比非基底细胞型乳腺癌患者的要高,得到的提示是:CD44的表达有可能在基底细胞型乳腺癌的发病机制中发挥着一定的作用。本研究还发现CD44在各亚型中的表达差异有统计学意义,在Her-2过表达型和基底细胞型乳腺癌中的表达相对要高些。这与李玉冰等[15]的研究相一致。但有研究却发现CD44的表达在Luminal A型乳腺癌中相对更高,而另外的研究者却提出CD44在基底细胞型乳腺癌中的表达比其他亚型明显增高[16]。造成这些表达结果的差异性,可能是与免疫组织化学染色方法和判读标准的不同相关。本研究结果提示CD44与乳腺癌出现淋巴结转移有一定的相关性。此外,还发现了FGFR4和CD44两者均在基底细胞型乳腺癌中有更高的表达,这也进一步提示其与预后差的分子表型呈正相关 ,但并未发现二者之间存在协同作用,可能需要加大样本量,并建立更加精确和细化的分子分型,才能为乳腺癌患者的精准医治指明新的方向。
参 考 文 献
[1]ISIDORI F, BOZZARELLI I, FERRAR I S, et al. RASAL1 and ROSI gene variants in hereditary breast cancer[J].Cancers, 2020,12(9):2539.
[2]蔣梦怡,陆言巧,王红霞.乳腺癌异质性的研究进展及临床意义[J].中国癌症杂志,2020,30(5):394-400.
[3]HARRELL J C, PRAT A, PARKER J S, et al. Genomic analysis identifies unique signatures predictive of brain,lung,and liver relapse[J].Breast Cancer Res Treat, 2012,132(2):523-535.
[4]XUE W J, LI M T, CHEN L, et al. Recent developments and advances of FGFR as a potential target in cancer[J].Future Med Chem, 2018,10(17):2109-2126.
[5]GAO L X, WANG X L, TANG Y L, et al. FGF19/FGFR4 signaling contributes to the resistance of hepatocellular carcinoma to sorafenib[J].J Exp Clin Cancer Res, 2017,36(1):8.
[6]SHIMADA Y, OKUMURA T, TAKEI Y, et al. Role of fibroblast growth factor receptors in esophageal squamous cell carcinoma[J].Esophagus, 2016,13(1):30-41.
[7]ZHAO X D, XU F L, DOMINGUEZ N P, et al. FGFR4 provides the conduit to facilitate FGF19 signaling in breast cancer progression[J].Mol Carcinog, 2018,57(11):1616-1625.
[8]谢静静,刘晶,孙姗姗,等.FGFR4基因多态性与Luminal型乳腺癌临床病理特征的相关性[J].现代肿瘤医学,2016,24(13):2038-2041.
[9]HOSSEINI M. The relationship between polymorphic fibroblast growth factor receptor (FGFR) gene and breast cancer risk[J].Arch Breast Cancer, 2017,4(1):24-27.
[10]TIONG K H, TAN B S, CHOO H L, et al. Fibroblast growth factor receptor 4 (FGFR4) and fibroblast growth factor 19 (FGF19) autocrine enhance breast cancer cells survival[J].Oncotarget, 2016,7(36):57633-57650.
[11]WIMMER K, BOLLIGER M, BAGO-HORVATH Z, et al. Impact of surgical margins in breast cancer after preoperative systemic chemotherapy on local recurrence and survival[J].Ann Surg Oncol, 2020,27(5):1700-1707.
[12]ZOU W Y, YANG Y, ZHENG R S, et al. Association of CD44 and CD24 phenotype with lymph node metastasis and survival in triple-negative breast cancer[J].Int J Clin Exp Pathol,2020,13(5):1008-1016.
[13]罗明华,叶静,张增,等.CD44和EPCR mRNA在乳腺癌组织中的表达及其临床意义[J].中华临床医师杂志(电子版),2018,12(9):492-499.
[14]YANG Y, YANG H H, TANG B W, et al. The outcome of TGFβ antagonism in metastatic breast cancer models in vivo reflects a complex balance between tumor-suppressive and proprogression activities of TGFβ[J].Clin Cancer Res, 2020,26(3):643-656.
[15]李玉冰,向臣希,殷倩倩,等.不同分子亚型乳腺癌组织中CD44+/CD24-/low细胞的分布情况及临床意义[J].徐州医科大学学报,2021,41(1):17-21.
[16]RYSPAYEVA D E, SMOLANKA I I, DUDNICHENKO A S, et al. Are CD44+/CD24-cells the assumed cancer stem cells in breast cancer?[J].Exp Oncol, 2017,39(3):224-228.
(收稿日期:2022-06-07 修回日期:2022-08-25)
(編辑:梁明佩)
