植物乳杆菌与地衣芽孢杆菌复合微贮稻草发酵早期菌群结构变化及功能分析
2023-07-13任文义李娅楠杨双鸣张力莉徐晓锋
任文义 李娅楠 杨双鸣 张力莉 徐晓锋
(宁夏大学农学院,宁夏 银川 750021)
饲料成本是制约现代养殖业发展的重要因素之一[1]。我国的稻草资源丰富,但稻草的品质差,反刍动物利用效率低。稻草主要由纤维素和半纤维素组成,还含有木质素、含氮化合物和粗灰分等[2]。若能找到合适的处理方法,能够提高稻草的利用率。
微贮技术是利用一些酶制剂和益生菌,在合适条件下对秸秆进行厌氧发酵处理,此过程产生热量、酸和酶;产生热量会提高发酵的温度,酸可以使稻草柔软蓬松,降低发酵pH 值,较低的pH 值和较高的温度可为纤维素分解酶、半纤维素分解酶和木质素分解酶提供适宜的酶解环境[3]。赵林果等[4]发现,利用白腐菌及黑曲霉所产的纤维素复合酶处理稻草48 h,能够使稻草中的纤维素、半纤维素和木质素分别降解53.8%、57.8%、44.5%。微贮饲料化加工可以最大程度保存稻草的营养价值,在一定程度上提高稻草适口性。植物乳杆菌是目前微贮饲料生产中最常用的微生物制剂之一。乳酸菌可以抑制酵母菌和霉菌的生长,避免微贮饲料好氧降解造成的营养损失[5-7]。地衣芽孢杆菌是一种常见于土壤的革兰氏阳性嗜热细菌[8],具有独特的生物氧捕获机制,能够快速创造厌氧环境,产生抗菌活性物质,抑制病菌的生长和繁殖[9]。但地衣芽孢杆菌与植物乳杆菌组合利用的研究相对较少,对微贮的作用有待进一步研究。本试验旨在研究地衣芽孢杆菌与植物乳杆菌复合微贮稻草,基于16S rRNA技术找到发酵过程中细菌群落动态和预测的代谢途径,分析微贮过程中菌群变化,探讨其分子机制,为实际生产中稻草资源的利用提供参考。
1 材料与方法
1.1 试验材料
稻草采自宁夏,干物质(DM)含量为94.49%,粗蛋白质(CP)含量为3.45%,中性洗涤纤维(NDF)含量为59.51%,酸性洗涤纤维(ADF)含量为33.59%。
植物乳杆菌为冻干型粉剂,活菌数为1.39×1010CFU/g,地衣芽孢杆菌为冻干型粉剂,活菌数为1.30×1011CFU/g,均购自山东中科嘉亿生物工程有限公司。
1.2 试验设计
试验采用完全随机设计,微贮稻草随机分为5 组,每组6个重复。试验设计见表1。试验期30 d。

表1 微贮稻草试验设计
1.3 微贮稻草的制作
以粉碎2~3 cm 左右的稻草为原料,利用小规模发酵法进行微贮,蔗糖、菌剂、蒸馏水均按照表1进行配制,使用喷壶均匀喷洒至稻草样品,在乙醇消毒的塑料容器中充分混匀。装入35 cm × 45 cm的聚乙烯发酵袋中,每袋500 g,每组6个重复,使用真空包装机抽真空,密封。室温条件(28±3)℃下避光贮藏。于微贮第30 d 后开袋,测定营养指标。
1.4 测定指标及方法
1.4.1 营养成分
微贮30 d后的稻草开袋取样,65 ℃烘干48 h,粉碎,过40 目标准筛。采用烘干法(GB/T 6435—2014)测定干物质(DM),采用凯氏定氮法(沛欧SKD-100)(GB/T 6432—2018)测定粗蛋白(CP)含量,采用Van Soest 洗涤法测定中性洗涤纤维(NDF)、酸性洗涤纤维(ADF)含量。样品开袋后,混匀,从每袋中取微贮稻草20 g,加入180 mL蒸馏水,使用多功能搅拌机均质30 s,使用4 层纱布过滤至三角瓶中,使用雷磁台式酸度计测定滤液pH值。
1.4.2 隶属函数分析
将DM、CP、NDF、ADF、pH 值采用模糊数学的隶属函数理论,综合评价其微贮品质[10-11]。其中DM、CP为正隶属函数,NDF、ADF、pH值为反隶属函数。隶属函数均值越大,说明微贮稻草品质越好。
1.4.3 微生物测序及生物信息学分析
根据模糊隶属函数分析将最优组合即复合菌组Ⅲ的1、3、7、15、30 d微贮样品进行细菌变化规律研究及功能预测分析。样品的DNA提取、PCR扩增、构建文库及测序由广州基迪奥生物科技有限公司完成,测序平台为Illumina Hiseq 2500测序平台。测序得到的原始数据经过质控得到有效数据,进行后续分析。
1.5 数据统计与分析
试验数据采用Excel 2019 处理,SAS 9.4 统计软件进行单因素方差分析,Duncan's 法进行多重比较,结果以平均值和标准误表示,P<0.05表示差异显著。
根据OTU 的物种注释和丰度信息,使用PICRUSt 2软件对细菌的KEGG 进行功能注释,并统计每个通路丰度信息。使用Origin 2022软件作图。
2 结果与分析
2.1 地衣芽孢杆菌与植物乳杆菌复合微贮对稻草营养成分的影响(见表2)
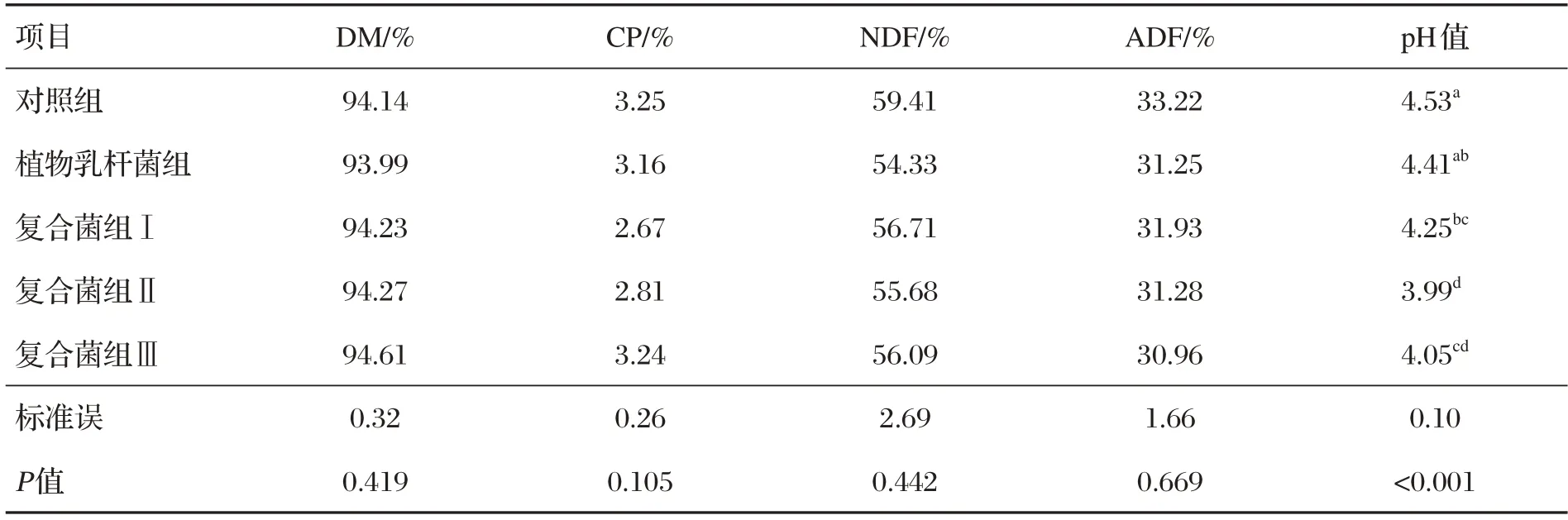
表2 地衣芽孢杆菌与植物乳杆菌复合微贮对稻草营养成分的影响
由表2 可知,微贮30 d 后,植物乳杆菌组、复合菌组Ⅰ、复合菌组Ⅱ、复合菌组Ⅲ微贮稻草的NDF 含量分别比对照组降低了8.6%、4.6%、6.3%、5.6%(P>0.05),ADF含量分别比对照组降低了5.9%、3.9%、5.8%、6.8%(P>0.05)。与对照组相比,复合菌组Ⅰ、复合菌组Ⅱ、复合菌组Ⅲ微贮稻草的pH 值分别降低了6.2%、11.9%、10.6%(P<0.05)。
2.2 地衣芽孢杆菌与植物乳杆菌复合微贮对稻草品质的隶属函数值的影响(见表3)

表3 地衣芽孢杆菌与植物乳杆菌复合微贮对稻草品质的隶属函数值的影响
由表3 可知,复合菌组Ⅲ稻草微贮的隶属函数平均值综合表现最优。
2.3 地衣芽孢杆菌与植物乳杆菌复合微贮对稻草发酵过程中细菌Alpha多样性的影响(见表4)

表4 地衣芽孢杆菌与植物乳杆菌复合微贮对稻草发酵过程中细菌Alpha多样性的影响
由表4 可知,微贮第7 d 时,微贮稻草的Shannon 指数最高,微贮第30 d 的Shannon 指数显著低于第1、3、7、15 d(P<0.05)。微贮第7 d 时,微贮稻草的Simpson指数最低,微贮第7、15 d的Simpson指数显著低于第1 d(P<0.05)。研究表明,稻草微贮过程中细菌群落多样性在第7 d时最高,第30 d时最低。
微贮稻草的Chao 1和Ace指数呈先升高后降低趋势,第7 d最高,微贮第7、15 d的Chao 1、Ace指数显著高于第1 d(P<0.05)。研究表明,稻草微贮过程中细菌群落丰富度呈先升高后降低趋势,第7 d时丰富度最高。
2.4 地衣芽孢杆菌与植物乳杆菌复合微贮对稻草发酵过程中细菌组成的影响(见表5、图1)

图1 稻草发酵过程中细菌门水平和属水平和弦图
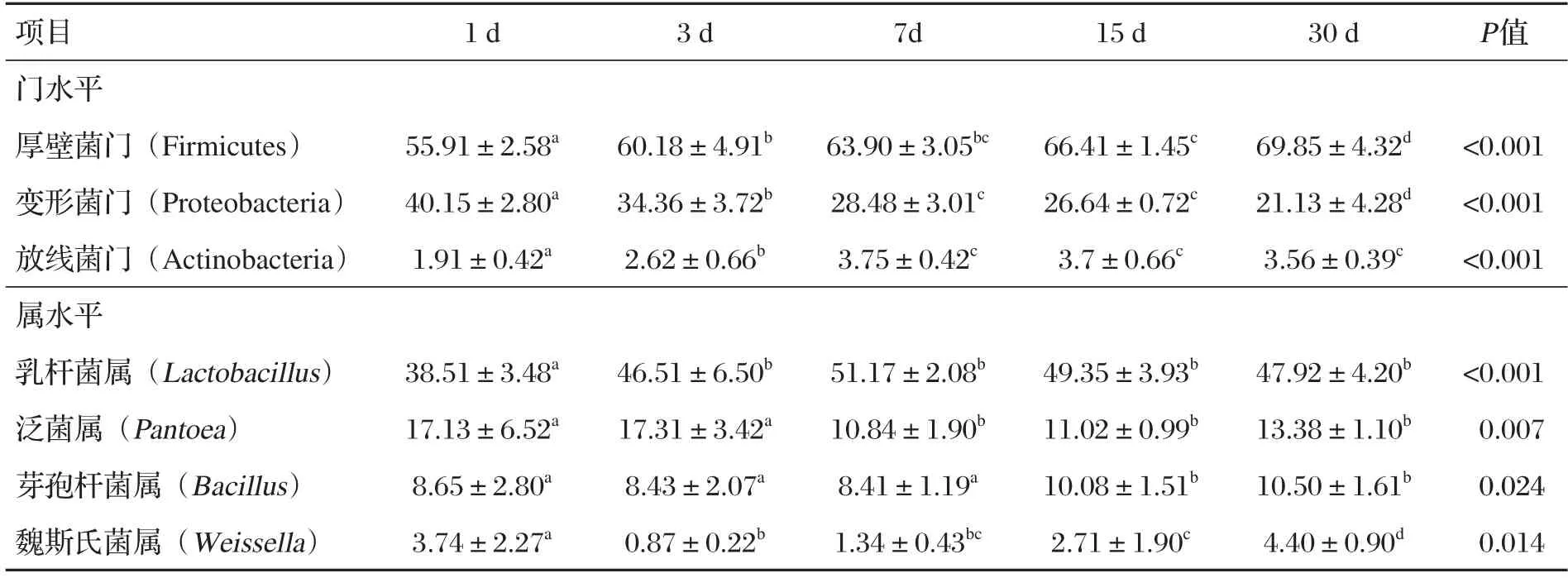
表5 稻草发酵过程中细菌群落的相对丰度 单位:%
由表5、图1可知,在门水平上,稻草发酵过程中的优势菌门为厚壁菌门、变形菌门、放线菌门;厚壁菌门随发酵时间增加而增加;变形菌门随发酵时间增加而减少;放线菌门呈先增加后减少趋势,在第7 d时相对丰度最高。在属水平上,稻草发酵过程中的优势菌属为乳杆菌属、泛菌属、芽孢杆菌属、魏斯氏菌属;发酵第1~3 d,乳杆菌属和泛菌属增加,芽孢杆菌属和魏斯氏菌属减少;第3~7 d,乳杆菌属继续增加达到最高,而泛菌属、芽孢杆菌属开始减少,魏斯氏菌属开始增加;第7~30 d,乳杆菌属减少,泛菌属、芽孢杆菌属和魏斯氏菌属增加。
2.5 稻草发酵过程中微生物功能预测(见图2)
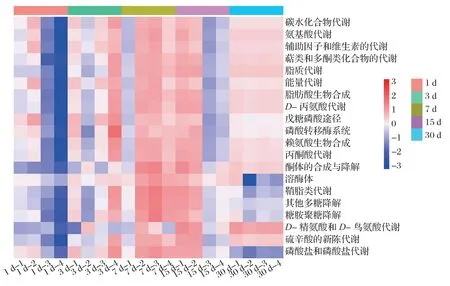
图2 稻草发酵过程中微生物功能预测
用PIRUSt的方法与KEGG数据库比对预测细菌功能选取6条Level 2层级代谢通路和14条Level 3层级代谢通路绘制丰度图。由图2 可知,稻草发酵过程主要涉及的Level 2 层级功能通路包括碳水化合物、氨基酸、辅酶因子和维生素、脂质和能量代谢等;Level 3 层级功能通路包括脂肪酸生物合成、D-丙氨酸代谢和磷酸戊糖途径等。稻草发酵过程中,溶酶体、鞘脂类代谢、其他多糖降解、糖胺聚糖降解、磷酸盐和磷酸盐代谢等途径存在明显差异。
3 讨论
3.1 地衣芽孢杆菌与植物乳杆菌复合微贮对稻草营养成分的影响
在微贮饲料中加入添加剂有助于乳酸菌的增殖,阻碍需氧菌和厌氧菌的增加,从而降低饲料pH 值,减少DM损失[12]。本研究中,与对照组相比,稻草微贮中单独添加植物乳杆菌并未显著降低发酵pH值;与对照组和植物乳杆菌组相比,地衣芽孢杆菌与植物乳杆菌复合后显著降低了稻草发酵pH值,可能与地衣芽孢杆菌独特的生物氧捕获机制快速创造了厌氧环境有关[8]。pH 值是评估发酵饲料发酵程度的重要参数,较低的pH值可确保更好的有氧稳定性,并抑制进一步发酵,pH值降至低于4.5,有助于抑制病原微生物。范子豪[13]研究发现,地衣芽孢杆菌在酸性环境中可以正常生长,在有氧状态下的生长速度远大于无氧状态,在无氧状态下可以利用营养物质产生乳酸。因此,在微贮饲料中加入地衣芽孢杆菌可以快速消耗氧气,有助于乳酸菌生长,产生的乳酸可以快速降低发酵pH值。
Mara 等[14]研究发现,地衣芽孢杆菌具有很强的降解纤维的能力,具有促进ADF 分解的作用。本试验中,添加地衣芽孢杆菌与植物乳杆菌组微贮稻草的NDF和ADF含量均低于对照组,原因可能是地衣芽孢杆菌与植物乳杆菌在降解植物纤维成分方面具有协同作用。NDF 和ADF 有助于生成可溶性碳水化合物,是一种良好的乳酸菌生长促进剂底物,可促进更多乳酸产生,促进发酵过程。此外,结构碳水化合物组分的分解可以提高微贮饲料的消化率。
3.2 地衣芽孢杆菌与植物乳杆菌复合微贮对稻草发酵过程中菌群变化规律的影响
微贮饲料微生物是影响其发酵品质的关键因素,原料表面附着的微生物还是外源添加的微生物在微贮发酵过程中均对微生物群落的演替起重要作用[15]。本试验中,稻草微贮细菌群落的Shannon、Chao1 和Ace 指数在发酵7 d时最高,表明此时稻草发酵中细菌群落丰富度和多样性最高。在本研究中,厚壁菌和变形菌是稻草微贮饲料中丰度最高的前两个门,与之前的研究结果一致[16-19]。厚壁菌是革兰氏阳性菌,主要包括产孢子菌、不产孢子菌和支原体菌,能够降解大分子物质,如纤维素、淀粉、蛋白质等,增加厚壁菌的丰度会提高产酸能力,从而降低pH值,进一步分解ADF[20]。Li等[21]研究发现,使用乳酸菌和糖蜜对本地牧草进行微贮,在微贮的早期阶段(前7 d),乳酸菌的相对丰度增加,随着微贮时间的延长,细菌群落的丰富度下降。Ni 等[22]研究发现,大豆在微贮前7 d乳酸菌数量显著增加,在14 d后减少。本研究中,稻草在微贮前7 d,乳杆菌属丰度随着发酵时间的增加而增加,可能是因为地衣芽孢杆菌与植物乳杆菌复合微贮降低了pH值,抑制了有害微生物的生长,促进了乳杆菌的生长。添加植物乳杆菌可以直接增加乳杆菌属的丰度,而地衣芽孢杆菌可以通过其独特的生物氧捕获机制,快速创造厌氧环境,促进乳杆菌属的快速生长繁殖[23]。魏斯氏菌是发酵饲料中最常见的异型发酵细菌之一,能够产生与乳杆菌属等量的有机酸。研究表明,泛菌属、芽孢杆菌属和魏斯氏菌属等是发酵饲料中的主要菌属,但其丰度与环境和地理位置密切相关[24-26]。
3.3 地衣芽孢杆菌与植物乳杆菌复合微贮对稻草发酵过程中菌群功能预测的影响
乳酸菌将稻草中可用的碳水化合物发酵为丙酮酸,在厌氧条件下丙酮酸在胞质中还原生成乳酸,完成糖的无氧氧化。当饲料中的葡萄糖和果糖水平随着植物呼吸或微生物利用而下降时,只有多糖降解可以增加葡萄糖含量。许冬梅[27]研究发现,添加布氏乳杆菌后,玉米青贮发酵中期糖胺聚糖降解上调,且主要贡献微生物为乳酸杆菌属。本研究发现,在发酵第7 d时糖胺聚糖降解途径显著上调,此时乳酸杆菌属达到最高。本研究中,发酵第7 d 时,D-精氨酸和D-鸟氨酸代谢途径开始上调,表明此时氨基酸的脱氨作用加强,生成的酮酸开始作为菌群发酵的碳源。Keshri等[28]研究发现,氨基酸代谢水平可能反映微贮饲料中细菌种群重新合成氨基酸的能力。磷酸盐和磷酸盐代谢途径的变化可能是由乳酸菌引起,乳酸菌发酵产生的有机酸可溶解磷复合物而具有解磷作用[29]。
乳酸菌和低氧压力产生的有机酸会阻止许多霉菌和有害细菌的生长。霉菌和有害细菌在发酵饲料生长,对线粒体功能产生毒性。Rezabakhsh 等[30]研究发现,线粒体和溶酶体功能障碍,细胞内腺嘌呤核苷三磷酸(ATP)耗竭和过多的活性氧(ROS)生成是霉菌产生毒素的机制。ROS 生成的增加可以使呼吸链和三羧酸循环受到抑制,破坏细胞结构[31]。硫辛酸是一种二硫醇,可通过其两个巯基部分保护机体免受氧化应激。研究表明,硫辛酸及其还原形式二氢硫辛酸可直接清除ROS 和活性氮(RNS),保护细胞免受氧化应激[32-34]。本研究中,硫辛酸的代谢在发酵7 d上调,15 d时开始下调。鞘脂可调节生物膜的生物物理特性,鞘脂类代谢的大部分路径都发生在溶酶体中。溶酶体中鞘脂及其代谢产物会抑制脂质循环,这直接影响细胞膜(包括线粒体内膜)的脂质组成[35]。本研究中,溶酶体新陈代谢和鞘脂类代谢途径在发酵7 d上调,15 d时开始下调。本试验条件下,稻草发酵的7~15 d,硫辛酸、溶酶体和鞘脂类的代谢与霉菌的变化有关。Rocchetti 等[36]研究基于霉菌毒素污染的玉米青贮饲料饲喂奶牛后牛乳中代谢组的变化,结果表明,鞘脂以及嘌呤和嘧啶衍生的代谢物是受影响最大的化学类别。许多研究表明,霉菌毒素污染的饲料会破坏鞘脂类代谢[37-38]。
4 结论
本研究条件下,植物乳杆菌复合地衣芽孢杆菌微贮稻草发酵优于单独添加植物乳杆菌的效果。
