牛大力中总甾醇的提取条件优化、含量测定及抗氧化性研究
2023-07-13石敏谢青梦黄思荣
石敏 谢青梦?黄思荣

摘要:【目的】对牛大力中总甾醇的提取工艺进行优化,建立其含量测定方法,并对其抗氧化性进行初步探究,为进一步开发牛大力价值提供参考。【方法】采用超声提取-分光光度计法,通过正交试验获得牛大力中总甾醇的最佳提取工艺参数和含量测定条件;通过自由基清除试验初步探究其抗氧化性。【结果】结果显示,料液比1∶80、乙醇浓度80%、超声温度50℃、超声功率450 W、超声时间90 min、超声次数2次,测定波长546 nm、5%香草醛-冰醋酸溶液用量0.4 mL、高氯酸用量0.8 mL、水浴温度80℃、水浴时间30 min时,牛大力中总甾醇的提取效果最佳,测定方法的方法学考察结果良好,对DPPH·和ABTS·清除率均达到95%以上。【结论】构建的牛大力总甾醇提取、测定方法简便快捷、提取率高、稳定准确、灵敏度高,可为牛大力价值挖掘、质量控制和天然抗氧化剂开发提供借鉴。
关键词:牛大力;总甾醇;提取;含量测定;抗氧化
中图分类号:S667.9文献标识号:A文章编号:1003-4374(2023)02-00-10
Study on Extraction, Detection and Antioxidant Activity of Total Sterol from
Millettia speciosa Champ.
Shi Min, Xie Qing-meng, Huang Si-rong
(Guangxi Vocational University of Agriculture , Nanning, Guangxi 530007, China)
Abstract: 【Objective】In order to exploiting the value of Millettia speciosa Champ., the extraction condition of total sterol from Millettia speciosa Champ. was optimized, and the determination method was established, the antioxidant activity was evaluated at the same time. 【Method】The optimum extraction process parameters and content determination conditions of total sterols in Millettia speciosa Champ. were obtained by ultrasonic extraction-spectrophotometer method and orthogonal test. Its antioxidant activity was preliminarily explored by free radical scavenging test.【Result】The result showed that the extraction and determination effect were best when material-to-liquid ratio was 1∶80, ethanol concentration was 80 %, ultrasonic temperature was 50℃, ultrasonic power was 450 W, ultrasonic time was 90 min, extraction times was 2, the detection wavelength was 546 nm, the volume of 5%vanillin-glacial acetic acid was 0.4 mL, the volume of perchloric acid was 0.8 mL, the water bath temperature was 80℃, and the water bath time was 30 min. Tests showed that the scavenging rate on DPPH· and ABTS· were above 95%. 【Conclusion】This extraction and analysis method of total sterol from Millettia speciosa Champ. was simple, efficient, accurate and sensitive, which will become reference to exploit the value, control the quality of Millettia speciosa Champ. and develop the natural antioxidants.
Key words: Millettia speciosa Champ., total sterol, extraction, detection, antioxidant activity
牛大力为豆科植物美丽崖豆藤(Millettia speciosa Champ.)的干燥根,分布于长江流域以南各地。牛大力含有多糖、黄酮、甾醇、酚酸和生物碱等多种活性成分[1-4],可用于治疗腰肌劳损、风湿性关节炎、肺热、肺结核、肾虚、慢性支气管炎、慢性肝炎、白带异常、遗精等。[5,6]南方地区,尤其是广东和广西,常将牛大力泡酒、熬汤或煮粥,药食两用,口感甘甜,芳香独特。近几年,牛大力开始以深加工产品的形式出现在市场上。[7-9]
植物甾醇是一种生物活性物质,主要包括谷甾醇和豆甾醇等。现代研究表明,植物甾醇对人体有增强抵抗力的作用,有利于减少细菌感染的风险;植物甾醇可加速胆固醇代谢,抑制胆固醇的吸收,对心脑血管疾病有一定的疗效;同时植物甾醇可促进血液循环,起到活血化瘀的功效。[10-12]植物甾醇还具有一定的抗氧化活性,低浓度的甾醇就能有效抑制自由基的氧化。[13-16]甾醇含量测定方法有:分光光度计法、气相色谱法、高效液相色谱法、气相色谱-质谱法、高效液相色谱-质谱法、薄层色谱法和酶法等。[17-22]其中,气相色谱法样品前处理繁琐,气相色谱-质谱法和高效液相色谱-质谱法对样品制备要求高、分析时间长、耗费高,薄层色谱法准确度低、重复性差,酶法技术要求高。分光光度计法相对简便快捷、准确可靠。目前,尚未有关于牛大力中总甾醇提取工艺及抗氧化性研究的相关报道。本试验采用超声提取-分光光度计法,通过L9(34)正交试验,对牛大力中总甾醇的提取工艺进行优化。通过单因素试验,对总甾醇的测定条件进行优化,同时对该方法的精密度、重復性和稳定性等进行评价。通过清除DPPH·和ABTS·试验,初步探究牛大力中总甾醇的抗氧化性。本试验探索简便快捷、提取率高、稳定准确、灵敏度高的牛大力中总甾醇提取、检测方法,为牛大力深加工提供工艺参数,为牛大力定质分级提供依据,从而有效推动中草药产业的发展。
1 实验材料与方法
1.1 实验材料
牛大力采自广西15个不同产区,由广西药用植物园长期从事药用植物资源调查和物种保育研究工作的彭玉德高级工程师鉴定,确认样品属于豆科植物美丽崖豆藤的根薯部。牛大力用水冲洗干净后自然晾干,于烘箱中干燥至恒重,打成粉状,于干燥器中保存。[23]
β-谷甾醇对照品(纯度:HPLC ≥98%):合肥博美生物科技有限责任公司;无水乙醇(分析纯)和冰醋酸(分析纯):西陇科学股份有限公司;香草醛(分析纯):天津市科密欧化学试剂有限公司;高氯酸(优级纯):上海华谊集团华原化工有限公司;1,1-二苯基-2-苦苯肼自由基(DPPH·)(纯度≥98%):上海源叶生物科技有限公司;抗坏血酸(纯度≥99%):成都市科龙化学品有限公司;2,2-二氮-双-3-乙基苯并噻唑啉-6-磺酸自由基(ABTS·)(纯度≥98%):上海麦克林生化科技有限公司。
1.2 实验设备
UV-2601双光束紫外可见分光光度计:北京北分瑞利分析仪器(集团)有限责任公司;KQ-500DE数控超声波清洗器:昆山市超声仪器有限公司; HWS-24电热恒温水浴锅:上海齐欣科学仪器有限公司。
1.3 实验方法
1.3.1 标准曲线的绘制
精密称取β-谷甾醇对照品10 mg,用无水乙醇溶解并定容至100 mL,即得0.1 mg/mL的β-谷甾醇对照品贮备液,于4℃下避光保存备用。
准确移取0mL、0.1mL、0.2mL、0.4mL、0.6mL、0.8 mL上述β-谷甾醇对照品贮备液,于90℃水浴中挥干乙醇溶剂,加入一定体积的5%香草醛-冰醋酸溶液及高氯酸,水浴中保温一段时间,速冷,加入冰醋酸至5 mL,摇匀,于最大吸收波长处测定吸光度。以β-谷甾醇的质量浓度(ρ)为横坐标,吸光度(A)为纵坐标,进行标准曲线的绘制。
1.3.2 样品的提取和测定
准确称取牛大力粉末,加入一定体积和浓度的乙醇溶液,称定质量,浸泡后超声提取一段时间,冷却后称重并补加提取溶液至原重,采用离心(4000 r/min,10 min)分离出上清液,重复提取数次,合并上清液,得到供试液。
将供试液稀释10倍,准确移取稀释后的供试液1 mL,按“1.3.1”项下步骤显色并测定吸光度,根据公式1-1计算牛大力样品中总甾醇的提取量。
X=ρxVxN/m(1-1)
其中,X为牛大力总甾醇提取量(mg/g);ρ为根据标准曲线方程计算得到的待测液中总甾醇质量浓度(mg/mL);V为待测液体积(mL);N为牛大力 样品稀释倍数;m为牛大力样品质量(g)。
1.3.3 总甾醇提取工艺的优化
(1)单因素试验
准确称取牛大力样品粉末1.0000 g,固定乙醇浓度90%、超声温度50℃、超声功率350 W、超声时间60 min、超声次数1次,考察料液比(1∶40、1∶50、1∶60、1∶70、1∶80)对总甾醇提取量的影响;固定料液比1∶70、超声温度50℃、超声功率350 W、超声时间60 min、超声次数1次,考察乙醇浓度(60%、70%、80%、90%、100%)对总甾醇提取量的影响;固定料液比1∶70、乙醇浓度80%、
超声功率350 W、超声时间60 min、超声次数1次,考察超声温度(30℃、40℃、50℃、60℃、70℃)對总甾醇提取量的影响;固定料液比1∶70、乙醇浓度80%、超声温度50℃、超声时间60 min、超声次数1次,考察超声功率(300 W、350 W、400 W、450 W、500 W)对总甾醇提取量的影响;固定料液比1∶70、乙醇浓度80%、超声温度50℃、超声功率450 W、超声次数1次,考察超声时间(0 min、30 min、60 min、90 min、120 min)对总甾醇提取量的影响;固定料液比1∶70、乙醇浓度80%、超声温度50℃、超声功率450 W、超声时间60 min,考察超声次数(1次、2次、3次)对牛大力总甾醇提取量的影响。
(2)正交试验
根据总甾醇提取条件单因素试验结果,选用L9(34)正交试验对牛大力总甾醇 提取条件进行优化,其中选取的四因素和三水平见表1。
(3)验证试验
按正交试验最优提取组合进行3次平行试验,分别计算牛大力中总甾醇提取量和3次平行试验的RSD,并与正交试验的结果进行对比,评价提取工艺的可靠性。
1.3.4 检测波长的选择
分别精密移取适量β-谷甾醇对照品贮备液和牛大力供试液,按“1.3.1”项下步骤进行显色, 于波长300~900 nm范围内进行扫描,选择测定的波长。
1.3.5 含量测定条件的优化
准确移取β-谷甾醇对照品贮备液0.5 mL,固定高氯酸0.8 mL、水浴温度70℃、水浴时间30 min、显色时间10 min,考察5%香草醛-冰醋酸溶液的用量(0.2 mL、0.3 mL、0.4 mL、0.5 mL、0.6 mL)对吸光度的影响;固定5%香草醛-冰醋酸溶液0.4 mL、高氯酸0.8 mL、水浴时间30 min、显色时间10 min,考察水浴温度(50℃、60℃、70℃、80℃、90℃)对吸光度的影响;固定5%香草醛-冰醋酸溶液0.4 mL、高氯酸0.8 mL、水浴温度80℃、显色时间10 min,考察水浴时间(10 min、20 min、30 min、40 min、50 min)对吸光度的影响;固定5%香草醛-冰醋酸溶液0.4 mL、高氯酸0.8 mL、水浴温度80℃、水浴时间30 min,考察显色时间(0 min、5 min、10 min、15 min、20 min)对吸光度的影响。
1.3.6 精密度试验
选取1份牛大力样品,按“1.3.1”项下步骤进行提取和显色后,连续测定吸光度6次,计算牛大力中总甾醇提取量和RSD,评价该方法的精密度。
1.3.7 重复性试验
选取同一批牛大力样品6份,分别按“1.3.1”项下步骤进行提取和测定,计算牛大力中总甾醇提取量和RSD,评价该方法的重复性。
1.3.8 稳定性试验
选取1份牛大力样品,按“1.3.1”项下步骤进行提取和显色,分别于显色结束60 min内,每间隔10 min测定一次吸光度,计算牛大力中总甾醇提取量和RSD,评价该方法的显色稳定性。
选取1份牛大力样品,按“1.3.1”项下步骤进行提取,将得到的牛大力供试液分别于室温下放置0 h、2 h、4 h、8 h、12 h、24 h、36 h、48 h,再按“1.3.1”项下步骤进行显色测定,评价该方法的样品稳定性。
1.3.9 抗氧化试验
(1)DPPH·清除能力试验
分别准确移取0.010 mg/mL、0.020 mg/ mL、0.030 mg/ mL、0.040 mg/mL、0.050 mg/mL、0.060 mg/ mL、0.080 mg/ mL、0.100 mg/mL、0.125 mg/mL的供试液各5 mL,与1 mL的0.1 mmol/L DPPH溶液充分混合均匀 ,避光处放置反应 30 min,于517 nm处测定得到 A样品;移取无水乙醇5 mL,与1 mL的上述DPPH溶液混合,避光处放置反应 30 min,于517 nm处测定得到 A空白;分别移取上述不同浓度的供试液5 mL,与1 mL的无水乙醇混合,避光处放置反应 30 min,于517 nm处测定得到 A对照。其中,参比为无水乙醇,阳性对照为维生素C。计算公式:
清除率(%)=A空白-A样品+A对照/A空白x100%(1-2)
(2)ABTS·清除能力试验
等体积混合2.5 mmol/L过硫酸钾溶液与7 mmol/ L ABTS溶液,于避光处放置约12 h,即得ABTS贮备液。稀释ABTS贮备液,使其于734 nm处的吸光度值为0.7 ± 0.02,即得ABTS工作液。[24]分别移取0.010 mg/mL、0.020 mg/mL、0.030 mg/ mL、0.040 mg/ mL、0.050 mg/mL、0.060 mg/mL、0.080 mg/ mL、0.100 mg/mL、0.125 mg/mL的供试液1 mL,与2 mLABTS工作液充分混合均匀 ,于734 nm处测定得到A样品;移取无水乙醇1 mL,与2 mL ABTS工作液充分混合均匀 ,于734 nm处测定得到 A空白。其中,参比为无水乙醇,阳性对照为维生素C。计算公式:
清除率(%)=A空白-A样品/A空白x100%(1-3)
2 实验结果与分析
2.1 总甾醇提取的单因素试验结果分析
2.1.1 料液比对总甾醇提取的影响
料液比对总甾醇提取的影响见图1。料液比在1∶40~1∶70范围内,与总甾醇提取量呈正相关;料液比超过1∶70后,溶出量已达到最大值的甾醇不再继续溶出,引起總甾醇提取量不升反降。因此,初步确定最优料液比为1∶70。
2.1.2 乙醇浓度对总甾醇提取的影响
乙醇浓度对总甾醇提取的影响见图2。乙醇浓度在60%~80%范围内,与总甾醇提取量呈正相关;乙醇浓度超过80%后,与总甾醇提取量却呈负相关,这是高浓度乙醇促使部分醇溶性杂质的溶出导致甾醇的溶出受到限制。因此,初步确定最优乙醇浓度为80%。
2.1.3 超声温度对总甾醇提取的影响
超声温度的高低会直接影响分子运动速率的大小,从而引起物质提取量的变化。超声温度对总甾醇提取的影响见图3。超声温度较低时,甾醇物质的溶出速率较慢;超声温度高到一定程度时,除了甾醇物质,还有挥发性的成分和热不稳定的杂质也会相继溶出, 同时高温会加快提取溶剂的挥发,影响提取的效率。因此,初步确定最优超声温度为50℃。
2.1.4 超声功率对总甾醇提取的影响
超声功率对总甾醇提取的影响见图4。牛大力总甾醇提取量先随超声功率的增大而增加,这是由于剧烈的空化效应提高了牛大力细胞的破坏率,加速了甾醇提取 ;当超声功率超过450 W后,大功率的超声波会引起杂质的大量溶出。 因此,初步确定最优超声功率为450 W。
2.1.5 超声时间对总甾醇提取的影响
超声时间对总甾醇提取的影响见图5。牛大力总甾醇提取量先随超声时间的增加而呈增加趋势,表明超声波产生的综合效应有利于物质的析出;超声时间达到60 min时,细胞壁破坏程度较大,内容物提取较多,从而总甾醇提取量最高;超声时间超过60 min后,除了目标物质之外,杂质也大量析出,并吸附目标物质。 因此,初步确定最优超声时间为60 min。
2.1.6 提取次数对总甾醇提取的影响
提取次数对总甾醇提取的影响见图6。总甾醇提取量与提取次数呈正相关,说明少次数的提取会造成提取不彻底,但多次提取又会导致成本增加。因此, 初步确定最优提取次数为2 次。
2.2 总甾醇提取的正交试验结果分析
正交试验设计方案与结果见表2。影响牛大力中总甾醇提取的主次因素顺序 为C>A>B,最优提取组合方式为A3B2C3,即料液比为1∶80,乙醇浓度为80%,超声时间为90 min。根据方差分析结果表3所示,C因素(超声时间)有统计学意义,A因素(料液比)、B因素(乙醇浓度)均无统计学意义。
2.3 验证试验结果分析
验证试验所得牛大力中总甾醇提取量结果分别为22.80 mg/g、22.35 mg/g、22.18 mg/g,所得平均提取量为22.44 mg/g, RSD为1.43%(n=3),所得结果高于正交试验中的任一组,说明该提取工艺稳定可靠。
2.4 含量测定条件优化结果分析
2.4.1 检测波长选择结果分析
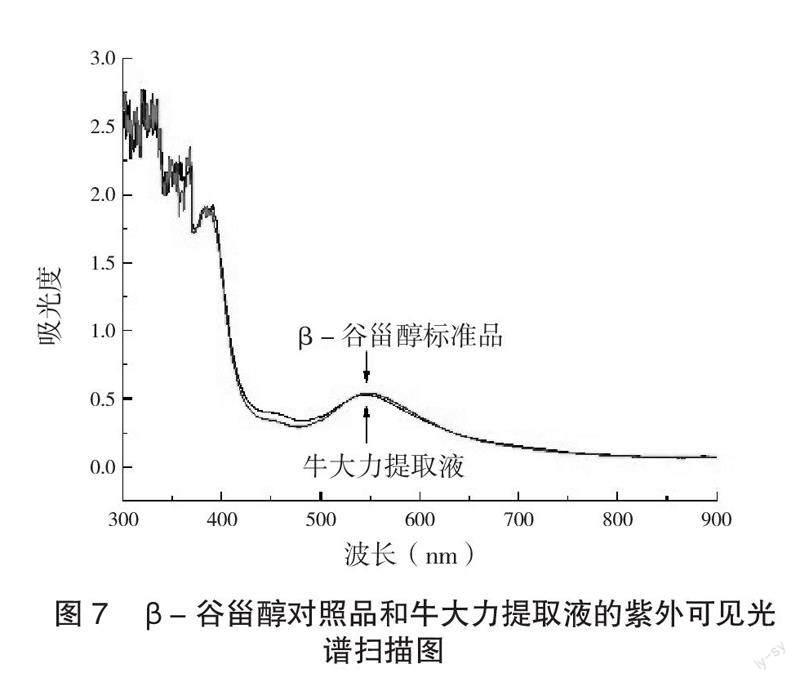
β-谷甾醇对照品和牛大力提取液的紫外可见光谱扫描图见图7。β-谷甾醇对照品和牛大力甾醇提取液均在546 nm处有最大吸收峰。因此,选择546 nm作为牛大力中总甾醇含量测定的检测波长。
2.4.2 5%香草醛-冰醋酸溶液用量对吸光度的影响
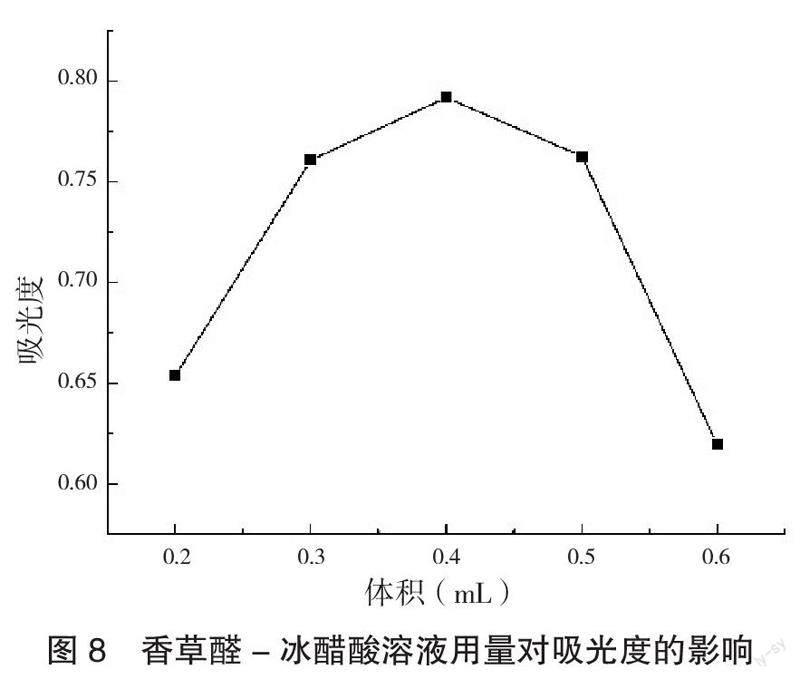
在强氧化性酸的作用下,甾醇可与香草醛试剂发生显色反应,因此5%香草醛-冰醋酸溶液用量对显色反应是否进行的完全存在直接影响。香草醛-冰醋酸溶液用量对吸光度的影响见图8。5%香草醛-冰醋酸溶液用量在0.2~0.4 mL范围内,与吸光度呈正相关;超过0.4 mL后,与吸光度却呈负相关。因此,确定5%香草醛-冰醋酸溶液用量为0.4 mL。
2.4.3 高氯酸用量对吸光度的影响
虽然高氯酸的用量对显色反应也存在显著影响,但不同用量的高氯酸会引起对照贮备液和供试液最大吸收波长的变化。[25]综合考虑,选择高氯酸用量為0.8 mL。
2.4.4 水浴温度对吸光度的影响
水浴温度对吸光度的影响见图9。随水浴温度的增大,吸光度呈现先升高后降低的趋势,水浴温度过低不利于显色反应的发生,水浴温度过高则可能会造成底物和显色试剂的分解。因此,确定水浴温度为80℃。
2.4.5 水浴时间对吸光度的影响
水浴时间对吸光度的影响见图10。吸光度随水浴时间的增大呈现先升高后降低趋势,表明底物显色是否完全受水浴时间长短的限制;水浴时间不够显色反应未完成,水浴时间过长影响甾醇物质和显色物质的稳定性。因此,确定水浴时间为30 min。
2.4.6 显色时间对吸光度的影响
显色时间对吸光度的影响见图11。吸光度随显色时间的增加有所降低,随后趋于稳定,表明水浴时显色反应已完成,水浴结束后可立即进行测定,放置时间越久,显色物质越不稳定。因此,确定显色时间为0 min。
2.5 方法学考察结果分析
2.5.1 线性关系考察结果分析
β-谷甾醇标准曲线见图12。得到线性方程为y=85.853x-0.0003,r=0.9999,说明浓度范围为0.002~0.016 mg/mL的β-谷甾醇与A546之间的线性关系良好。
2.5.2 精密度考察结果分析
精密度试验所得结果显示,牛大力中总甾醇平均提取量为22.23 mg/g,RSD为0.87%(n=6),表明精密度良好。
2.5.3 重复性考察结果分析
重复性试验所得结果显示,牛大力中总甾醇平均提取量为21.99 mg/g,RSD为2.04%(n=6),表明该方法重复性良好。
2.5.4 稳定性考察结果分析
显色稳定性试验所得结果显示,牛大力中总甾醇平均提取量为22.17 mg/g,RSD为1.77%(n=7),表明牛大力供试液在显色60 min内稳定。
样品稳定性试验所得结果显示,牛大力中总甾醇平均提取量为22.03 mg/g,RSD为3.21%(n=8),表明牛大力供试液在48 h内稳定。
2.6 样品测定结果分析
不同产地牛大力中总甾醇含量测定结果见表4。可见不同产地的牛大力中总甾醇含量差异较大,含量范围在6.90~41.56 mg/g,可为广西牛大力产品质量标准的建立提供参考。
2.7 抗氧化性研究结果分析
2.7.1 DPPH·清除能力试验结果分析
牛大力中总甾醇与维生素C对DPPH·清除能力见图13。牛大力甾醇提取液在0.010~0.125 mg/mL浓度范围内,与DPPH·清除率呈正相关;其中最高清除率达到95.4%。与维生素C的抗氧化能力相比,在0.010~0.050 mg/mL浓度范围内,牛大力甾醇提取液对DPPH·清除能力明显弱于维生素C;在0.060~0.125 mg/mL浓度范围内,却与维生素C相当。
2.7.2ABTS·清除能力试验结果分析
牛大力中总甾醇与维生素C对ABTS·清除能力见图14。牛大力甾醇提取液在0.010~0.125 mg/ mL浓度范围内,与ABTS·清除率呈正相关;其中最高清除率达到98.2%。与维生素C的抗氧化能力相比,浓度为0.010~0.080 mg/mL时,牛大力甾醇提取液的ABTS·清除能力明显弱于维生素C;浓度为0.100~0.125 mg/mL时,却与维生素C相当。
3 小结
本研究构建了一种简便高效、准确灵敏的牛大力中总甾醇的提取和含量测定方法,初步探究发现牛大力中的总甾醇具有一定的体外抗氧化性。经过正交试验优化得到最佳条件:料液比为1∶80、乙醇浓度为80%、超声温度为50℃、超声功率为450 W、超声时间为90 min、超声次数为2次,测定波长为546 nm、5%香草醛-冰醋酸溶液用量为0.4 mL、高氯酸用量为0.8 mL、水浴温度为80℃、水浴时间为30 min。本研究对牛大力产品的定量分析,牛大力加工产品的研制,天然抗氧化产品的开发均具有较大的指导作用。
参考文献:
[1]王祝年,赖富丽,王茂媛,等.牛大力根的化学成分研究[J].热带作物学报,2011,32(12):2378-2380.
[2]王呈文,陈光英,宋小平,等.牛大力的化学成分研究[J].中草药,2014,45(11):1515-1520.
[3]伍月榕,彭丽珊,肖健.牛大力主要化学成分及药理作用的研究进展[J].湖南中医药大学学报,2020,40(4):503-506.
[4]赵震宇,刘平怀,马莎莎,等.药食同源植物牛大力的研究进展(英文)[J].食品科学,2017,38(9):293-306.
[5]全国中草药汇编编写组.全国中草药汇编·上册[M].北京:人民卫生出版社,1986:200.
[6]国家中医药管理局《中华本草》编委会.中华本草[M].上海:上海科学技术出版社,1999:572.
[7]赵琤,黄友琴,潘嫣丽,等.牛大力绿茶保健植物饮料的开发研究[J].广西农学报,2021,36(5):33-42.
[8]赵琤,黄友琴,唐婷,等.牛大力绿茶保健植物饮料开发市场分析[J].广西农学报,2019,34(5):58-62.
[9]王茂媛,羊青,王清隆,等.牛大力速溶茶的研制加工[J].热带农业科學,2016,36(9):92-96.
[10]Piironen V,Lingdsay D G,Miettinen T A,et al. Plant sterols: biosynthesis, biological function and their importance to human nutrition[J]. fournal of the Science of food and agriculture 2000,7(7):939-966.
[11]韩军花.植物甾醇的性质、功能及应用[J].国外医学卫生学分册,2001,28(5):285-291.
[12]吴时敏,吴谋成.植物甾醇的研究进展与趋向
(Ⅰ):植物甾醇的基础研究[J].中国油脂,2002,27(2):73-75.
[13]何荣军,周菲,赵月钧,等.灵芝总甾醇的闪式提取工艺优化及其抗氧化活性[J].食品与发酵工业,2013,39(9):200-204.
[14]王晨慧,李春扬,张晓磊,等.山药酒中甾醇含量测定及清除DPPH自由基活性研究[J].中国酿造,2020,39(11):62-65.
[15]赵雁武,王宪伟,黄滢璋,等.苹果籽油中植物甾醇抗氧化活性研究[J].西北农林科技大学学报(自然科学版),2012,40(9):221-226.
[16]彭昕,黄亮,王平,等.雷竹笋总黄酮和总甾醇的抗氧化性与抑菌性[J].经济林研究,2017,35(3):179-185.
[17]徐小军,余国珍,陈鉴东.硫磷铁法测定大豆甾醇提取物中总甾醇含量[J].中国药业,2010,19(8):35-36.
[18]邹燕娣,包李林,熊巍林,等.氧化铝固相萃取-气相色谱快速测定植物油中甾醇含量[J].食品工业,2018,39(6):253-256.
[19]杨静,白冰,刘绣华,等.HPLC法同时测定山药中的植物甾醇[J].食品科技,2019,44(6):321-325.
[20]曾婉俐,米其利,李晶,等.高效液相色谱串联质谱法快速测定烟草中5种甾醇的研究[J].化学研究与应用,2019,31(11):1879-1885.
[21]刘海霞,仇农学,王峰,等.苹果籽油中植物甾醇含量的薄层色谱-分光光度法测定[J].中国油脂, 2008,33(11):76-79.
[22]李文庆,孙敏甜,李文佳,等.HPLC-ELSD法同时测定冬虫夏草中3个甾醇的含量[J].时珍国医国药,2018,29(4):862-864.
[23]石敏,吴桂妮,蓝淼杏.牛大力总酚酸提取工艺优化、定量分析及抗氧化活性研究[J].食品工业,2022,43(9):82-87.
[24]李斌,雷月,孟宪军,等.响应面试验优化超声波辅助提取蓝靛果多酚工艺及其抗氧化活性[J].食品科学,2015,36(22):33-39.
[25]盛卫国,叶剑锋,徐勇,等.紫外-可见分光光度法测定普乐安片中总甾醇含量[J].中国医药导报,2012,9(23):8-9,13.
(责任编辑:黎月娟)
