湖北枫杨总黄酮对非小细胞肺癌A549细胞的影响及机制研究
2023-07-12侯孜明吴昊冯佳洪岚张宗星刘道忠江露袁林
侯孜明 ,吴昊 ,冯佳 洪岚 ,张宗星 ,刘道忠 ,江露 ,袁林
1.湖北民族大学风湿性疾病发生与干预湖北省重点实验室,湖北 恩施 445000;
2.湖北民族大学医学部,湖北 恩施 445000; 3.湖北恩施学院,湖北 恩施 445000
肺癌是全球癌症死亡的主要原因之一。据统计,2020年肺癌约占癌症相关死亡总数的18%[1]。肺癌主要分为非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC),其中NSCLC占80%~85%。西医主要采用放疗、化疗、靶向治疗和免疫治疗,但患者的五年生存率仅15%左右,且治疗伴有严重不良反应,包括肾毒性、骨髓抑制及胃肠道反应,给患者带来严重的负担和痛苦[2-3]。因此,探索治疗NSCLC的新药物具有重要意义。
中药对多种疾病具有良好的治疗效果,能通过多靶点、多途径发挥作用。《中国植物志》记载枫杨属Pterocarya Kunth植物包括湖北枫杨、枫杨、越南枫杨、水胡桃、华西枫杨、甘肃枫杨、云南枫杨7种[4],其中湖北枫杨、华西枫杨、甘肃枫杨和云南枫杨为我国特有。枫杨中含有丰富的黄酮类化合物[5]。药理研究表明,枫杨具有抗菌、抗炎、抗糖尿病、抗肿瘤等作用[6-8]。本研究观察湖北枫杨总黄酮对人肺癌A549细胞增殖的影响,探讨其可能的作用机制,为NSCLC治疗提供实验依据。
1 实验材料
1.1 细胞
人非小细胞肺癌A549细胞,购于中国科学院细胞库。采用RPMI 1640培养基(含10%胎牛血清和1%青链霉素),于37 ℃、5%CO2培养箱中培养。
1.2 药物及制备
本研究使用枫杨树皮采于湖北省恩施州,经湖北民族大学医学院李厚聪老师鉴定为湖北枫杨Pterocarya hupehensisSkan的干燥树皮。采用超声辅助提取总黄酮,D101大孔树脂分离纯化,获得纯化的湖北枫杨总黄酮,以芦丁为标准品,测得总黄酮纯度为78%。先用DMSO 溶解,使用时以培养基稀释(DMSO终浓度不超过0.1%)。
1.3 主要试剂及仪器
RPMI 1640 培养基(批号8121319),美国Gibco公司;胎牛血清(批号2140301),上海逍鹏生物科技有限公司;青链霉素(批号1857816),美国Gibco公司;CCK-8 试剂盒(批号NQ646),日本同仁公司;DMSO(批号RNBJ9551),美国Sigma公司;芦丁标准品(批号2012008),广州硕谱生物科技有限公司;D-101大孔吸附树脂(批号20200916),国药集团化学试剂有限公司;PMSF 蛋白酶抑制剂(批号101321211021),碧云天生物技术有限公司;RIPA裂解液(批号CR2107001),武汉塞维尔生物科技有限公司;细胞凋亡检测试剂盒、细胞周期检测试剂盒(批号分别为A10523、A10431),杭州联科生物技术股份有限公司;预染蛋白Marker(批号01081673),美国Thermo 公司;PVDF 膜、ECL 发光液(批号分别为R1BB06918、2106001),美国Millipore 公司;SDSPAGE凝胶配制试剂盒(批号MA0383-Nov-01G),大连美仑生物;Fas、Bax、Bcl-2、Cyclin D1、P27抗体(批号分别为0200390102、3560005119、3560219203、0003210101、4000000455),武汉爱博泰克生物科技有限公司;山羊抗兔IgG、山羊抗小鼠IgG、β-actin抗体(批 号 分 别 为20000311、20000275、10004156),Proteintech 公司;Cleaved Caspase-3 抗体(批号15z0096),维百奥(北京)生物科技有限公司。
IX73 型倒置荧光显微镜(日本Olympus 公司),TU-1901双光束紫外可见分光光度计(北京普析通用仪器有限责任公司),FD8-8真空冷冻干燥机(瑞士Buchi公司),TH-100BQX数控超声仪(美国GOLO-SIM公司),311 型CO2细胞培养箱(美国Thermo Fisher Scientific 公司),ImageQuant LAS4000mini 生物分子成像仪(日本GE公司),Multiscan Go酶标仪(美国Thermo Fisher Scientific公司),SH800流式细胞分选仪(日本SONY公司)。
2 实验方法
2.1 CCK-8法检测细胞存活率
取对数生长期细胞,经胰酶消化后用RPMI 1640培养基将细胞调整为5×104个/mL,接种于96孔板,每孔100 μL,置于培养箱培养过夜,加入0(对照组)、25、50、100、150、200 μg/mL湖北枫杨总黄酮,每组6个复孔,另设空白组调零,继续培养24、48 h,每孔加入CCK-8工作液10 μL,放入培养箱孵育1 h,酶标仪波长450 nm测定各孔吸光度(A值),计算细胞存活率。细胞存活率(%)=(实验组A值-空白组A值)÷(对照组A值-空白组A值)×100%。
2.2 细胞凋亡检测
将A549细胞按1×105个/mL接种至6孔板,每孔2 mL,置于培养箱培养过夜。将细胞分为对照组和枫杨总黄酮低、中、高剂量组,分别加入相应培养基培养24 h,预冷PBS 洗涤,收集细胞,加入1×binding buffer 500 μL 重悬细胞,每个样本分别加入Annexin V-FITC 5 μL和碘化丙啶10 μL,涡旋混匀后,室温避光孵育5 min,流式细胞仪上机检测,采用FlowJo软件进行分析。
2.3 细胞周期检测
将A549细胞按1×105个/mL接种至6孔板,每孔2 mL,置于培养箱培养过夜。将细胞分为对照组和枫杨总黄酮低、中、高剂量组,分别加入相应培养基培养24 h,收集细胞,PBS洗涤,预冷无水乙醇-20 ℃固定过夜,将固定细胞洗涤、沉淀后,加入DNA 染色液1 mL,涡旋振荡5~10 s混匀,室温避光孵育30 min,流式细胞仪上机检测,采用FlowJo软件进行分析。
2.4 Western blot检测
将A549细胞按1×105个/mL接种至6孔板,每孔2 mL,置于培养箱培养过夜。将细胞分为对照组和枫杨总黄酮低、中、高剂量组,分别加入相应培养基培养24 h。加入含PMSF的RIPA裂解液冰上裂解,BCA法测定蛋白浓度并加热使蛋白变性,进行SDS-PAGE,转至PVDF膜,TBST洗膜,用5%脱脂奶粉室温封闭2 h,TBST洗膜3次(5 min/次),分别加入Fas、Bax、Bcl-2、Cleaved Caspase-3、Cyclin D1、P27 一抗(均为1∶1 000),4 ℃孵育过夜,TBST洗膜,加入二抗(1∶10 000),室温孵育2 h,多功能凝胶成像仪进行化学发光显影,采用Image J软件进行灰度分析。
3 统计学方法
采用SPSS20.0 统计软件进行分析。计量资料以±s表示,组间比较采用方差分析。P<0.05表示差异有统计学意义。
4 结果
4.1 湖北枫杨总黄酮对A549细胞存活率的影响
与对照组(0 μg/mL)比较,不同浓度(25、50、100、150、200 μg/mL)湖北枫杨总黄酮处理细胞24、48 h对细胞增殖有明显抑制作用(P<0.05,P<0.01),结果见图1。为避免药物毒性对细胞的影响,后续实验以100、150、200 μg/mL枫杨总黄酮作为低、中、高剂量处理A549细胞,作用时间24 h。
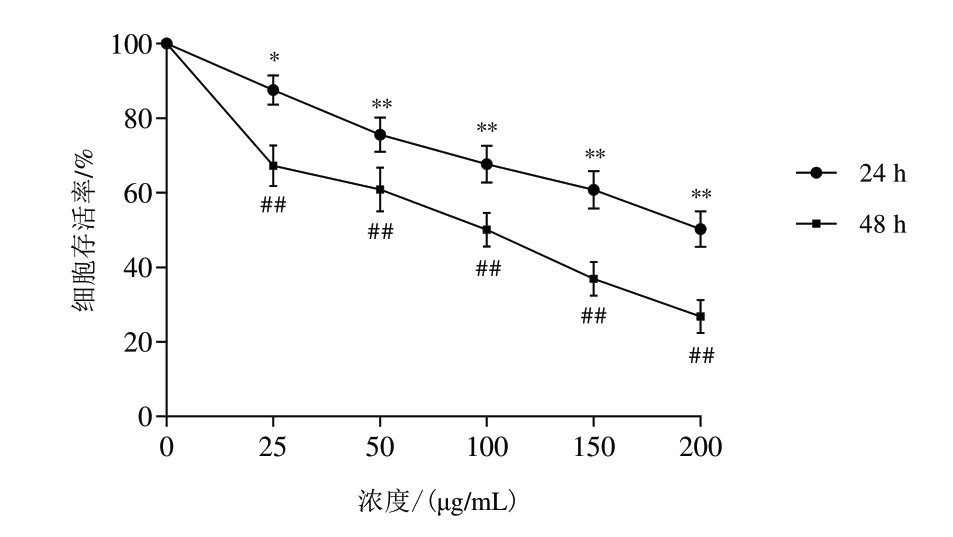
图1 不同浓度湖北枫杨总黄酮对A549细胞增殖的影响(±s,n=6)
4.2 湖北枫杨总黄酮对A549细胞形态的影响
对照组细胞生长状态良好,存活细胞数量多,细胞呈梭形,细胞间隙较小、连接紧密,少见漂浮细胞;枫杨总黄酮各剂量组存活细胞数量明显减少,细胞排列松散,间隙明显增宽,培养基中可见大量漂浮细胞,随着药物浓度增加,细胞状态变差更为明显。见图2。
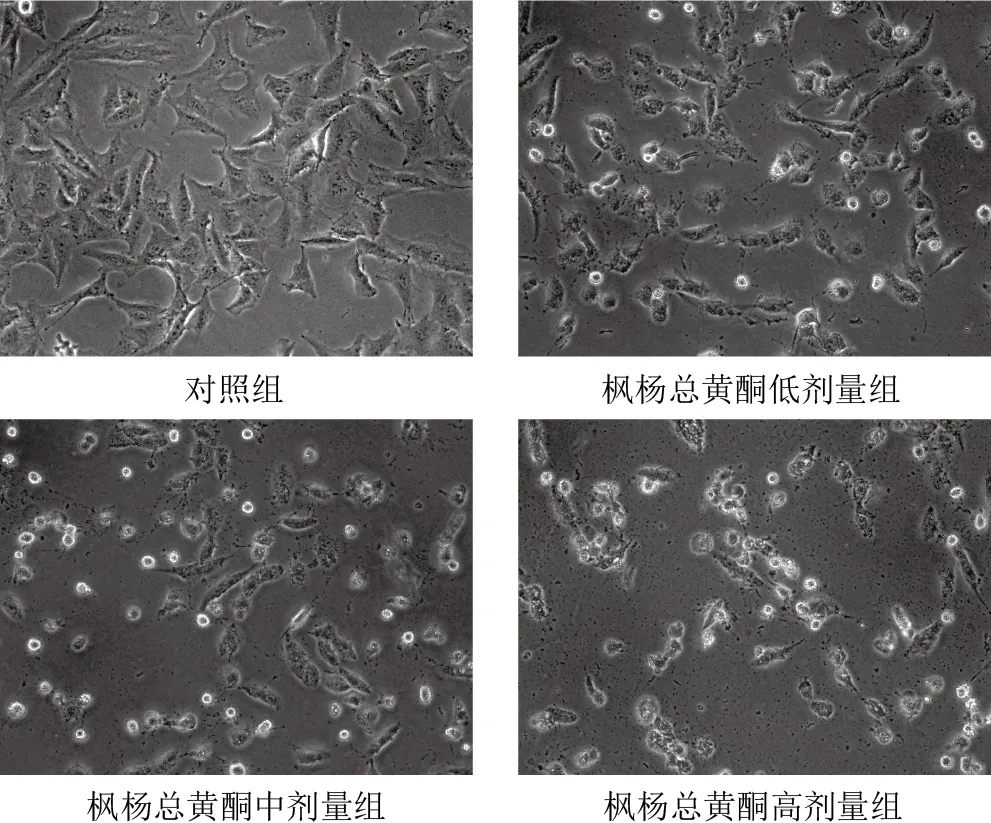
图2 各组A549细胞形态(×400)
4.3 湖北枫杨总黄酮对A549细胞凋亡的影响
流式细胞术检测结果显示,与对照组比较,枫杨总黄酮各剂量组A549细胞凋亡率明显升高(P<0.01)。见表1、图3。
表1 各组A549细胞凋亡率比较(±s,%)
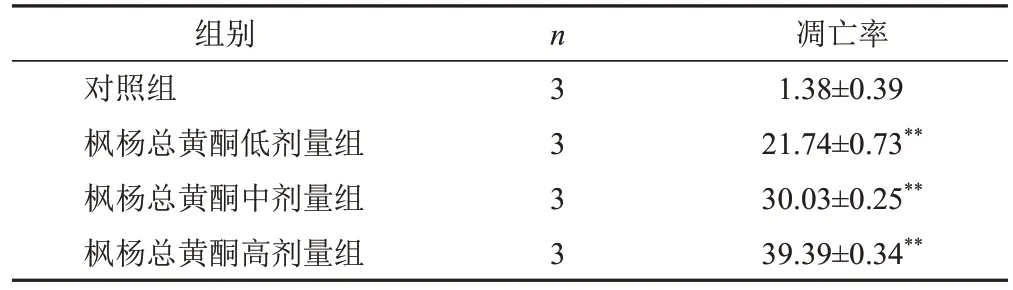
表1 各组A549细胞凋亡率比较(±s,%)
注:与对照组比较,**P<0.01
凋亡率1.38±0.39 21.74±0.73**30.03±0.25**39.39±0.34**组别对照组枫杨总黄酮低剂量组枫杨总黄酮中剂量组枫杨总黄酮高剂量组n 3 3 3 3
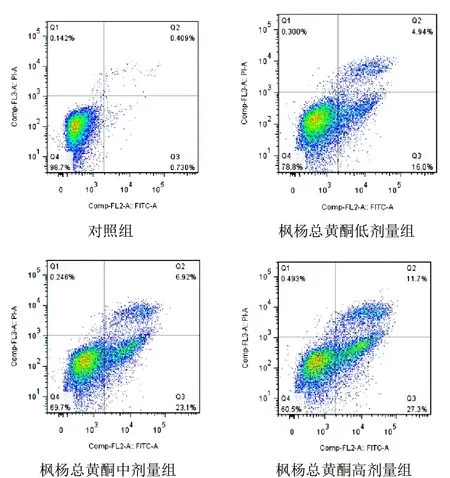
图3 各组A549细胞凋亡检测流式图
4.4 湖北枫杨总黄酮对A549细胞周期的影响
流式细胞术检测结果显示,与对照组比较,枫杨总黄酮各剂量组A549细胞G0/G1期比例明显增加(P<0.01),S期细胞比例明显减少(P<0.01)。见表2。
表2 各组A549细胞周期比较(±s,%)
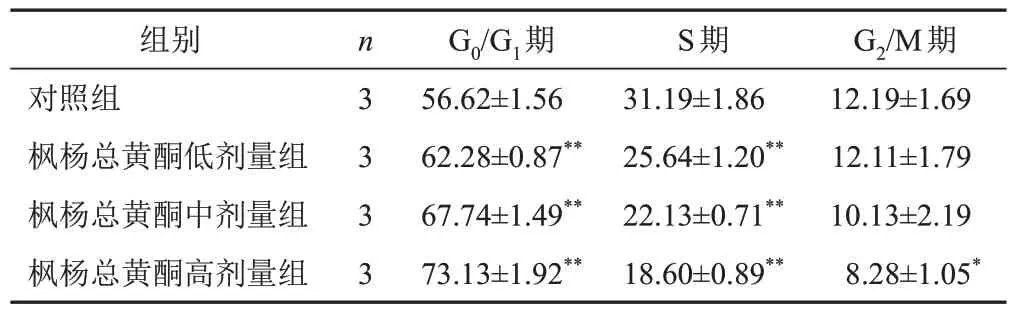
表2 各组A549细胞周期比较(±s,%)
注:与对照组比较,*P<0.05,**P<0.01
组别对照组枫杨总黄酮低剂量组枫杨总黄酮中剂量组枫杨总黄酮高剂量组G2/M期12.19±1.69 12.11±1.79 10.13±2.19 8.28±1.05*n 3 3 3 3 G0/G1期56.62±1.56 62.28±0.87**67.74±1.49**73.13±1.92**S期31.19±1.86 25.64±1.20**22.13±0.71**18.60±0.89**
4.5 湖北枫杨总黄酮对A549细胞凋亡和细胞周期相关蛋白表达的影响
Western blot结果显示,与对照组比较,枫杨总黄酮各剂量组细胞Fas、Bax、Cleaved Caspase-3、P27蛋白表达明显升高,Cyclin D1 蛋白表达明显降低(P<0.05,P<0.01),枫杨总黄酮中、高剂量组细胞Bcl-2蛋白表达明显降低(P<0.01)。见图4。
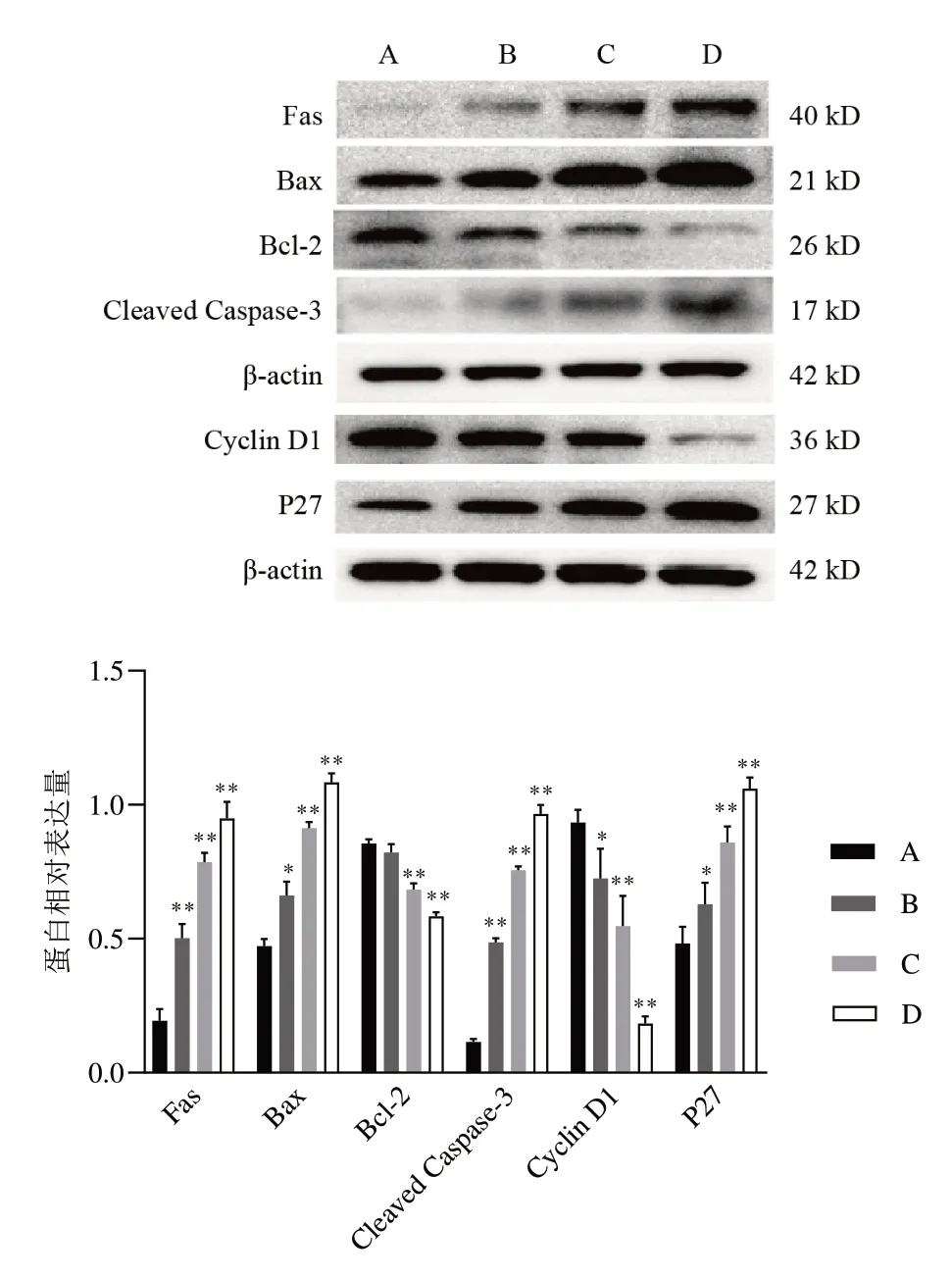
图4 各组A549细胞凋亡和周期相关蛋白表达比较(±s,n=3)
5 讨论
细胞增殖和凋亡失调与肿瘤进展密切相关,细胞凋亡在细胞生长发育中起重要作用,诱导肿瘤细胞凋亡已成为癌症治疗的一种策略[9-10]。细胞凋亡主要存在内在(线粒体)途径和外在死亡受体途径[11]。Bcl-2家族蛋白是内在途径的中心调节因子,通过调节cyt-c和其他凋亡相关蛋白表达改变线粒体膜通透性,从而调节细胞凋亡[12-13],主要由促凋亡蛋白(如Bax)和抗凋亡蛋白(如Bcl-2)组成,Bax和Bcl-2蛋白表达水平是决定细胞是否进入凋亡途径的关键因素[14-15];在外源性死亡受体通路中,Fas是一种细胞表面蛋白,是重要的死亡受体之一[16],通过与抗体或Fas配体(FasL)交联可介导快速凋亡[17]。有研究表明,Fas在包括肺癌在内的各种癌症中表达下调[18]。以上2种途径最终会导致Caspase家族蛋白激活,特别是作为关键效应因子的Caspase-3[19]。在正常情况下,Caspase-3以无活性前体存在于细胞中,在应激条件下被切割以产生介导细胞凋亡的活性片段,Caspase-3激活是细胞进入不可逆凋亡阶段的标志[20-22]。本研究通过流式细胞术检测枫杨总黄酮对A549细胞凋亡的影响,发现其可促进细胞凋亡,并且可以上调死亡受体蛋白Fas、促凋亡蛋白Bax表达,降低抗凋亡蛋白Bcl-2表达,促进Caspase-3活化,上调Cleaved Caspase-3 蛋白表达(P<0.05,P<0.01)。提示湖北枫杨总黄酮可能通过激活内在途径和外在途径促进A549细胞凋亡。
除细胞凋亡外,细胞周期停滞是抑制癌细胞增殖的另一作用机制[23]。在细胞周期进程中,主要由细胞周期蛋白Cyclins、细胞周期蛋白依赖性激酶(Cdks)及Cdks抑制剂共同协调发挥作用。Cdks本质上是无活性的催化亚基,需要与激活伴侣细胞周期蛋白(关联的调节亚基)结合,形成Cyclin-Cdk复合物以发挥在细胞增殖中的作用。另外,Cyclin-Cdk复合物可以与Cdks抑制剂结合,从而抑制激酶活性并阻止细胞周期进程[24-25]。因此,细胞周期受特定周期相关蛋白的正向调节,并受某些Cdks抑制因子的负向调节。Cyclin D1是调节G1期最重要的蛋白,P27是一种Cdks抑制剂,主要抑制从G1期到S期转变的Cdks[26-27]。本研究结果表明,湖北枫杨总黄酮可以调节A549细胞Cyclin D1和P27蛋白表达,诱导A549细胞G0/G1期阻滞,即湖北枫杨总黄酮作用A549细胞后可能干扰DNA的合成,并可能在此阶段抑制A549细胞增殖。
综上所述,湖北枫杨总黄酮能抑制A549细胞增殖,其机制可能与激活线粒体和Fas介导的死亡受体通路以诱导A549细胞凋亡、促进A549细胞G0/G1期阻滞有关。
