大菱鲆肠道乳杆菌Lactobacillus sp.N5 的筛选鉴定及其抑制水产病原菌的研究
2023-07-12包瑞璇周皓隆方再郗卢静吕明生王淑军
包瑞璇,周皓隆,方再郗,卢静,吕明生,王淑军
(1.江苏海洋大学海洋生物资源与环境重点实验室/海洋生物技术重点实验室,江苏 连云港 225005;2.江苏省海洋生物产业技术协同创新中心,江苏 连云港 222000)
乳酸菌是发酵糖类产生乳酸、过氧化氢酶阴性和革兰氏阳性细菌的通称[1,2],其厌氧或兼性厌氧,对营养要求比较高[3-5]。在水产养殖中,乳酸菌是微生态制剂的重要菌种之一。乳酸菌产生的有机酸可以降低鱼虾肠道内的pH,抑制病原菌在肠道的定植[6,7];分泌的消化酶可以促进水产动物的生长[8,9]。黄浦江等[10]采用乳酸菌降解作用降低凡纳对虾(Litopenaeus vannamei)养殖水体中的有机物,降低氨氮、亚硝酸盐等的含量,净化水质。殷海成等[11]在饲料中添加乳酸杆菌后,显著提高了鲤(Cyprinus carpio)末重、增重率和生长率。衣启麟等[12]将嗜酸乳杆菌投喂给凡纳对虾,有效抑制了病菌侵入引起的细胞凋亡,降低了对虾的死亡率。
从健康水产动物肠道中筛选乳酸菌是获得优良菌株的重要手段之一[13,14]。我国水产养殖的密度较高,受病原微生物侵染的潜在威胁大[15]。通过乳酸菌定植于水产动物肠道,调节宿主免疫功能,促进营养物质的吸收和利用[18,9],可以降低抗生素的使用,实现绿色健康养殖,保障食品安全,提高经济效益[20-22]。海州湾海水养殖大菱鲆(Scophthalmus maximus)和凡纳对虾的病害日益增多[21],病原菌主要有鳗弧菌(Vibrio anguillarum)、哈维氏弧菌(V.harveyi)、嗜水气单胞菌(Aeromonas hydrophila)等[22];弧菌病一直是凡纳对虾养殖的重要病害[23]。本研究通过从健康大菱鲆肠道内分离乳酸菌,研究其特性,以筛选适用于海水养殖鱼虾的益生菌。
1 材料与方法
1.1 材料
1.1.1 材料与试剂
大菱鲆和凡纳对虾购于江苏省连云港市海鲜市场。哈维氏弧菌(Vibrio harveyi)、副溶血弧菌(V.parahaemolyticus)、嗜水气单胞菌(Aeromonas hydrophila)、鳗弧菌(V.anguillarum)、金黄色葡萄球菌(Staphylococcus aureus)、枯草芽孢杆菌(Bacillus subtilis)和大肠杆菌(Escherichia coli)均为实验室保藏。MRS 固体培养基和MRS 肉汤培养基(北京陆桥技术股份有限公司);大豆蛋白酶、脂肪酶、猪胃蛋白酶、牛胰蛋白酶、木瓜蛋白酶、碱性蛋白酶、卡纳霉素、氨苄青霉素、庆大霉素和罗红霉素(阿拉丁工业公司)。细菌基因组DNA 快速抽提试剂盒(天根生化科技有限公司),乳酸、过氧化氢和过氧化氢酶(生物工程上海股份有限公司)。
1.1.2 主要仪器与设备
小型离心机(Eppendorf 仪器公司),PCR 扩增仪(伯乐生命医学产品公司),电泳槽和电泳仪(北京六一仪器厂),pH 计(上海梅特勒-托利多仪器公司),酶标仪(Bio-Rad Laboratories),SPX-150C 型生化培养箱,上海博讯实业有限公司。
1.2 方法
1.2.1 乳酸菌的筛选
取健康大菱鲆肠道5 g 研磨,用无菌生理盐水梯度稀释后,涂布于MRS 平板(含1%碳酸钙)上,37℃下静置培养24 h。挑取白色光滑圆润、有透明圈的菌落三区划线,纯化二次,斜面保藏[24]。
1.2.2 菌株的鉴定
触酶试验:挑取培养菌苔置于洁净的玻片上,在其上加一滴3%过氧化氢,观察结果,30 s 内有气泡产生为阳性菌,反之为阴性[25]。保留触酶阴性菌株进行下一步试验。
革兰氏染色:挑取新培养20 h 的纯培养物,用革兰氏染色法染色,以大肠杆菌和金黄色葡萄球菌为对照,保留革兰氏阳性菌株进行下一步试验[25]。
16S rDNA 鉴定:选用细菌鉴定通用引物27F 和1492R 进行PCR 扩增,电泳检测后寄上海生工检测,提交序列到NCBI 比对,用MEGA7 软件,采用邻接法构建系统进化树[26]。
1.2.3 乳酸菌抑菌活性检测
采用牛津杯法测定发酵上清液的抑菌活性。指示菌分别为鳗弧菌、哈维氏弧菌、副溶血弧菌、嗜水气单胞菌、金黄色葡萄球菌、枯草芽孢杆菌和大肠杆菌。取菌悬液50 μL 涂布于LB 固体平板上,将牛津杯均匀旋转并加入200 μL 发酵上清液,37℃培养12~24 h 后,测量抑菌圈直径,以未接种的MRS肉汤培养基上清液作为对照,设三个平行样,测量后取平均值。
1.2.4 乳酸菌的耐药性检测
采用滤纸片法测定乳酸菌对抗生素的敏感性。取50 μL 菌悬液涂布于MRS 平板上,将灭菌的滤纸片旋转后分别滴加5 μL 卡纳霉素、氨苄青霉素、庆大霉素和罗红霉素(100 μg/mL)。37℃培养12 h后,测量抑菌圈直径。
1.2.5 乳酸菌生物被膜形成能力检测
1.2.6 发酵乳杆菌发酵上清液的制备
菌株按2%的接种量接入25 mL 的MRS 肉汤培养基,37℃培养18 h,培养液10 000 r/min 离心5 min,取上清液,用0.22 μm 滤器过滤,备用。
1.2.7 指示菌菌悬液的制备
指示菌菌株按2%接种量接入LB 肉汤培养基中,30℃静置培养10 h。
1.2.8 菌株发酵液抑菌物质的鉴定
过氧化氢:在发酵上清液中加入1.5 mg/mL 的过氧化氢酶,对照组不用过氧化氢酶处理,在37℃水浴作用2 h,排除发酵液中过氧化氢的作用。以鳗弧菌为指示菌,采用牛津杯法检测抑菌能力[28]。
有机酸产物:鉴定发酵上清液中起抑菌作用的是否为有机酸等物质。将菌株发酵液用1 mol/L NaOH 和1 mol/L HCl 调节pH 至5.0,分别用乳酸、乙酸和盐酸调节pH 为5.0 的MRS 肉汤作对照组,检测其对鳗弧菌的抑菌能力[29]。
1.2.9 温度对发酵上清液抑菌性能的影响
“正直,”他瞪大眼睛一边揉着大腿说,“对公牛般神气的财神爷来说是一块红布,换句话说,正直是穷人的遮羞布。”(2014:431)
将菌株上清液的pH 调至5.0,分别在30℃、37℃、60℃、80℃、105℃下水浴30 min,灭菌的MRS肉汤为对照组,检测其对鳗弧菌的抑菌能力。
1.2.10 蛋白酶敏感试验
将菌株发酵液的pH 调至大豆蛋白酶、脂肪酶、猪胃蛋白酶、牛胰蛋白酶、木瓜蛋白酶和碱性蛋白酶的最适pH(分别为8.0、7.5、2.5、8.6 和10.0),37℃恒温水浴2 h、4 h,沸水10 min 使酶失活,再将pH 调为5.0,以处理0 h 和未处理发酵液为对照,采用牛津杯法检测抑菌作用[30]。
1.2.11 致病菌感染试验
将150 mL 浓度为1×103cfu/mL(秋季)、2×103cfu/mL(夏季)的鳗弧菌、哈维氏弧菌和菌株N5 分别加入15 L 盐浓度为2%的水中,对照组三组:盐水对照(C);MRS 和盐水混合(M);LAB 和盐水混合(L)。试验组为:菌株N5 和盐水混合(N);哈维氏弧菌和盐水混合(H);哈维氏弧菌与菌株N5 和盐水混合(H+N);鳗弧菌和盐水混合(V);鳗弧菌与N5 和盐水混合(V+N);哈维氏弧菌与鳗弧菌与菌株N5 和盐水混合(H+V+N)。其中只有H+V+N 组中,哈维氏弧菌与鳗弧菌分别是75 mL。先加入菌株N5 菌液试养5 d,待虾生存稳定后,加入致病菌,观察7 d,记录凡纳对虾的存活[31]。
1.2.12 菌株N5 对病原菌形成生物膜的影响
在24 孔板中加入1 mL MRS 培养基和培养至对数生长期的鳗弧菌或哈维氏弧菌1 mL,菌株N5发酵上清的加入是亦为1 mL。分组同1.2.11。30℃培养24 h 后弃去培养液,检测病原菌的生物膜[32],方法同1.2.5。
1.3 数据分析
数据用平均值加标准差表示,应用SPSS 20 统计软件进行。试验均设置三个平行,进行均值检验、方差齐性检验、显著性检验、单因素方差分析,采用Origin 9.0 绘图。
2 结果与分析
2.1 乳酸菌的筛选
从大菱鲆肠道中分离出22 株具有溶钙圈的菌株,其中8 株菌为革兰氏阳性,过氧化氢酶呈阴性,对该8 株菌进行分子生物学鉴定。
2.2 乳酸菌的鉴定
通过16S rDNA 序测定,利用BLAST 进行序列比对,利用MEGA7 软件构建系统进化树,结果显示8 个菌株均为Lactobacillus,与发酵乳杆菌(Lactobacillus fermentum)相似度最高,其中菌株N5 的系统进化树见图1。
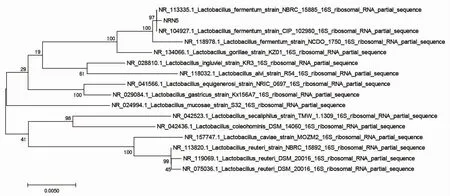
图1 菌株N5 系统进化树Fig.1 Phylogenetic tree of strain N5
2.3 乳酸菌抑菌能力
由表1 可知,菌株N5 对金黄色葡萄球菌的抑制效果最好,菌株N4 和N7 对枯草单胞菌抑制效果较差。菌株N5、N6 对哈维氏弧菌抑制效果较强,对副溶血弧菌抑制效果较好的是菌株N2 和N5,菌株N2 和N6 对嗜水气单胞菌具有较好的抑制效果,对副溶血弧菌有明显抑制效果的是菌株N2,菌株N5对鳗弧菌的抑制效果最佳。

表1 乳酸菌对指示菌的抑菌效果Tab.1 Bacteriostatic effect of isolated Lactobacillus spp.
2.4 乳酸菌药物敏感性
结果表明:菌株N2、N6、N8 对卡纳霉素高度敏感;菌株N1、N4、N7、N9 对卡纳霉素中度敏感,而菌株N5 为耐药;菌株N6 对氨苄青霉素和罗红霉素表现为耐药(表2)。
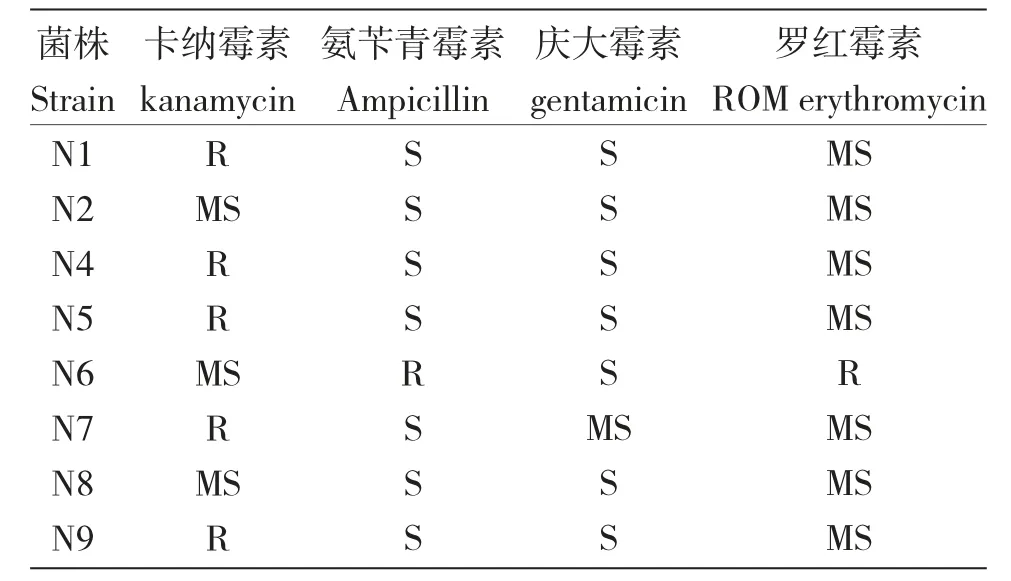
表2 分离菌株药物敏感性检测结果Tab.2 Drug sensitivity test results of isolated strains
2.5 乳酸菌生物被膜形成能力测定
结果表明:N1 的生物被膜形成能力更强,菌株N2、N6、N8 和N9 亦能较好地形成被膜,菌株N5 形成生物被膜的能力较弱(图2)。
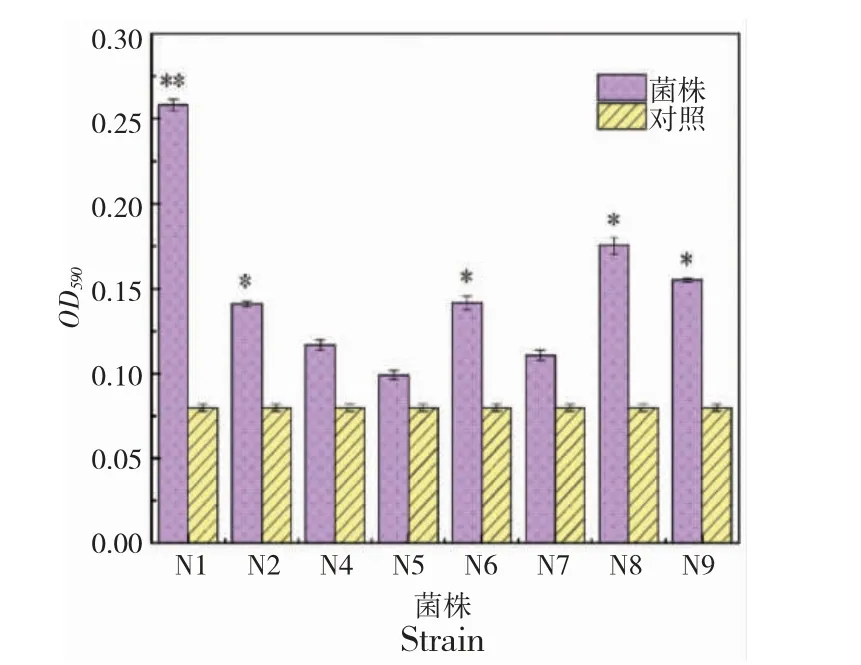
图2 菌株生物被膜形成能力Fig.2 Determination of biofilm formation ability of bacterial strains
2.6 过氧化氢酶对菌株N5 抑菌能力的影响
经过过氧化氢酶处理的发酵上清液与未经过处理的上清液相比抑菌能力没有显著性差异,推测起抑菌作用的物质不是过氧化氢(表3)。

表3 菌株N5 发酵上清液排除过氧化氢试验[11]Tab.3 Elimination of hydrogen peroxide in supernatant of strain N5 fermentation
2.7 菌株N5 抑菌物质的检测
由表4 可知,菌株N5 发酵上清液对鳗弧菌有较强的抑制效果,用乳酸、乙酸和盐酸调节pH 后,均不能抑制鳗弧菌的生长。推测菌株N5 的抑制鳗弧菌作用物质不是有机酸。

表4 菌株N5 发酵上清液排酸试验[12]Tab.4 Acid removal test of fermentation supernatant of strain N5
2.8 温度对菌株N5 抑菌物质的影响
结果发现,加热处理不影响菌株N5 发酵上清抑制鳗弧菌的作用,表明该抑菌物质耐热。105℃高温处理后,抑菌作用略有提高(图3)。
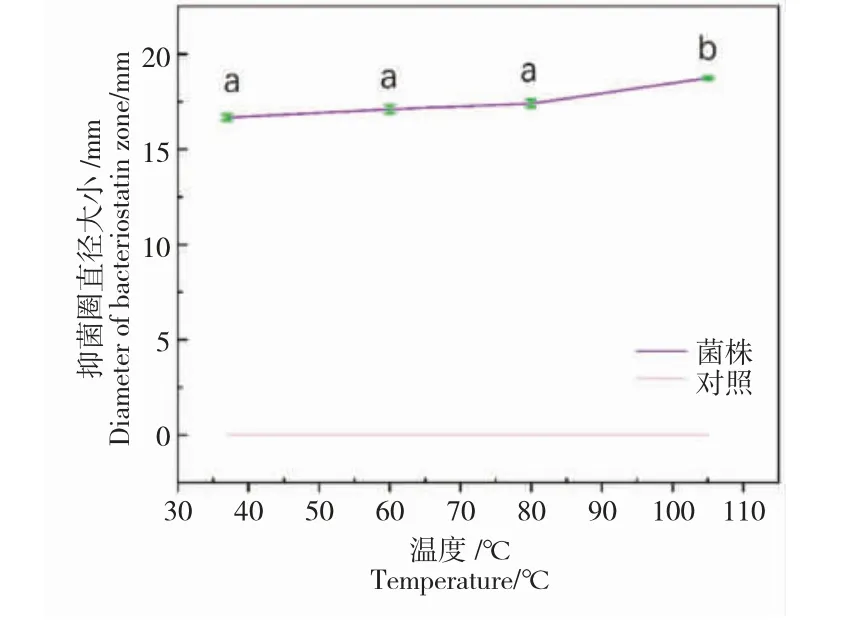
图3 温度对菌株N5 抑菌物质的影响,“ab”表示加热处理后结果的显著性分析(P<0.05)Fig.3 Effect of temperature on the antibacterial secretory substance of strain N5,“ab”represents the significant difference between different warming treatments(P <0.05)
2.9 蛋白酶敏感试验
菌株N5 发酵上清经多种蛋白酶处理后,对鳗弧菌的抑菌能力均有所下降(图4),处理4 h 后,丧失抑菌能力。因此,推测发酵上清液中的抑菌物质为蛋白质。

图4 不同酶处理对菌株N5 抑菌能力的影响,“abcd”表示不同酶处理后结果的显著性分析(P <0.05)Fig.4 Effects of different enzyme treatments on the antibacterial ability of strain N5,“abcd”shows the significant difference between different enzyme treatments(P <0.05)
2.10 菌株N5 对致病菌感染试验
凡纳对虾养殖5 d 定植菌株N5,加入鳗弧菌和哈维氏弧菌,继续养殖7 d,统计对虾存活的情况(图5)。
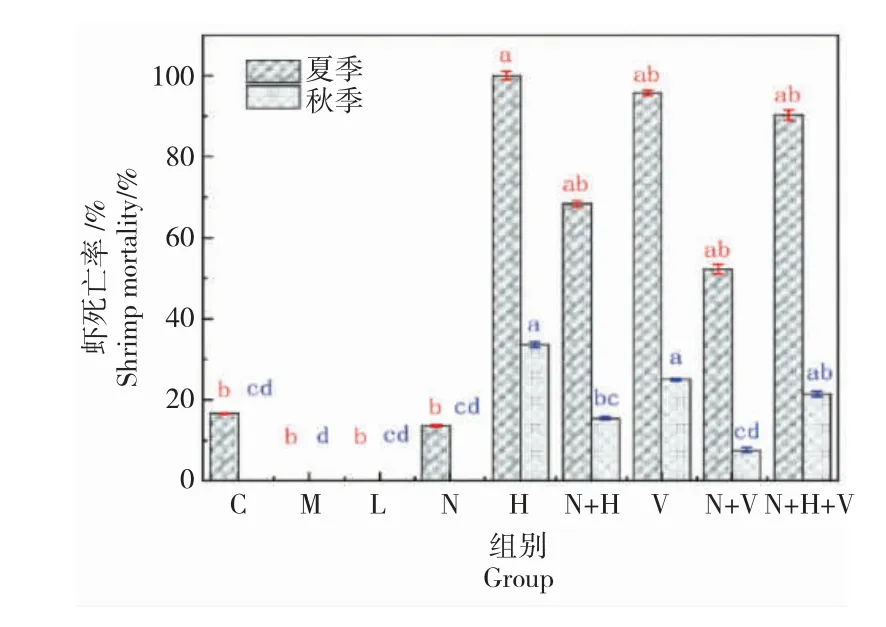
图5 菌株N5 在秋、夏两季对凡纳对虾抗感染的影响,abcd表示为试验组与对照组的显著性分析(P<0.05),红色为夏季之间比较,兰色为秋季之间比较Fig.5 Effect of strain N5 on anti-infection of Pacific white leg shrimp L.vannamei in autumn and summer.abcd were expressed as significant difference between the experimental group and the control group(P <0.05).Red is the comparison between summer and blue is the comparison between autumn
在秋季和夏季,定植了菌株N5 的虾的死亡率显著降低。抗鳗弧菌感染的作用强于抗哈维氏菌的作用。秋季的效果好于夏季。夏季虾的死亡率高于秋季,气温高导致致病菌的致病能力和虾的死亡率大幅提高。
2.11 菌株N5 对病原菌形成生物膜的影响
菌株N5 对鳗弧菌和哈维氏弧菌形成生物膜的影响见图6。菌株N5 与致病菌共培养后,对鳗弧菌和哈维氏弧菌生物膜的形成具有较强的抑制能力。

图6 菌株N5 对鳗弧菌和哈维氏菌形成生物膜的影响,abcd 表示为试验组之间的显著性分析(P<0.05)Fig.6 The effect of strain N5 on biofilm formation of V.anguillarum and V.harvey.abcd were expressed as significant difference between groups(P <0.05)
3 讨论
本实验从健康的大菱鲆肠道中分离益生菌,通过平板划线法分离得到8 株乳酸菌,对研究了病原菌的抑制和耐抗生素等,其中菌株N5 的特性较为突出,对其抑菌作用的物质以及对凡纳对虾的抗病作用进行了试验。
菌株N5 在生长5 h 后进入生长对数期。这与高擎燏等[33]的研究结果相似。分离菌株多数具有较好生物被膜形成能力。史国萃等[34]报道,非致病性细菌生物被膜的形成具有保护作用,可维持和适应自身生存环境,增强对各种不利因素的抵抗力。
乳酸菌抑制病原菌可以提高水产动物的免疫力。然而,乳酸菌之间亦存在较大差异。郭凤茹等[35]分析了20 株乳酸菌对5 种致病菌(大肠杆菌、副溶血性弧菌、金黄色葡萄球菌、沙门氏菌、嗜水气单胞菌)的抑菌效果。结果表明:菌株之间的抑菌能力有一定差异,其中的13 株乳酸菌对5 种指示菌有不同程度的抑菌作用。本文从大菱鲆肠道内分离的8株乳酸菌的抑菌能力也存在差异,其中,菌株N5 对鳗弧菌的抑制能力最强;添加两种病原菌时,菌株N5 仍表现出一定的抗病能力。
近年来,以乳酸菌为主的微生态制剂被用于改善水生动物健康状况和预防疾病。具有广谱拮抗作用乳酸菌是重要筛选标准之一。Kong 等[36]从乌鳢(Channa argus)肠道中分离出178 株菌株,其中5株均对多种水生病原菌具有较高的抑制作用。抗生素耐药性已经成为一个全球化问题[37]。郭凤茹等[38]研究表明:不同属乳酸菌对抗生素的耐药性具有明显的种间差异,而相同属的乳酸菌有其遗传耐药性,也存在不同程度的种内差异。菌株N5 对卡纳霉素表现为耐药,对罗红霉素为中度敏感,反映了大菱鲆肠道乳酸菌的耐药情况。
随着养殖密度的不断提高,养殖环境劣化,细菌性疾病日益增多,给水产养殖业造成严重的经济损失[39]。研究发现,65%~80%的细菌感染是由细菌生物膜所介导[40]。王亮亮[41]从牛奶中筛选抑制金黄色葡萄球菌生物膜形成的乳酸菌,预防疾病的作用强。Sha 等[42]报导饲喂含有益生菌饲料的虾存活率显著提高。乳酸菌定植可以提高水产动物的抗病能力[43]。本试验表明,菌株N 5 可以显著抑制病原菌生物膜的形成。在秋季和夏季的试验中,菌株N5 都能增加海州湾养殖的凡纳滨对虾的抗病能力,表明该菌株在水产养殖具有一定的应用潜力。抗菌物质是一种耐热的蛋白质(乳酸菌素),有利于在加工饲料中添加;进一步对其结构与功能的研究也具有一定的科学意义。
结论
本研究从健康大菱鲆肠道分离得到了8 株乳酸杆菌,对鳗弧菌、哈维氏弧菌、副溶血弧菌、嗜水气单胞菌、金黄色葡萄球菌、枯草芽孢杆菌和大肠杆菌等具有一定的抑菌作用;对罗红霉素、庆大霉素、氨苄青霉素、卡纳霉素等抗生素表现出不同程度的敏感和抗药性,其中,菌株N5 的抑菌作用显著、对抗生素敏感。推测菌株N5 的抑菌物质是一种耐热的乳酸菌素。菌株N5 在抑制鳗弧菌和哈维氏弧菌生物膜形成有较强的抑制能力。通过定植菌株N5,可以提高凡纳滨对虾对鳗弧菌和哈维氏菌的抗感染能力,显著降低虾的死亡率。该菌株具有在水产养殖中应用的潜力,进一步研究耐热的乳酸菌素的分子结构也具有一定的科学意义。
