注射用牛肺表面活性剂双途径给药对重症新生儿胎粪吸入综合征的治疗价值
2023-07-12吴靖张红阳周曼丽
吴靖,张红阳,周曼丽
(南阳市第一人民医院 新生儿重症监护科,河南 南阳 473000)
新生儿胎粪吸入综合征(meconium aspiration syndrome,MAS)是指胎儿在宫内或娩出过程中吸入被胎粪污染的羊水而引发的气道阻塞、肺部炎症等一系列症状,主要表现为气道机械性阻塞、化学炎症、继发性肺表面活性物质失活,严重可引发肺萎陷、通气不足,甚至新生儿持续性肺动脉高压等,危及患儿生命[1-2]。临床常采用机械通气治疗MAS,虽能在一定程度上改善呼吸困难症状,但单独使用该治疗方案容易对机体肺部组织造成损伤,无法从根本上恢复患儿呼吸功能[3]。注射用牛肺表面活性剂是从新生小牛肺中分离提取出来的肺表面活性物质,包含磷脂、胆固醇、甘油三酯、活性物质蛋白等成分,其给药途径包含气管肺泡灌洗和气管内滴入2种途径,能有效降低肺泡气液界面表面张力,促使肺泡稳定,常用于治疗新生儿呼吸窘迫综合征、MAS等疾病[4-5]。本研究选取178例重症MAS患儿作为研究对象,探讨注射用牛肺表面活性剂双途径给药对重症新生儿MAS的治疗价值。
1 对象与方法
1.1 研究对象本研究选取2019年1月至2022年12月南阳市第一人民医院收治的178例重症MAS患儿,按照随机数字表法分为对照组(n=89)和试验组(n=89)。对照组:男52例,女37例;胎龄37~41(39.25±0.62)周;出生体重2.3~3.9(3.08±0.21)kg;日龄1~12(6.58±1.63)h;分娩方式经阴道分娩46例,剖宫产43例。试验组:男48例,女41例;胎龄37~41(39.18±0.65)周;出生体重2.3~3.9(3.11±0.24)kg;日龄1~12(6.54±1.61)h;分娩方式经阴道分娩49例,剖宫产40例。两组患儿上述资料(性别、胎龄、日龄、出生体重、分娩方式)均衡可比(P>0.05)。
1.2 选取标准(1)纳入:①经X线、肺部听诊等检查确诊为MAS;②羊水检查可见胎粪污染情况;③胎儿分娩后出现不同程度的呼吸困难、呼吸急促等症状;④接受机械通气治疗;⑤无先天性心脏病。(2)排除:①伴有免疫功能障碍;②合并先天性膈疝;③存在重要器官先天性发育异常;④伴有严重的遗传性疾病;⑤合并颅内出血或肺出血。
1.3 研究方法
1.3.1常规治疗 给予两组患儿常规呼吸道清理、纠正机体酸中毒及内环境平衡、抗生素预防感染、维持水电解质平衡等治疗,同时进行机械通气治疗。选择英国SLE5000型呼吸机,选择同步间歇指令通气模式,设置呼吸频率为20~45次·min-1,吸气时间为0.4~0.7 s,氧流量为5~8 L·min-1,吸气峰压值为20~25 cmH2O(1 cmH2O=98.06 Pa),呼气末正压为2~5 cmH2O,根据患儿具体病情调整呼吸频率、氧流量、吸气时间、吸气峰压和呼气末正压,待患儿可正常呼吸时撤机。
1.3.2对照组 在常规治疗基础上接受注射用牛肺表面活性剂(华润双鹤药业股份有限公司,国药准字H20052128)气管内滴入治疗,剂量为100 mg·kg-1。用药前将药瓶放在掌心中温化至37 ℃,并在瓶中加入灭菌注射用水,摇晃均匀,确定好气管插管部位后,使用无菌针筒抽取药液,刺入消过毒的导管中,给药时间控制在10~15 min,给药期间注意维持复苏囊供氧状态,给药后持续性机械通气,注意6 h内不对患儿进行拍背、吸痰,依据患儿病情每隔6~8 h重复给药,总给药次数≤4次。
1.3.3试验组 在常规治疗基础上接受注射用牛肺表面活性剂双途径给药(气管肺泡灌洗+气管内滴入)治疗,气管内滴入治疗同对照组。气管肺泡灌洗:于气管内滴入治疗前,将9 g·L-1氯化钠溶液注入注射用牛肺表面活性剂中,将药液稀释为10 g·L-1,之后进行气管肺泡灌洗,直至灌洗吸出物变清。
1.4 观察指标(1)疗效。显效,治疗后患儿临床症状全部消失;缓解,治疗后患儿临床症状明显减少;无效,治疗后未达显效和缓解。将显效、缓解计入总有效率。(2)机械通气时间、氧疗时间、住院时间。(3)炎症因子水平:对比两组治疗前、治疗48 h后白细胞介素-8(interleukin-8,IL-8)、白细胞介素-10(interleukin-10,IL-10)水平。(4)血气指标:对比两组治疗前、治疗48 h后动脉血氧分压(arterial partial pressure of oxygen,PaO2)、动脉血二氧化碳分压(partial pressure of carbon dioxide in arterial blood,PaCO2)、经皮血氧饱和度(transcutaneous oxygen saturation,SpO2)水平。(5)血管内皮功能指标:对比两组治疗前、治疗48 h后内皮素-1(endothelin-1,ET-1)、一氧化氮(nitric oxide,NO)水平。(6)并发症发生率。
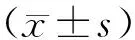
2 结果
2.1 疗效试验组总有效率较对照组高(P<0.05)。见表1。

表1 两组疗效比较
2.2 机械通气时间、氧疗时间、住院时间与对照组比较,试验组机械通气时间、氧疗时间、住院时间短(P<0.05)。见表2。

表2 两组机械通气时间、氧疗时间、住院时间比较
2.3 炎症因子水平治疗48 h后与对照组比较,试验组IL-8水平低,IL-10水平高(P<0.05)。见表3。

表3 两组炎症因子水平比较
2.4 血气指标治疗48 h后与对照组比较,试验组PaO2、SpO2水平高,PaCO2水平低(P<0.05)。见表4。
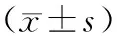
表4 两组血气指标比较
2.5 血管内皮功能指标治疗48 h后与对照组比较,试验组ET-1水平低,NO水平高(P<0.05)。见表5。
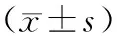
表5 两组血管内皮功能指标比较
2.6 并发症发生率试验组并发症发生率较对照组低(P<0.05)。见表6。

表6 两组并发症发生率比较(n,%)
3 讨论
MAS是临床常见疾病,多发生于新生儿中,形成该疾病的原因较多,宫内窘迫、胎粪的排出和吸入、不均匀气道通气、低血氧症等均会增加MAS发生风险[6-7]。MAS患儿会出现呼吸道梗阻症状,且症状严重程度与吸入粪便污染的羊水量及性质有关,吸入少量或混合均匀的羊水者症状轻微,吸入大量或黏稠胎粪者会出现呼吸窘迫、呼吸急促、吸气性三凹征等症状[8-9]。如未及时治疗,还会导致意识障碍、惊厥等缺血缺氧性脑病及颅内出血等并发症,对患儿生命安全造成不良影响。肺表面活性物质减少是导致MAS发生和发展的重要原因,所以,及时为机体补充肺表面活性物质是改善患儿临床症状的关键[10-11]。
注射用牛肺表面活性剂具有减轻肺泡表面张力的作用,可有效抑制因肺表面活性物质减少导致的肺泡萎缩,提升气道的清除能力,改善机体氧合功能[12-13]。本研究采用注射用牛肺表面活性剂双途径给药治疗重症新生儿MAS,结果显示,试验组总有效率较对照组高;与对照组比较,试验组机械通气时间、氧疗时间、住院时间短,可见该治疗方案能缩短机械通气、氧疗及住院时间。注射用牛肺表面活性剂通过肺泡灌洗和气管内滴入2种给药途径,并借助负压吸引技术有效清除气道内的阻塞物,确保气道通畅,与机械通气联合使用能建立人工气道,保证药物均匀分布在肺部表面,提升药物治疗效果,加快患儿康复,缩短机械通气、氧疗及住院时间[14-15]。IL-8是一种趋化因子,参与和调节机体的生理和病理过程,该指标水平偏高说明患儿体内存在炎症反应。IL-10是一种参与炎症反应和免疫抑制的细胞因子,能调节细胞的生长和分化,加强免疫诱导,抑制巨噬细胞释放大量炎症因子,该值持续降低说明炎症反应加重。经进一步研究发现,治疗48 h后与对照组比较,试验组IL-8水平低,IL-10水平高,提示该治疗方案能缓解机体炎症。MAS可在发生后48 h内引起支气管和肺泡上皮炎症反应,增加炎性分泌物,导致机体通气功能障碍。注射用牛肺表面活性剂可通过气管肺泡灌洗途径吸出肺部深层组织中的胎粪和炎性分泌物,从而改善机体炎症反应,减轻通气功能障碍[16-17]。
PaO2是血液中氧分子所产生的压力,该水平降低会造成通气不良,诱发呼吸困难症状。PaCO2是指物理溶解的二氧化碳产生的张力,可反映肺泡通气状况,该指标水平升高说明二氧化碳在肺间积聚,容易对肺部正常通气功能造成不良影响。SpO2能反映人体血液中的氧气含量,该值偏低提示机体存在缺氧情况,常见原因为肺通气功能不全或肺弥散功能障碍。本研究结果还显示,治疗48 h后与对照组比较,试验组PaO2、SpO2水平高,PaCO2水平低,充分佐证该治疗方案能改善患儿血气指标。注射用牛肺表面活性剂双途径给药能快速清除气道粪便,降低胎粪黏稠度,改善机体血液循环和肺部通气状况,提升肺顺应性,有利于改善患儿血气指标。ET-1是一种由血管平滑肌细胞、内皮细胞等产生的多肽,具有较强的血管收缩功能,该指标水平升高会诱导血管内皮的炎症反应。NO由血管内皮细胞合成,具有保持血管内皮细胞完整性的作用,该值偏低说明血管内皮功能下降。本研究数据显示,治疗48 h后与对照组比较,试验组ET-1水平低,NO水平高,提示该治疗方案能改善患儿血管内皮功能。注射用牛肺表面活性剂双途径给药能缓解患儿体内的炎症反应,减轻气道阻塞症状,有效调节通气和血流比例,改善血管内皮损伤和肺功能损伤。研究结果还显示,试验组并发症发生率较对照组低,充分说明该治疗方案能降低并发症发生率,治疗安全性较高。
综上所述,注射用牛肺表面活性剂双途径给药治疗重症新生儿MAS效果显著,能缩短机械通气、氧疗及住院时间,减轻机体炎症,改善患儿血气指标,抑制血管内皮功能受损,且治疗安全性较高。
