全真一气汤通过HIF-1α/VEGF通路抑制COPD大鼠气道重塑的研究*
2023-07-12张旺生王世聪陈永忠林秀明杨裕华
张旺生,王世聪,陈 慧,陈永忠,林秀明,陈 成,杨裕华,李 希
(福建中医药大学附属第二人民医院,福建 福州 350001)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)已经成为全球三大死亡原因之一,全球30岁以上的人群COPD的患病率约为11.7%[1]。而且中国20岁及以上成人慢阻肺患病率为8.6%,40岁以上人群患病率高达13.7%,估算我国患者近1亿[2]。慢性缺氧是COPD发生、发展的重要病理因素,可造成气道、肺实质及肺血管等组织结构发生重塑。若未能进行及时早期筛查、诊断和治疗,后期常出现慢性肺源性心脏病,严重者出现呼吸衰竭及右心功能衰竭等并发症危及生命。
研究[3]发现,低氧诱导因子-1α(hypoxiainducible factor-1α,HIF-1α)不仅在COPD炎症过程中起着重要作用,还可通过调控相应靶基因参与气道重塑。本课题组在前期的研究发现,全真一气汤对肾不纳气证COPD大鼠具有抑制气道重塑作用,但其相关机制尚未明确。本研究运用全真一气汤干预COPD大鼠,通过观察气道和肺组织病理变化情况及检测肺组织HIF-1α、血管内皮生长因子(vascular endothelial growth factor,VEGF)、闭合蛋白(occloudin)、闭锁小带蛋白-1(zonula occludens-1,ZO-1)蛋白的表达水平,探讨全真一气汤抑制COPD大鼠气道重塑的机制,进一步明确其治疗COPD的作用靶点和机制,从而为临床治疗提供理论依据。
1 材料与方法
1.1 实验动物 健康SPF级雄性SD大鼠39只,体质量180~200 g,购自福州诺敦斯生物科技有限公司,动物生产许可证号:SCXK(浙)2019-0002。大鼠饲养于福建省中医科学院医学研究中心,于温度(22±2)℃、湿度(55±5)%恒定条件下标准饲料喂养,人工光源明暗照射12 h,24 h自由饮水和食物。动物实验全程遵守福建中医药大学关于动物实验伦理学的相关规定,批准文号:FJATCM-IAEC20210421。
1.2 药物与试剂 全真一气汤,方药组成:熟地黄15 g,白术6 g,人参15 g,麦冬15 g,五味子6 g,附子6 g,牛膝15 g。中药饮片购自福建省药材公司,由福建中医药大学附属第二人民医院倪立坚副主任药师鉴定为正品,由福建中医药大学附属第二人民医院制备成生药质量浓度为1.0 g/mL、体积为226 mL的汤药。氨茶碱(批号:2101071,规格:0.25 g/2 mL)购自宁波美诺华天康药业;电镜固定液(批号:GR2211123)购自中国Servicebio公司;812包埋剂(批号:90529-77-4)购自美国SPI公司;4%多聚甲醛(批号:1406M20512)、HIF-1α(批号:8619071002)、VEGF(批号:S50322080902)、HRP-山羊抗兔(批号:GR2212109)、β-actin(批号:20210913)、SDS-PAGE凝胶制备试剂盒(批号:GR2202155)、显影定影试剂(批号:GR2204014)均购自中国Servicebio公司;脂多糖(LPS)(批号:GR2207044)购自美国Sigma公司;石狮牌香烟(批号:6901028137416,每支香烟焦油含量:12 mg、Nicotine含量:1.1 mg、CO含量:13 mg)购自福建中烟公司。
1.3 主要仪器 Eclipse Ci-L型正置白光拍照显微镜(日本Nikon公司);Leica UC7型超薄切片机(德国Leica公司);Ultra 45°型钻石切片刀(Daitome);HT7700型透射电子显微镜(日本hitachi公司);烟熏箱由福建中医药科学院动物房自制。
1.4 造模与分组 39只SD大鼠适应性喂养1周后,采用随机数字表法分为空白组(n=9)、模型组(n=10)、氨茶碱组(n=10)和全真一气汤组(n=10)。采用烟熏联合脂多糖(LPS)气管滴注的方法进行COPD模型的制备,除空白组外,模型组、氨茶碱组和全真一气汤组大鼠在造模的第1、14天采用10%水合氯醛麻醉大鼠,进行无创气管插管(专利号:ZL202020203846.6)滴注1 μg/μL的LPS 200 μL,滴注后休息1周,开始烟熏大鼠,烟熏频率为1次/d,一次15支香烟,持续烟熏28 d。各组取3只进行模型评估,其中模型组、氨茶碱组及全真一气汤组大鼠若表现为咳嗽、喘息、体质量减轻、面容疲惫、皮毛光泽度差等,肺组织病理可见气道分泌物增多、气道慢性炎症及肺泡腔扩张明显并且破裂、肺泡间隔明显减少、单位肺泡数量减少等情况,表明COPD大鼠模型复制成功。
1.5 实验给药 参照《人和动物间按体表面积折算的等效剂量比值表》[4]将成人临床用药等效剂量换算为大鼠给药剂量,全真一气汤含生药量226 g,参照70 kg成人和200 g大鼠体表面积比值为0.018换算,全真一气汤组灌胃给予成人等效剂量的全真一气汤药液,给药剂量为40.860 0 g/(kg·d)(相当于临床成人用量的3.230 0 g/(kg·d),氨茶碱组按成人临床等效剂量的给予相应的混悬液灌胃,给药剂量为0.040 5 g/(kg·d)。空白组和模型组大鼠给予等体积生理盐水灌胃,1次/d,连续给药28 d。
1.6 观察指标
1.6.1 肺部组织标本采集 取材前大鼠禁食不禁水12 h,采用水合氯醛(0.4 mL/100 g)腹腔麻醉,待大鼠麻醉后用组织剪刀剪开胸腹部至胸骨,剪开胸骨暴露出肺组织,剪下左肺上叶放入4%多聚甲醛中,以备HE染色和免疫组化检测使用。再剪下左肺下叶黄豆大小组织放入电镜固定液4 ℃固定3 h,于透射电子显微镜下观察。其余肺叶于-80 ℃冰箱中冻存,备用。
1.6.2 组织病理学检测
1.6.2.1 HE染色 从4%多聚甲醛中取出肺叶组织,修剪组织、不同浓度酒精进行梯度脱水、包埋、切片、脱蜡、染色、封片,镜下观察肺组织并拍照。成像完成后使用Image-Pro Plus 6.0分析软件,分别计数每张图片中肺泡的数量和视野面积。单位长度内的肺泡数量=肺泡的数量/视野面积。
1.6.2.2 电镜透射 从电镜固定液取出肺叶组织,修剪组织、漂洗、固定,不同浓度酒精及丙酮进行梯度脱水、渗透、包埋、切片、染色,最后在透射电子显微镜下观察,采集图像分析。
1.6.3 免疫组化检测HIF-1α、occludin、VEGF、ZO-1蛋白表达情况 肺组织经对多聚甲醛固定后同HE染色步骤进行脱水、石蜡包埋、切片,脱蜡后的切片加入枸橼酸修复液进行抗原修复,加入血清封闭,按照试剂盒中操作步骤,加入HIF-1α、occludin、VEGF、ZO-1一抗(稀释比例1∶1 800)、二抗,室温下显色剂染色5 min,切片后镜下观察,通过Image pro-plus6.0图像分析系统计算平均光密度值。平均光密度值=累积光密度IOD值/阳性像素面积[5]。
1.6.4 Western blotting检测HIF-1α、VEGF蛋白表达情况 取出冻存的肺脏组织,加入组织裂解液,进行组织匀浆,4 ℃条件下12 000 r/min(离心半径为8.5 cm)离心20 min,吸取上层上清液,进行BCA蛋白浓度测定。测定完成后,5×Loading Buffer和PBS对蛋白样品进行稀释,沸水浴5 min。制备分离胶和浓缩胶,进行蛋白上样、电泳、转模分离目标蛋白,脱脂奶粉封闭摇床1 h,并依次加入HIF-1α和VEGF一抗(稀释比例1∶500),于4 ℃孵育过夜;加入二抗,室温孵育1 h,成像仪进行显影,采用Image pro-plus 6.0测定目的蛋白HIF-1α、VEGF相对表达量及内参条带灰度值。
1.7 统计学方法 采用SPSS 23.0软件进行统计学分析,计量资料以“均数±标准差”表示。采用Levene检验进行方差齐性检验。当数据符合方差齐性和正态分布时,采用单因素方差分析进行多重比较,采用最小显著性差异检验评价两组间的差异。方差不齐采用非参数检验。绘图软件主要采用GraphPad PriSm8.0。
2 结果
2.1 大鼠一般情况 实验结束时,空白组大鼠动作灵敏,体质量增长较快,对外界反应灵敏,无死亡情况。模型组大鼠咳、喘息、体质量减轻、面容疲惫、皮毛光泽度差,死亡1只。全真一气汤组大鼠体质量较空白组稍有减轻,均略重于模型组,对外界反应的灵敏度稍有降低,皮毛光泽度略低,死亡1只。氨茶碱组大鼠体质量稍有减轻,对外界反应的灵敏度稍有降低,皮毛光泽度稍差,无死亡情况。
2.2 各组大鼠肺组织病理学改变情况 空白组大鼠肺泡结构完整,肺泡间隔无明显增厚;模型组大鼠可见肺泡腔扩张明显并且破裂、肺泡间隔明显增厚,单位面积内的肺泡数量明显减少;氨茶碱组可见肺泡腔轻度扩张并且部分破裂、肺泡间隔轻度增厚,单位面积内的肺泡数量稍有减少;全真一气汤组大鼠可见肺泡腔轻度扩张、肺泡间隔轻度增厚,单位面积内的肺泡数量稍有减少。与空白组比较,模型组大鼠可见肺泡腔扩张明显并且破裂,肺泡间隔明显增厚,单位面积内的肺泡数量明显减少(P<0.01);与模型组比较,氨茶碱组和全真一气汤组大鼠可见肺泡扩张有所减少,单位面积内的肺泡数量明显增加(P<0.01),提示全真一气汤可改善COPD引起的肺泡腔扩张、破裂和肺泡间隔增厚,并且可增加单位面积内的肺泡数量。其中,以全真一气汤组最为明显,氨茶碱组次之。(见图1、表1)
表1 各组大鼠单位面积内的肺泡数量比较 (±s)

表1 各组大鼠单位面积内的肺泡数量比较 (±s)
注:与空白组比较,aP<0.01;与模型组比较,bP<0.01。
组别n 给药剂量/(g/kg) 单位面积内的肺泡数量/(个/mm2)空白组6-134.71±31.49模型组6-94.69±24.80a氨茶碱组60.040 5112.84±26.65b全真一气汤组 640.860 0115.11±26.39b F 5.339 P 0.014
2.3 各组大鼠透射电镜结果 透射电镜结果显示,空白组大鼠线粒体未见明显肿胀,大多结构尚可,基质较为均匀,嵴存在;模型组大鼠线粒体损伤严重,整体呈中、重度肿胀,膜破损,基质较多溶解,嵴消失;全真一气汤组大鼠线粒体未见明显肿胀,大多结构尚可,基质较为均匀,嵴存在;氨茶碱组线粒体损伤严重,整体呈中、重度肿胀,膜破损,基质较多溶解,嵴消失。4组肺泡Ⅱ型上皮细胞存在一定程度差异性,模型组、氨茶碱组大鼠线粒体损伤最为严重,整体呈中、重度肿胀,膜破损,基质较多溶解,嵴消失;空白组、全真一气汤组大鼠线粒体未见明显肿胀,大多结构尚可,基质较为均匀,嵴存在。4组大鼠细胞表面的微绒毛未见明显差异,数量较少,排列稀疏。(见图2)
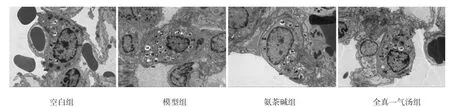
图2 各组大鼠肺组织电镜结果 (×5 000)
2.4 各组大鼠肺组织HIF-1α、occludin、VEGF、ZO-1平均光密度值比较 与空白组比较,模型组大鼠肺组织HIF-1α、VEGF平均光密度值明显升高(P<0.01),occludin、ZO-1平均光密度值明显降低(P<0.05);与模型组比较,氨茶碱组大鼠肺组织HIF-1α平均光密度值均明显降低(P<0.05),occludin、ZO-1平均光密度值均明显升高(P<0.05);与模型组比较,全真一气汤组大鼠肺组织HIF-1α、VEGF平均光密度值明显降低(P<0.05或P<0.01),occludin、ZO-1平均光密度值明显升高(P<0.05或P<0.01)。(见图3、表2)
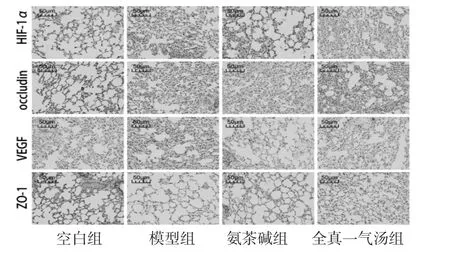
图3 各组大鼠肺组织HIF-1α、occludin、VEGF、ZO-1免疫组化图 (×200)
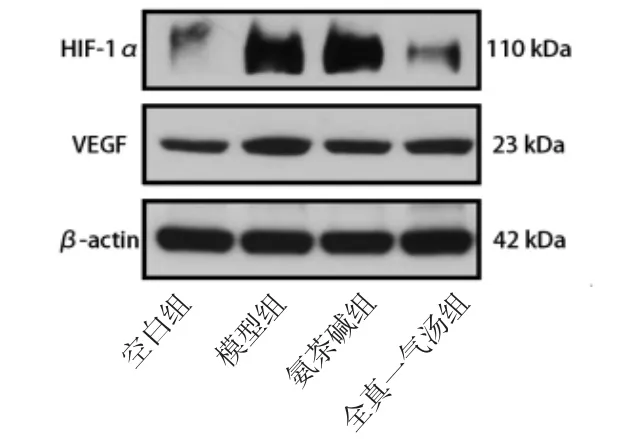
图4 各组大鼠肺组织HIF-1α、VEGF 蛋白表达Western blotting 图
表2 各组大鼠肺组织HIF-1α、VEGF、occludin、ZO-1 平均光密度值比较 (±s)
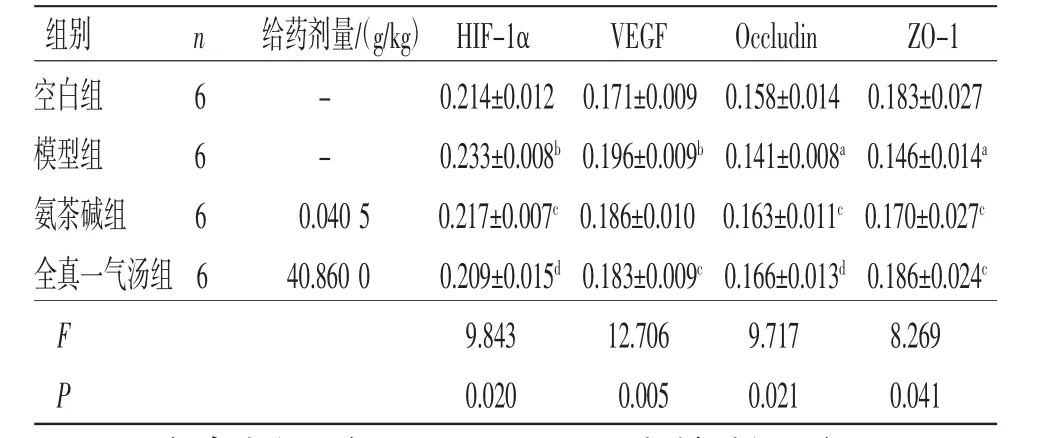
表2 各组大鼠肺组织HIF-1α、VEGF、occludin、ZO-1 平均光密度值比较 (±s)
注:与空白组比较,aP<0.05,bP<0.01;与模型组比较,cP<0.05,dP<0.01。
组别n给药剂量/(g/kg) HIF-1αVEGFOccludinZO-1空白组6-0.214±0.012 0.171±0.009 0.158±0.014 0.183±0.027模型组6-0.233±0.008b 0.196±0.009b 0.141±0.008a 0.146±0.014a氨茶碱组60.040 50.217±0.007c 0.186±0.010 0.163±0.011c 0.170±0.027c全真一气汤组 640.860 00.209±0.015d 0.183±0.009c 0.166±0.013d 0.186±0.024c F 9.84312.7069.7178.269 P 0.0200.0050.0210.041
2.5 各组大鼠肺组织HIF-1α、VEGF蛋白相对表达量比较 与空白组比较,模型组大鼠肺组织HIF-1α、VEGF蛋白相对表达量均明显升高(P<0.01);与模型组比较,氨茶碱组大鼠肺组织VEGF蛋白相对表达量明显降低(P<0.01),HIF-1α蛋白相对表达量与模型组比较,差异无统计学意义(P>0.05);全真一气汤组大鼠肺组织HIF-1α、VEGF蛋白相对表达量均明显降低(P<0.01)。(见图5、表3)
表3 各组大鼠肺组织HIF-1α、VEGF 蛋白相对表达量比较(±s)

表3 各组大鼠肺组织HIF-1α、VEGF 蛋白相对表达量比较(±s)
注:与空白组比较,aP<0.01;与模型组比较,bP<0.01。
组别n给药剂量/(g/kg) HIF-1αVEGF空白组6-0.08±0.010.32±0.03模型组6-1.43±0.14a0.75±0.04a氨茶碱组60.040 51.29±0.050.51±0.05b全真一气汤组 640.860 00.29±0.02b 0.45±0.05b F 264.99052.226 P 0.0000.000
3 讨论
中医古籍中未见COPD相关的病名,但依据其临床证候表现及病因病机,可将其归于“肺胀”“喘证”范畴。依据COPD发病规律,本病总属于本虚标实之证。肾脏与肺脏通过经络系统、精微物质生成敷布两种体系产生密切联系[6]。故本病发展到后期,久病肺虚及肾,金不生水,导致肾气衰惫,肺不主气,肾不纳气,常出现呼多吸少、动则气喘等表现。因此,补肺纳肾、阴阳双调是中医治疗肺胀病本虚证的基本治法。
全真一气汤中熟地黄归肾经,具有补肾益气、益精填髓功效;制附子辛、甘、大热,可达回阳救逆、助阳补火作用;生晒参味甘、微苦、性温,大补元气,补脾益肺;五味子酸、甘而温,敛肺滋肾;白术甘、苦而温,健脾补气;牛膝苦、酸而平,补养肝肾;麦冬甘、微苦、微寒,可养胃润肺,清心除烦。全真一气汤阴阳俱全,补中有泻。诸药共用可达疏经通脉、养阴益气、调补肺肾之效,具有“方从法出,法随证立”之意,是治疗肾不纳气证的经典方剂。
慢性阻塞性肺疾病特征性的病理学改变是气道炎症与重塑,包括气道、肺实质及肺血管的慢性炎症及组织结构重塑,其共同构成COPD气流受限的病理学基础[7-8]。慢性缺氧是COPD发生、发展的重要病理因素,可造成气道、肺实质及肺血管等组织结构发生重塑。既往的研究结果发现,HIF-1α通过调控相应靶基因参与COPD气道重塑[3]。低氧诱导因子1(HIF-1)是由缺氧诱导的转录激活剂,也是氧稳态和生理反应的调节剂[9-10]。HIF-1通过其对血管重塑和血管生成的影响以及通过参与氧化还原稳态和葡萄糖代谢的氧气利用来介导氧气输送[11]。血管内皮生长因子(VEGF)的表达由HIF-1α诱导,是血管生成和血管通透性的有效调节剂。VEGF已被证明参与COPD的发病机制,HIF-1α调节的VEGF过表达可能是慢性支气管炎的特征[12]。VEGF及其受体VEGFR-1(Flt-1)和VEGFR-2(KDR/Flk-1)可能在COPD的组织重塑和血管生成中发挥作用[13]。HIF-1α的表达与VEGF和VEGFR2的表达呈正相关,HIF-1α、VEGF和VEGFR2表达的增加反映了COPD的疾病严重程度,而且HIF-1α、VEGF和VEGFR2的高表达可能与肺功能下降和生活质量下降有关,从而导致COPD的疾病进展[14]。另外,研究发现[15]缺氧可激活肺组织中HIF-1α/VEGF通道,影响维持肺通透性的紧密连接蛋白occludin与ZO-1表达,进而损伤肺泡上皮细胞及肺泡毛细血管。支气管上皮作为对抗多种吸入外源性物质的前线防御。上皮屏障功能由相邻细胞之间形成的顶端连接复合物维持,并由黏附连接下面的顶端紧密连接(TJ)组成[16]。TJ蛋白,如claudin家族、occludin、连接黏附分子(JAM)和闭塞带(ZO)蛋白及AJ蛋白(如E-钙黏蛋白)已被证明可构成支气管上皮的交界复合物,且与健康人相比,COPD患者支气管上皮和肺组织切片中ZO-1、occludin和E-钙黏蛋白的表达较弱[17-20]。但COPD气道重塑是否通过HIF-1α/VEGF通路影响紧密连接蛋白occludin与ZO-1表达有关,需要进一步研究。
本研究的目的是运用形态学和免疫学的方法研究全真一气汤治疗COPD大鼠的作用,结果表明,模型建立成功,全真一气汤在一定程度上改善COPD大鼠气道重塑。HE染色结果显示,与模型组比较,全真一气汤组大鼠可见肺泡扩张有所减少,单位面积内的肺泡数量明显增加;透射电镜结果显示,模型组、氨茶碱组大鼠肺泡Ⅱ型上皮细胞线粒体损伤最为严重,整体呈中重度肿胀,膜破损,基质较多溶解,嵴消失,而全真一气汤组大鼠肺泡Ⅱ型上皮细胞线粒体未见明显肿胀,大多结构尚可,基质较为均匀,嵴存在。免疫组化结果显示,与模型组比较,全真一气汤组大鼠肺组织HIF-1α、VEGF蛋白相对表达量均明显降低,occloudin、ZO-1蛋白相对表达量均明显升高,提示HIF-1α、VEGF、occloudin、ZO-1蛋白可能参与COPD气道重塑。
综上,全真一气汤可通过下调HIF-1α、VEGF蛋白,上调occloudin和ZO-1蛋白的表达,进而改善COPD大鼠肺脏损伤,达到气道重塑具有保护作用,可为全真一气汤治疗COPD气道重塑的作用提供实验基础和理论依据。
