牛蒡子苷元抑制HMGB1/TLR4/NF-κB信号通路减轻单侧输尿管梗阻大鼠肾纤维化
2023-07-12高海洋陈曦张金存关晓海曹凤宏康绍叁王磊么安亮刘健张立国
高海洋, 陈曦, 张金存, 关晓海, 曹凤宏, 康绍叁, 王磊, 么安亮, 刘健, 张立国
(华北理工大学附属医院泌尿外科,河北唐山 063000)
肾纤维化是几乎所有慢性和进行性肾病常见的病理改变[1]。在慢性肾病中,纤维化是一种主动的生物合成愈合反应,其目的是保护组织免受损伤。然而,当纤维化独立于初始刺激时,它会导致严重的器官损伤[2]。大量研究表明,天然产物用于预防和治疗纤维化具有广阔的前景。肾纤维化归属于中医学“水肿”“癃闭”“虚劳”“肾劳”“肾风”“溺毒”“尿浊”等范畴,其病机多由脾肾虚衰,湿浊羁留,浊邪壅塞三焦,气机升降失调,导致水湿、湿热、痰浊、浊毒和瘀血等病理产物集聚所致,补益脾肾、清热利湿、化浊排毒、活血化瘀为主要治法[3]。牛蒡子,味辛、苦,性寒,具有疏散风热、宣肺透疹、解毒利咽的功效[4]。已有研究表明,牛蒡子可用于治疗糖尿病肾脏病[5]。牛蒡子苷元(arctigenin)是从牛蒡中分离出的木脂素衍生化合物,现代药理学研究表明,其具有抗病毒、抗炎、抗肾损伤的作用[6-10]。既往有研究表明,牛蒡子苷元可通过抑制炎症、氧化应激来保护肾脏免受单侧输尿管梗阻(unilateral ureteral obstruction,UUO)诱导的损伤和纤维化[11]。减弱源自高迁移率族蛋白B1(high mobility group protein B1,HMGB1)/Toll 样受体4(Toll-like receptor 4,TLR4)/核因子-κB(nuclear factor-κB,NF-κB)通路传导的纤维化信号可预防UUO 诱导的肾纤维化[12]。但牛蒡子苷元能否通过调控HMGB1/TLR4/NF-κB信号通路减轻UUO大鼠肾纤维化尚未见报道。因此,本研究通过构建UUO 大鼠模型,探讨牛蒡子苷元对UUO 大鼠肾纤维化的治疗作用及机制,旨在为肾纤维化的临床治疗提供新的思路,现将研究结果报道如下。
1 材料与方法
1.1 动物60 只SPF 级雄性SD 大鼠,8~10 周龄,体质量308 ~317 g,购自长春市亿斯实验动物技术有限责任公司,动物生产许可证号为SCXK(吉)2019-0007,于华北理工大学附属医院动物实验室进行实验,动物使用许可证号为SYXK(冀)2021-0014。大鼠饲喂标准饲料,饲养条件为温度(23±2)℃,平均湿度(55±5)%,自由进食和饮水。本研究动物实验方案已经华北理工大学附属医院伦理委员会批准,批准编号:DWLS2021 第107 号。
1.2 主要药物、试剂与仪器牛蒡子苷元(分子量:372.412,分子式:C21H24O6,分子结构纯度≥98%,批号:HEJCX-00001978-025),购自合肥博美生物科技有限责任公司。将牛蒡子苷元溶于生理盐水配制成1.0、2.0 mg/mL(0.002 7、0.005 4 mol/L)的牛蒡子苷元溶液。HMGB1过表达质粒购自武汉华联科生物公司;白细胞介素(IL)-1β、IL-6酶联免疫吸附分析(ELISA)试剂盒,末端脱氧核苷酸转移酶介导的dUTP缺口末端标记(TUNEL)细胞凋亡检测试剂盒,均购自武汉亚科因生物公司;兔源α-平滑肌肌动蛋白(α-SMA)、Ⅰ型胶原蛋白(Collagen Ⅰ)、HMGB1、TLR4、磷酸化NF-κB p65(p-NF-κB p65)、NF-κB p65、β-actin 等一抗、羊抗兔IgG 二抗,均购自美国Abcam 公司。全自动生化分析仪(型号:Senlo8011)、显微镜(型号:NE950)、酶标仪(型号:PT-3502B),均购自成都斯马特科技有限公司;蛋白成像仪(型号:BOT-860SR),购自北京诺汇诚科技有限公司。
1.3 分组、建模与给药将60 只SD 大鼠随机分为假手术组、模型组、牛蒡子苷元低剂量组、牛蒡子苷元高剂量组、HMGB1 过表达质粒+牛蒡子苷元高剂量组(HMGB1+牛蒡子苷元高剂量组),每组12 只。除假手术组外,其余各组大鼠参照文献研究[13]进行UUO 模型的构建。造模方法:采用腹腔注射3%戊巴比妥钠(90 mg/kg)麻醉大鼠,切开大鼠左腹侧表面,分离左侧输尿管并用丝线于上1/3 处双结扎,使左肾处于完全梗阻的状态,最后缝合伤口。假手术组大鼠仅分离左侧输尿管,不进行结扎处理。术后第2天开始给药,给药剂量参照文献研究[14]及前期预实验结果进行确定。牛蒡子苷元低剂量组按照10 mg/kg的剂量灌胃牛蒡子苷元(10 mL/kg,0.002 7 mol/L),同时尾静脉注射等体积生理盐水;牛蒡子苷元高剂量组按照20 mg/kg的剂量灌胃牛蒡子苷元(10 mL/kg,0.005 4 mol/L),同时尾静脉注射等体积生理盐水;HMGB1+牛蒡子苷元高剂量组灌胃20 mg/kg的牛蒡子苷元外,同时尾静脉注射8 μg/kg HMGB1 过表达质粒[15];假手术组、模型组灌胃并尾静脉注射等体积生理盐水。每日1次,持续14 d。
1.4 标本收集末次给药结束后,代谢笼收集大鼠24 h尿液用于24 h尿蛋白定量(UTP)的检测。麻醉后经心脏穿刺取血,离心得血清用于血肌酐(SCr)、血尿素氮(BUN)的检测。心脏穿刺取血后处死大鼠,收集大鼠左侧肾组织,分为两部分,一部分固定于4%多聚甲醛中,另一部分冻存于液氮中。
1.5 观察指标与方法
1.5.1 肾功能指标的检测 应用全自动生化分析仪检测24 h UTP 及SCr、BUN 水平。
1.5.2 肾组织的苏木素-伊红(HE)染色及Masson染色 将固定于4%多聚甲醛的肾组织以石蜡包埋,切成4 μm 厚的切片,通过HE 染色法检测肾组织病理变化,Masson 染色法检测大鼠肾组织纤维化程度,均置于显微镜下观察。
1.5.3 ELISA 法检测肾组织中IL-1 β、IL-6水平 将液氮中冻存的肾组织解冻匀浆,严格按照IL-1β、IL-6 试剂盒说明书检测肾组织匀浆中IL-1β、IL-6水平。
1.5.4 TUNEL 染色法检测肾细胞凋亡 取肾组织石腊切片,应用TUNEL 试剂盒染色检测肾细胞凋亡。TUNEL 染色阳性的细胞呈绿色荧光,细胞核呈蓝色。细胞凋亡率(%)=(绿色荧光细胞数/细胞总数)×100%。
1.5.5 蛋白印迹法检测肾组织中蛋白表达 用放射免疫沉淀分析(RIPA)裂解缓冲液提取肾组织匀浆中的总蛋白,将40 μg 蛋白质样品进行电泳、转膜、封闭,再将膜与按体积比稀释的一抗包括α-SMA(1∶1 700)、Collagen I(1∶1 700)、HMGB1(1∶1 300)、TLR4(1∶1 450)、p-NF-κB p65(1∶1 350)、NF-κB p65(1∶1 350)、β-actin(1∶1 000)于4 ℃孵育过夜,然后与羊抗兔IgG 二抗(1∶2 700)37 ℃温育1 h,加入增强化学发光(ECL)底物染色5 min,曝光显影,最后使用ImageJ 软件对蛋白灰度值进行定量。
1.6 统计方法采用SPSS 25.0软件处理数据,计量资料(均符合正态分布)以均数±标准差(±s)表示,多组间比较采用单因素方差分析,进一步两两比较行SNK-q检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 牛蒡子苷元对UUO模型大鼠肾功能的影响表1 结果显示:与假手术组比较,模型组大鼠24 h UTP、SCr、BUN 水平升高(P<0.05);与模型组比较,牛蒡子苷元低、高剂量组大鼠24 h UTP、SCr、BUN水平降低(P<0.05);与牛蒡子苷元低剂量组比较,牛蒡子苷元高剂量组大鼠24 h UTP、SCr、BUN水平降低(P<0.05);与牛蒡子苷元高剂量组比较,HMGB1+牛蒡子苷元高剂量组大鼠24 h UTP、SCr、BUN水平升高(P<0.05)。
表1 各组大鼠肾功能比较Table 1 Comparison of renal function among each group of rats(±s)
注:①P<0.05,与假手术组比较;②P<0.05,与模型组比较;③P<0.05,与牛蒡子苷元低剂量组比较;④P<0.05,与牛蒡子苷元高剂量组比较
?
2.2 牛蒡子苷元对UUO模型大鼠肾组织病理变化及纤维化的影响HE 染色结果显示:与假手术组比较,模型组可见肾小球基底膜增厚、系膜增生,且有大量炎性细胞浸润;与模型组比较,牛蒡子苷元低、高剂量组大鼠肾组织病理损伤减轻;与牛蒡子苷元高剂量组比较,HMGB1+牛蒡子苷元高剂量组大鼠肾组织病理损伤加剧。见图1。
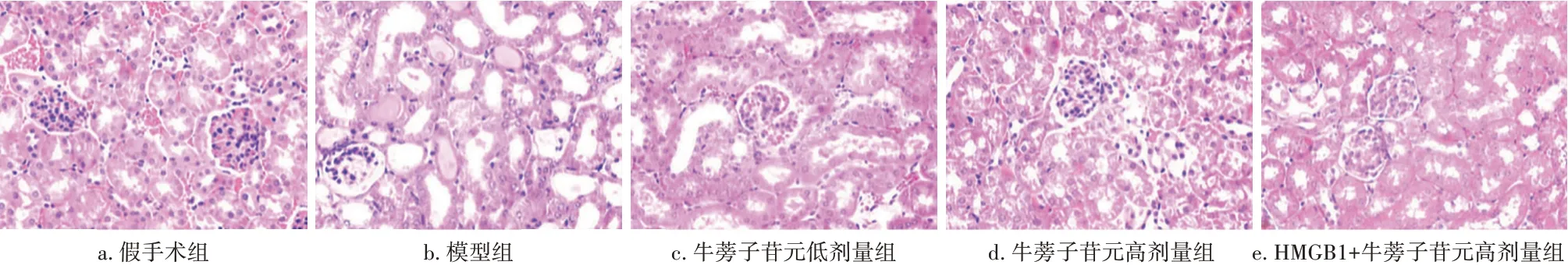
图1 各组大鼠肾组织病理变化比较(HE染色法,×200)Figure 1 Comparison of histopathological changes among each group of rats(HE staining,×200)
Masson 染色结果显示:与假手术组比较,模型组大鼠的肾组织中可见大量蓝染区域,纤维化严重;与模型组比较,牛蒡子苷元低、高剂量组肾组织蓝染区域减少,纤维化减轻;与牛蒡子苷元高剂量组比较,HMGB1+牛蒡子苷元高剂量组肾组织纤维化加剧。见图2。

图2 各组大鼠肾组织纤维化表现比较(Masson染色法,×200)Figure 2 Comparison of fibrosis manifestations of renal tissue among each group of rats(Masson,×200)
2.3 牛蒡子苷元对UUO模型大鼠肾组织中IL-1β、IL-6水平的影响表2 结果显示:与假手术组比较,模型组IL-1β、IL-6 水平升高(P<0.05);与模型组比较,牛蒡子苷元低、高剂量组IL-1β、IL-6 水平降低(P<0.05);与牛蒡子苷元低剂量组比较,牛蒡子苷元高剂量组IL-1β、IL-6水平降低(P<0.05);与牛蒡子苷元高剂量组比较,HMGB1+牛蒡子苷元高剂量组IL-1β、IL-6水平升高(P<0.05)。
表2 各组大鼠肾组织中IL-1β、IL-6水平比较Table 2 Comparison of IL-1β and IL-6 levels in renal tissue among each group of rats(±s,pg·mL-1)

表2 各组大鼠肾组织中IL-1β、IL-6水平比较Table 2 Comparison of IL-1β and IL-6 levels in renal tissue among each group of rats(±s,pg·mL-1)
注:①P<0.05,与假手术组比较;②P<0.05,与模型组比较;③P<0.05,与牛蒡子苷元低剂量组比较;④P<0.05,与牛蒡子苷元高剂量组比较
?
2.4 牛蒡子苷元对UUO模型大鼠肾细胞凋亡的影响图3、表3 结果显示:与假手术组比较,模型组肾细胞凋亡率升高(P<0.05);与模型组比较,牛蒡子苷元低、高剂量组肾细胞凋亡率降低(P<0.05);与牛蒡子苷元低剂量组比较,牛蒡子苷元高剂量组肾细胞凋亡率降低(P<0.05);与牛蒡子苷元高剂量组比较,HMGB1+牛蒡子苷元高剂量组肾细胞凋亡率升高(P<0.05)。

图3 各组大鼠肾细胞凋亡比较(TUNEL染色,×200)Figure 3 Comparison of renal cell apoptosis among each group of rats(TUNEL staining,×200)
表3 各组大鼠肾细胞凋亡率比较Table 3 Comparison of renal cell apoptosis rate among each group of rats(±s,%)

表3 各组大鼠肾细胞凋亡率比较Table 3 Comparison of renal cell apoptosis rate among each group of rats(±s,%)
注:①P<0.05,与假手术组比较;②P<0.05,与模型组比较;③P<0.05,与牛蒡子苷元低剂量组比较;④P<0.05,与牛蒡子苷元高剂量组比较
?
2.5 牛蒡子苷元对UUO模型大鼠肾组织中纤维化相关蛋白α-SMA、CollagenⅠ表达的影响图4、表4 结果显示:与假手术组比较,模型组α-SMA、CollagenⅠ蛋白表达升高(P<0.05);与模型组比较,牛蒡子苷元低、高剂量组α-SMA、CollagenⅠ蛋白表达降低(P<0.05);与牛蒡子苷元低剂量组比较,牛蒡子苷元高剂量组α-SMA、CollagenⅠ蛋白表达降低(P<0.05);与牛蒡子苷元高剂量组比较,HMGB1+牛蒡子苷元高剂量组α-SMA、CollagenⅠ蛋白表达升高(P<0.05)。

图4 各组大鼠肾组织α-SMA、Collagen I蛋白电泳条带图(Western Blot法)Figure 4 Comparison of electrophoretic bands of α-SMA and Collagen I in renal tissue among each group of rats(Western Blot method)
2.6 牛蒡子苷元对UUO模型大鼠肾组织中HMGB1/TLR4/NF-κB通路蛋白表达的影响图5、表5 结果显示:与假手术组比较,模型组HMGB1、TLR4、p-NF-κB p65 蛋白相对表达量升高(P<0.05);与模型组比较,牛蒡子苷元低、高剂量组HMGB1、TLR4、p-NF-κB p65 蛋白相对表达量降低(P<0.05);与牛蒡子苷元低剂量组比较,牛蒡子苷元高剂量组HMGB1、TLR4、p-NF-κB p65 蛋白相对表达量降低(P<0.05);与牛蒡子苷元高剂量组比较,HMGB1+牛蒡子苷元高剂量组HMGB1、TLR4、p-NF-κB p65 蛋白相对表达量升高(P<0.05)。
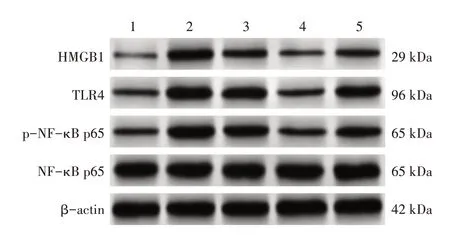
图5 各组大鼠肾组织HMGB1/TLR4/NF-κB通路相关蛋白电泳条带图(Western Blot法)Figure 5 Comparison of electrophoretic bands of HMGB1/TLR4/NF-κB pathway-related proteins in renal tissue among each group of rats(Western Blot method)
3 讨论
肾纤维化作为慢性肾病的一个关键步骤,其主要特征包括促纤维化因子的过度产生和沉积、肾小管间质炎症反应、肾细胞大量凋亡等[16-18]。相关研究显示,单侧输卵管梗阻(UUO)小鼠肾功能指标SCr、BUN水平以及血清中炎症因子IL-1β、IL-6 水平升高,表明UUO 小鼠存在肾功能下降及炎症反应[19];在UUO 后,包括Collagen I、α-SMA在内的多种纤维化蛋白在肾组织中的表达显著增加,提示UUO 成功诱导了肾纤维化[20];肾细胞凋亡加速了肾纤维化的进展[21]。UUO是一种经典且广泛使用的实验性肾间质纤维化模型[22]。本研究构建了UUO 大鼠模型,HE 及Masson 染色结果显示,模型组大鼠肾组织病理损伤及纤维化严重,且CollagenⅠ、α-SMA 的表达升高,表明UUO 诱导肾纤维化大鼠模型构建成功。本研究结果还显示,模型组大鼠肾功能指标(24 h UTP、SCr、BUN)、炎性因子(IL-1β、IL-6)水平及肾细胞凋亡率显著高于假手术组,提示UUO 诱导肾纤维化大鼠肾功能异常,炎症反应及肾细胞凋亡加剧。经低、高剂量牛蒡子苷元处理后,UUO 大鼠肾组织病理损伤减轻,纤维化减少,24 h UTP、SCr、BUN、IL-1β、IL-6 水平及肾细胞凋亡率明显降低,提示牛蒡子苷元可抑制UUO 大鼠肾纤维化及炎症损伤。
HMGB1 是炎症反应重要的调节剂,其可与TLR4 结合,通过髓样分化因子88(MyD88)依赖性机制激活NF-κB 信号通路,进而促进炎症细胞因子的产生,如IL-1β 和IL-6 等[23]。据报道:抑制HMGB1/TLR4/NF-κB 信号通路可对造影剂肾病产生肾脏保护作用[24];抑制HMGB1/TLR4/NF-κB 通路可减轻糖尿病肾病大鼠肾组织病理损伤[25];Lu等[26]研究表明,牛蒡子苷元能抑制HMGB1/TLR4/NF-κB 信号通路,改善弓形虫诱导的肝损伤小鼠肝脏炎症。因此,本研究推测牛蒡子苷元可能通过抑制HMGB1/TLR4/NF-κB 信号通路介导的炎症反应在肾纤维化中起到一定的治疗作用。本研究结果显示,UUO 大鼠肾组织中HMGB1、TLR4、p-NF-κB p65 蛋白表达升高,推测HMGB1/TLR4/NF-κB 信号通路参与了UUO 大鼠肾纤维化进程。牛蒡子苷元干预后,UUO 大鼠肾组织中HMGB1/TLR4/NF-κB 信号通路上述蛋白表达明显减少,推测牛蒡子苷元通过抑制HMGB1/TLR4/NF-κB 信号通路减轻UUO 大鼠肾纤维化。为了验证该推测结果,本研究将高剂量牛蒡子苷元处理的UUO 大鼠再用HMGB1 过表达质粒进行干预,结果显示,HMGB1 逆转了高剂量牛蒡子苷元对UUO 大鼠肾纤维化的抑制作用。
综上所述,牛蒡子苷元对UUO 大鼠肾纤维化具有明显的改善作用,其机制与抑制HMGB1/TLR4/NF-κB信号通路有关。
