胸椎黄韧带骨化症后路经皮内镜减压术后1 年预后情况及影响因素分析
2023-07-11王永乐占恭豪
王永乐,占恭豪
胸椎黄韧带骨化症(TOLF)临床表现为下肢麻木、感觉异常和步行困难等症状,严重者可导致截瘫,对患者身心健康造成不利影响[1]。目前临床主要采用传统开放手术和微创内镜手术治疗,但开放手术会对患者脊柱稳定性造成一定影响,导致术后椎体长期不稳,从而引发驼背等脊柱畸形[2]。近年来,后路经皮内镜减压术因创伤小、术中出血量少和椎旁组织损伤小等优点逐渐被应用于TOLF 的治疗中[3]。但因患者病情和手术情况的不同,其预后不尽相同。此外相关研究显示[4],部分患者术后仍会出现减压效果欠佳和功能恢复较差等情况,预后较差。因此对TOLF 患者后路经皮内镜减压术后预后情况进行分析并积极寻找导致预后不良的潜在因素十分重要,有助于指导临床采取个性化和科学化的干预措施,以改善患者预后。基于此,本研究通过分析TOLF患者的临床资料,探讨其预后情况,并分析影响预后的相关因素,现报道如下。
1 资料与方法
1.1 一般资料 选取2016 年5 月至2021 年4 月在温州医科大学附属第二医院及温州市中医院择期行后路经皮内镜减压术的TOLF 患者80 例。纳入标准:术前影像学结果提示单节段或多节段TOLF;症状、体征持续12 周以上,与影像学结果相符;所有患者年龄≥18 岁;所有患者均进行后路经皮内镜减压术治疗并接受随访;患者及其家属均了解同意本次研究。排除标准:存在脊柱结核、脊柱肿瘤等其他脊柱病变者;行开放手术患者;存在其他神经系统疾病者;存在重要脏器功能病变者或凝血功能障碍者;存在精神疾病者。本研究经温州市中医院医院伦理委员会审批通过。
1.2 方法 采用Joimax经皮椎间孔镜系统(卡尔斯鲁厄,德国),指导患者俯卧位,利用C臂机对责任椎间盘和椎板位置进行定位后画点,皮肤进针点至椎板位置2 cm,行对穿刺部位局部麻醉后进行手术操作。插入穿刺针,在C 臂机的引导下将穿刺针插入至患者椎板,待经过筋膜层及椎板位置时将针芯退出,再次注入8 ~10 ml 0.5%利多卡因进行麻醉。将导引钢丝插入其中并退出穿刺针,然后沿着钢丝作一0.8 cm 的切口,逐级插入扩张管及工作导管。退出导引钢丝和扩张管后插入导棒,然后沿着导棒将工作套管和椎间孔内镜插入,完成椎板位置的分离操作,使骨膜暴露,切除椎板骨质,再作一0.8 cm 的骨窗。切除背侧增生黄韧带,对脊髓背侧进行充分减压。术毕完成灌洗和止血,逐层缝合伤口。本次手术均由经验丰富的2 位医生共同完成。
1.3 观察指标 于患者入院时,收集年龄、性别、病程等基本资料,评估是否存在排便功能障碍。术前采用磁共振成像(MRI)检查,记录患者骨化分型(孤立型、连续型和跳跃型)、病变节段和T2加权像髓内信号;采用计算机断层扫描(CT)检查,测量患者胸椎管面积和黄韧带骨化物面积,计算胸椎管面积残余率,胸椎管面积残余率=[1—(黄韧带骨化物面积/胸椎管面积)]×100%。于术后观察脑脊液漏出发生情况,并记录手术相关指标即手术时间和术中出血量。术后随访1 年,于术前和末次随访时评估患者的日本骨科协会(JOA)脊椎功能评分[5]、数字分级法(NRS)评分[6]和Oswestry 功能障碍指数(ODI)评分[7]。以JOA 评分改善率作为评定预后的标准,术后JOA 评分改善率=(术后 JOA 评分—术前)/(11—术前)×100%,术后JOA 评分改善率≥75%为优,50 ~74%为良,25 ~49%为可,<25%为差,其中将改善率≥25%(优+良+可)作为预后良好组,将改善率<25%(差)作为预后不良组[8]。
1.4 统计方法 采用SPSS 22.0 软件进行整理和分析,计数资料采用2检验;满足正态分布且方差齐的计量资料采以均数±标准差表示,采用t 检验;采用Logistic 回归分析分析影响TOLF 患者后路经皮内镜减压术后1 年预后不良的独立危险因素。P <0.05 表示差异有统计学意义。
2 结果
2.1 手术疗效 手术后,患者JOA 评分升高,NRS和ODI 评分均降低(均P <0.05),见表1。

表1 手术前后的JOA、NRS 和ODI 评分比较 分
2.2 预后情况 随访末次时80 例患者的JOA评分为(8.69±0.42)分,其中优24 例,良21 例,可17 例,差18 例。预后良好组62 例(77.50%),预后不良组18 例(22.50%)。
2.3 单因素分析 两组病程、术前T2加权像髓内信号、术前胸椎管面积残余率、术后脑脊液漏出发生情况、术前排便功能障碍和术前JOA 评分比较差异均有统计学意义(均P <0.05);两组性别、年龄、骨化分型、病变节段、手术时间和术中出血量差异均无统计学意义(均P >0.05),见表2。
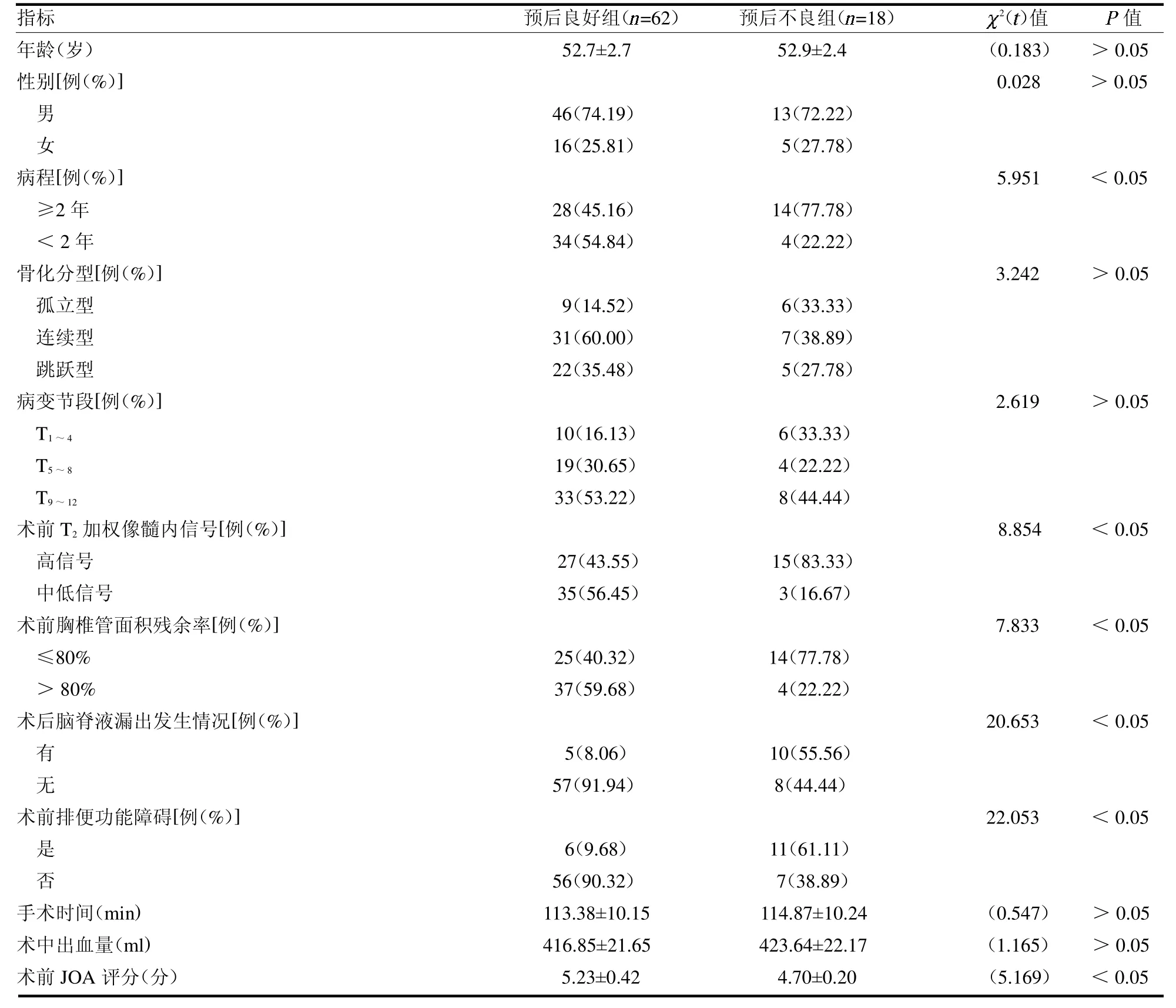
表2 单因素分析
2.4 多因素Logistic回归分析 将预后情况作为因变量(预后不良组=1,预后良好组=0),将单因素分组中差异有统计学意义的因素作为自变量(赋值见表3),并进行二分类Logistic 回归分析。Logistic 回归分析显示,术前 T2加权像髓内信号为高信号(OR=2.869)、胸椎管面积残余率≤80%(OR=3.782)和术后有脑脊液漏出发生(OR=2.622)均为影响TOLF 患者后路经皮内镜减压术后1 年预后不良的独立危险因素(均P <0.05),见表4。

表3 自变量赋值

表4 影响TOLF 患者后路经皮内镜减压术后1 年预后不良的Logistic 回归分析
3 讨论
早期诊断和早期治疗TOLF 对改善患者预后尤为重要。目前TOLF 治疗的关键在于早期减压,既往临床常用的开放手术虽可有效治疗TOLF,但这些方式术中出血量大、手术时间长,并且易引发脊髓损伤和脑脊液漏等并发症[9]。随着脊柱微创孔镜技术的发展,后路经皮内镜减压术治疗TOLF 已成为可能。但由于该技术操作难度大,对术者要求高,再加之各种外界因素的影响,使术后恢复效果与预期效果相差较大。本研究中,80 例患者术后1 年的JOA 评分升高,NRS 和ODI 评分均降低,但JOA 评分改善率≥25%仅有62 例,另18 例患者则预后不良,且术后脑脊液漏的发生率为18.75%(15/80),提示大多数TOLF 患者采用后路经皮内镜减压术治疗可明显改善脊椎功能,缓解疼痛症状,但仍有部分患者疗效较差,术后易发生脑脊液漏。
本次研究发现术前排便功能障碍、病程≥2 年、术前JOA 评分<5 分均为影响TOLF 患者后路经皮内镜减压术后1 年预后不良的相关因素,可能是与本研究中所纳入的样本量较少有关。本研究中Logistic回归分析显示,术前T2加权像髓内信号为高信号(OR=2.869)、胸椎管面积残余率≤80%(OR=3.782)和术后有脑脊液漏出发生(OR=2.622)均为影响TOLF患者后路经皮内镜减压术后1 年预后不良的独立危险因素。究其原因:(1)采用MRI 检查可了解脊髓内的病理变化情况,在正常生理情况下,术前T2加权像髓内为中等信号。因TOLF 患者机体某些病变节段的脊髓受到长期压迫,使得血液循环障碍而出现局部缺血现象,导致T2加权像髓内呈现高信号。申沧海等[10]研究表明,T2加权像髓内高信号与脊髓受压程度呈正相关,说明此时的脊髓功能受损更严重,预后更差。此外,相关研究报道显示[11],T2加权像髓内出现高信号可能与脊髓软化、感染、缺血和水肿等密切相关,此类变化使得患者在术后也难以恢复正常的脊椎功能,从而影响患者预后,与本研究结果类似。故临床对出现T2加权像髓内呈现高信号的TOLF 患者应尽早采用手术治疗,以缩短脊髓受压时间,规避缺血发生,从而达到改善患者预后的目的;(2)胸椎管面积残余率越低,脊髓压迫程度越严重,血液循环更易受阻,此时脊椎不可逆性损伤的发生风险越大,术后并发症发生率较高,不利于患者的术后恢复[12]。有研究显示,当术前胸椎管面积残余率≤80%时,韧带的骨化组织与硬膜之间联系更为紧密,严重者还可发生硬膜骨化,在进行手术时易造成硬膜刺破而使脊髓再次受压,进而影响神经功能,导致预后效果欠佳[13]。故针对此类患者,临床在进行治疗时可在术中常规使用甲泼尼龙,以降低术后并发症的发生风险;(3)当TOLF 患者体内的硬膜受到骨化组织的长期压迫并与之相融时,手术操作难度大大增加,使术者在进行骨化组织的切除时会伤及硬脊膜,最终导致硬脊膜的破裂而引发脑脊液漏[14]。脑脊液漏的发生会引起TOLF患者术后出现恶心呕吐、头痛等一系列症状,甚至可导致伤口感染,对术后恢复产生不利影响[15]。故临床在治疗时应彻底减压,在术中应尽可能的减少对硬脊膜的伤害,若发现损伤应及时采取针对性补救措施,以降低脑脊液漏的发生风险,促进术后快速恢复,改善预后。
综上所述,对TOLF 患者采用后路经皮内镜减压术治疗可取得较好疗效,有助于改善患者脊柱功能,缓解疼痛程度,但术前T2加权像髓内信号为高信号、胸椎管面积残余率≤80%和术后有脑脊液漏出发生均为影响TOLF患者后路经皮内镜减压术后1 年预后不良的独立危险因素,临床应对此类人群多加关注,积极采取预防性的干预措施,以改善预后。
