miR-29c 和miR-93 在卵巢癌患者血清中的表达及其临床意义
2023-07-11于聪祥李跃飞刘亚萍
于聪祥,李跃飞,刘亚萍*
(1.内蒙古医科大学附属医院妇产科,内蒙古 呼和浩特 010050;2.内蒙古自治区妇幼保健院妇产科,内蒙古 呼和浩特 010012)
卵巢癌(ovarian cancer,OvCa)在全球女性恶性肿瘤中的发病率及病死率位居第四[1],约85%卵巢癌发现时已经处于中晚期[2],5 年总生存率低于30%[3],预后相对较差,并且有年轻化趋势。目前国内外面临的瓶颈是缺乏有效的筛查手段,难以对卵巢癌进行早期诊断以及精准治疗。研究发现上皮性卵巢癌的发生发展及浸润转移与p53突变率、p16和Ki67的高表达率具有显著相关性,有助于进行临床诊断,可能作为诊断和预后的特异性抗体指标[4]。然而p53 突变率、p16 和Ki67 的表达率不能应用于卵巢癌的早期筛查及早期诊断。血清糖类抗原125(cancer antigen125,CA125)是MUC16 基因编码的糖蛋白,在正常组织中呈低表达或不表达,在卵巢癌恶性肿瘤中却呈显著升高趋势,广泛应用于卵巢癌的早期诊断。然而其敏感性、特异性相对较低,并且假阳性率相对较高[5]。相当多的患者难以实现早期诊断,而错失治疗时机。微小核糖核酸(micro RNA,miRNA)是在恶性肿瘤中新近发现的一类影响肿瘤转移、复发的重要生物学标志物。miRNA 是由20~22 个核苷酸组成的一类内源性、不编码蛋白质的小型非编码RNA,转录后通过靶向互补的DNA 和miRNA 序列调控基因表达[6]。目前的研究热点主要集中在试图将miRNA 作为癌症的早期诊断指标。然而关于miRNA 与卵巢癌的研究仍处于起步阶段,miRNA 能否联合CA125 作为卵巢癌诊断及治疗的重要分子标志物,以实现对卵巢癌的二级预防,是亟待解决的重要问题。本课题拟通过测定卵巢癌患者血清中miR-29c、miR-93 表达情况,探讨miR-29c、miR-93 在卵巢癌患者中的生物学特性,进而分析其潜在的临床应用价值。
1 资料和方法
1.1 一般资料
选取2016 年4 月至2018 年1 月内蒙古医科大学附属医院妇产科因卵巢肿瘤住院的患者32例,其中卵巢癌患者20 例(包括卵巢上皮性恶性肿瘤14例、非上皮性恶性肿瘤6 例)、卵巢良性肿瘤(benign ovarian tumor,BT)12 例,所有患者入组前采集血液标本,待术后病理确诊方列入相应组别。所有卵巢癌均行卵巢癌根治术。另随机选取无卵巢肿瘤的正常健康女性(normal healthy women,N)12 例为对照组,采集血液样本。研究组患者平均年龄(42.52±4.38)岁,对照组平均年龄(41.68±3.86)岁,对照组平均年龄(39.82±4.13)岁,组间比较平均年龄等一般资料差异无统计学意义(P>0.05),有可比性。所有受试者均签署知情同意书,且本研究已获得内蒙古医科大学附属医院伦理委员会批准。入组前未接受放化疗或激素药物治疗;不合并自身免疫系统疾病、其他脏器器质性病变及恶性肿瘤等。
1.2 标本采集
收集20 mL血液于EDTA管中,室温下放置2 h,以3 000 rpm/min离心15 min,离心后将血浆匀浆等分于-80 ℃保存。
1.3 miRNA提取
根据生产商说明,使用QiAzol Lysis Reagent(Qiagen,杜塞尔多夫,德国)裂解血清样品。将miRNeasy 血清、血浆掺入对照(Qiagen)添加到裂解样品中进行miRNA提取。具体的提取过程如下:取200 μL 血清样本,加入5 倍体积的裂解液,涡旋混匀,室温静置5 min;加3.5 μL control 工作液,混匀;加200 μL 氯仿,涡旋15 s,室温放置3 min;4 ℃1 2000 rpm 离心15 min;取上清液至新EP 管,加1.5倍体积无水乙醇,涡旋混匀;将上述溶液移至吸附柱中,室温1 2000 rpm 离心1 min,弃废液;加700 μL RWT buffer至吸附柱中,室温1 2000 rpm 离心1 min,弃废液;加500 μL RPE buffer 至吸附柱中,室温1 2000 rpm 离心1 min,弃废液;加500 μL 80%乙醇至吸附柱中,室温1 2000 rpm 离心2 min,弃废液及收集管;将吸附柱置于新的收集管上,室温1 2000 rpm离心5 min;将吸附柱置于新的EP 管上,加入14 μL RNase-free water于吸附柱中央,静置1 min,1 2000 rpm离心1 min;提好的RNA放到-80 ℃保存。
1.4 血清miRNA反转录
使用Mir-XTM miRNA 第一链合成试剂盒(Ta-KaRa,中国大连)。根据生产商说明进行血清miRNA反转录,反转录反应体系为:5 μL缓冲液、3.75 μLRNA、1.25 μL酶。反应条件如下:37 ℃反应1 h、85℃反应5 min。4 ℃冷却,用100 μL cDNA,-20 ℃保存。
1.5 实时定量聚合酶链反应(qRT-PCR)
qRT-PCR反应体系根据SYBR Premix Ex TaqTMII(TaKaRa)说明制备。每个样品设置两个反应孔,并进行3 次平行实验。反应条件为:预变性(95 ℃,2 min)、变性(95 ℃,2 min)、退火(60 ℃,15 s)、延伸(72 ℃,30 s)、共进行40 个循环。上游引物由上海胜工生物工程有限公司提供。 mRQ 3'Primer作为下游引物(TaKaRa)。秀丽隐杆线虫miR-39 作为内参基因。采用RT-qPCR 实验[18]检测血清中特定miRNA 的相对表达量。将所研究的miRNA 的每个循环阈值(Ct)用内源参考miRNA的Ct(ΔCt)进行标准化,ΔCt=平均值Ct(参考miRNA)-平均值Ct(目标miRNA),特定的miRNA 相对内参基因的相对表达量采用2-Δct值表示。BT 或OvCa 组的每例患者均以正常健康女性组的平均值(N 个)(ΔΔCt)进行标准化。ΔΔCt=平均值Ct(来自N 个正常健康女性miRNA 的平均值)-平均值Ct(来自BT 或OvCa 的miRNA的平均值),特定的miRNAs相对阴性对照组的相对表达量采用2-Δct值表示。
1.6 引物
RT- qPCR 实验中所用到的引物采用Primer 5软件和NCBI Primer- BLAST 进行设计,Tm 值在60 ℃上下浮动,引物设计均符合RT-qPCR 正常进行的要求。具体引物见表1。内参基因miR- 39(miRNeasy®Serum/ Plasma Spike- In Control),U6 引物(Mir-X™miRNA First-Strand Synthesis Kit),3′microRNA Primer 通用下游引物(Mir- X™miRNA First-Strand Synthesis Kit)均由试剂盒提供。F 表示上游引物,R表示下游引物。
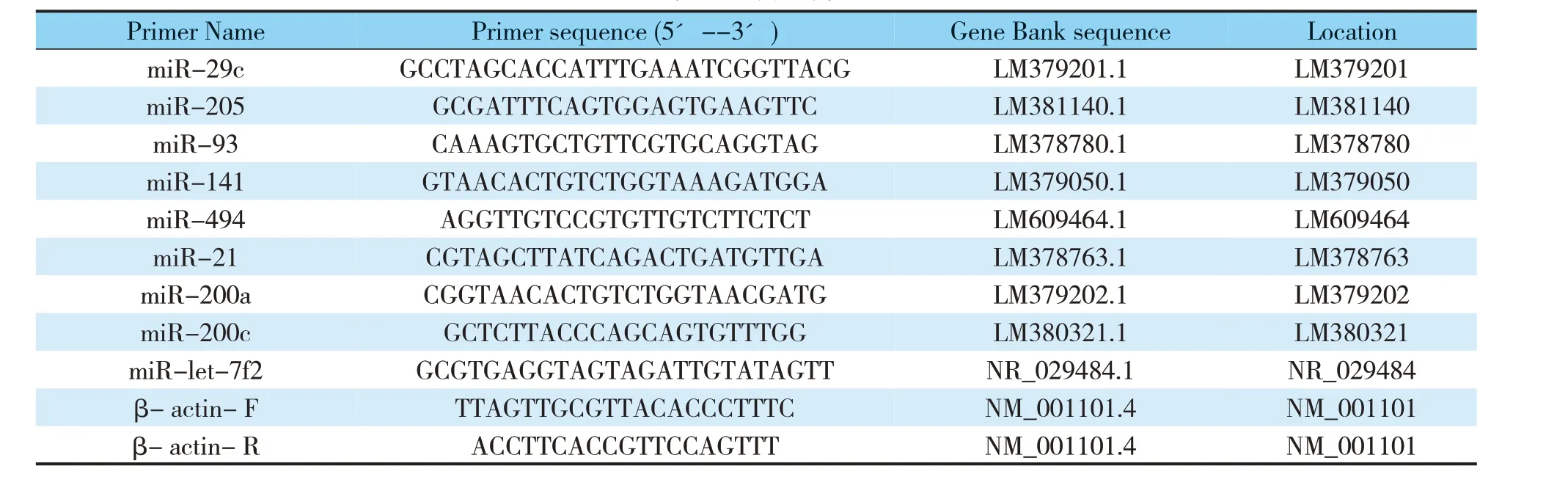
表1 引物列表
1.7 统计学方法
使用SPSS 22.0软件进行统计学分析。计量数据用(±s)表示,利用t检验;计数数据用[n(%)]表示,利用χ2检验,组间比较采用秩和检验。通过受试者工作特征曲线(ROC)分析miRNA的诊断能力,并计算其下面积(AUC)。检验水准为α=0.05,P<0.05被认为差异具有统计学意义,预后采用Logistics回归进行分析。
2 结果
2.1 主要指标
本研究共纳入44 位受试者,包括20 位OvCa 患者(其中包括上皮性卵巢癌患者14例、非上皮性恶性肿瘤6例)、12位良性卵巢肿瘤患者(BT)和12位正常健康女性(N),以评估外周血中差异表达的miRNA。
2.2 选择miRNA
根据文献资料,本实验选择8 种miRNA 作为OvCa 患者候选生物学标志物[7~9],包括miR-29c、miR-93、miR-141、miR-21、miR-200a、miR-200c、miR-494-5p 和miR-let-7f2-5p。资料表明在OvCa患者中,上述miRNA在血清或组织样本中的浓度均比正常健康女性更高或更低。本研究预实验应用RT-qPCR检测了12位卵巢癌患者血清中8种miRNA的表达。结果显示,OvCa 患者血清中miR-29c、miR-93相对浓度显著高于BT患者或正常健康女性。因此,后续实验中选取miR-29c、miR-93 作为OvCa诊断的潜在血清miRNA指标进行验证(见图1)。

图1 各组血清样品中miRNA的表达情况
2.3 卵巢癌患者血浆中miR-29c 与miR-93 含量高于正常健康女性
本实验通过qRT-PCR 分别对20 位OvCa 患者血清的每种miRNA(miR-29c、miR-93)进行了3 次测定,将3组独立实验的Ct值取平均值,并标准化为内部参比miR-39,以获得Δct值。如材料和方法[10]中所述计算2-Δct和2-ΔΔct值。通过分析受试者血清样品中的表达来标准化这两种miRNA的qRT-PCR数据。
与BT 患者和正常健康女性相比,OvCa 患者血清中miRNA(miR-29c、miR-93)浓度更高。N、BT和OvCa 组中miR-29c 的平均相对浓度分别为0.003、0.015和0.053(见图2A)。N、BT和OvCa组中miR-93的平均相对浓度分别为0.112、0.345 和0.630(见图2B)。散点图显示,OvCa患者miR-29c和miR-93的血清浓度高于正常健康女性,差异有统计学意义(P<0.05)(见图2)。
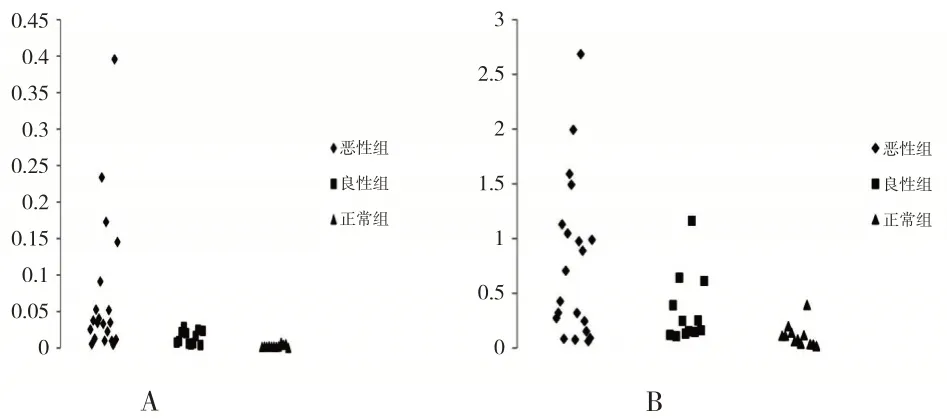
图2 不同组别miR-93浓度含量(OvCa 患者(n=20)、BT 患者(n=12)和正常健康女性(n=12)血清中miR-29c,miR-93的差异表达散点图)。
2.4 miR-29c、miR-93 结合CA125 在OvCa 中的诊断价值
通过IBM SPSS Statistics 软件对OvCa 患者血清中的miR-29c、miR-93 和CA125 进行联合分析。参照正常CA125(<35 U/mL)范围,选择中位数18 U/mL作为正常健康女性组的CA125值,miR-29c、miR-93血清水平的差异显著,OvCa 患者和健康正常女性miR-29c、miR-93、CA125及其组合的AUC值分别为0.599、0.538、0.893 和0.910。miR-29c、miR-93 与CA125组合可以区分OvCa患者和正常健康女性,敏感性为89%(见图3)。miR-29c、miR-93、CA125 及其组合的敏感性和特异性由最高的约登指数确定(敏感性+特异性-1)。总之,将miR-29c、miR-93与CA125结合起来作为诊断OvCa的新方法是可行的。

图3 ROC曲线分析
2.5 miR-29c 、miR-93 结合CA125 对OvCa 预后分析
该实验所检测卵巢癌症20例患者中,随访到16例,其中4例因联系方式改变而失访,截止到2020年12月31日,所随访患者随访时间均为≥4年、<5年,结局变量为是否复发。因变量为是否复发,赋值:0=未复发,1=复发。自变量为miR29C、miR93 和CA125。选择Logistics 回归进行分析。经Logistics回归分析可知,miR29C、miR93 和CA125 对于是否复发没有影响(P>0.05)(见表2)。
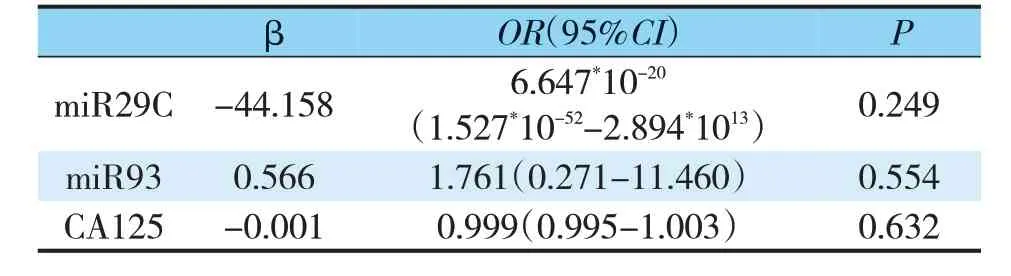
表2 预后影响因素筛选结果
3 讨论
卵巢位于盆腔深处,早期病变不易被发现,目前临床上缺乏有效的筛查手段。大多数患者出现症状前来就诊时已进展为晚期卵巢癌。治疗效果明显降低,患者预后差、生存率极低。因此,寻找特异性标志物以实现对卵巢癌的二级预防,早发现、早诊断并进行早期精准治疗是改善卵巢癌患者不良预后的关键。
miRNA是一组内源性非蛋白编码RNA,约占人类基因组的1%~5%。其广泛参与基因的表达和信号通路的调控,主要功能是参与基因转录后的调控[6]。miRNA在肿瘤、炎症等疾病中发挥重要作用,是目前国内外的研究热点,关于miRNA在卵巢癌发病机制中的研究仍处于起步阶段。2020年胡菊梅等通过qRT-PCR 法检测卵巢癌组织中和正常卵巢组织中miR-29b和miR-187的表达情况,发现miR-29b在卵巢癌组织中呈低表达,而miR-187 呈高表达,提出miR-29b 和miR-187 与卵巢癌的分化程度、淋巴结转移等临床病理特征及预后相关,认为miR-29b和miR-187可能共同影响卵巢癌不良预后[11]。国外学者研究发现miRNA-141 在卵巢癌细胞中呈高表达,可促进卵巢癌细胞异常增殖,与卵巢癌转移及预后有关[12]。miR-519a 通过调控信号通路及转录激活因子3(activating transcription factor 3,STAT3)发挥抑癌作用[13]。这表明多种miRNA可能与卵巢癌发生发展、侵袭转移密切相关。研究表明miR-29c是血管内皮细胞损伤的调节因子,miR-29c 通过靶向结合IGF-1 的3’-UTR,参与调节内皮细胞的细胞循环、增殖和血管形成等[14]。Liu 等[15]研究发现miR-29c 靶向抑制血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达,促进内皮细胞的血管参与肿瘤形成。2015年穆鹏等[16]采用qRT-PCR对65 例卵巢癌患者经手术切除的上皮性卵巢癌组织标本进行检测分析发现,卵巢癌组织中miR-29c表达水平高于正常组和良性肿瘤组。卵巢癌组miR-29c 表达水平与肿瘤分化程度、临床分期及淋巴结转移具有相关性,提出miR-29c 在卵巢癌诊断及病情评估方面具有一定应用价值。本研究结果显示,OvCa 患者血清中miR-29c 的浓度明显高于卵巢良性肿瘤和正常健康女性的血清浓度(P<0.05)。这提示miR-29c 可能通过调节血管形成促进卵巢癌细胞增殖侵袭,在卵巢癌的发生发展中起重要作用。通过检测血清miR-29c 的表达情况可能辅助诊断卵巢癌。
miR-93 是近年发现的位于染色体7922 上的miR-106b-25基因簇,在非小细胞肺癌、子宫内膜癌和乳腺癌组织中呈现高表达[17~19]。研究结果显示[20],miR-93 通过调控抑癌基因PTEN 发挥作用,过表达的miR-93 可阻断细胞凋亡,与结直肠癌相关。miR-93 过表达可以促进鼻咽癌细胞[21]和食管癌细胞[22]的异常增殖,其过表达还与胆管癌的发生及发展密切相关[23]。miR-93 在胃癌组织及胃癌细胞株中的表达明显升高,过表达的miR-93 可显著促进胃癌细胞的增殖,并诱导细胞由Go/G1期向S期演进,提出miR-93 通过促进细胞增殖,诱导细胞周期的演进而参与胃癌的形成[24]。这提示miR-93 在癌症中发挥着促癌基因的作用。课题前期研究,分别在卵巢癌细胞株(A2780)和正常卵巢上皮细胞株(IOSE-80)中提取得到miRNA,并采用qRT-PCR 检测两种不同细胞系中miR-93 的相对表达水平,实验结果显示miR-93 在卵巢癌细胞系中的水平明显高于正常卵巢上皮细胞[25]。然而,陈说等[26]研究发现上皮性卵巢癌和卵巢交界性肿瘤中,miR-93的表达水平显著低于正常卵巢组织,miR-93的表达水平与分化程度及FIGO 分期呈负相关。实验结果显示,Lnc RNA TDRG1 通过抑制miR-93 进而解除miR-93对Rho C(ras homolog family member c,Ras同源家族成员C)的靶向抑制作用,从而参与卵巢癌的发生发展。本研究结果显示,OvCa患者miR-93的血清浓度显著高于卵巢良性肿瘤组和正常健康女性,差异具有统计学意义(P<0.05)。这提示miR-93可能抑制细胞凋亡,增强卵巢癌细胞异常增殖及迁移能力,参与卵巢癌的发生发展。通过检测血清中miR-93的表达水平,可能提高卵巢癌的临床诊断的准确率。关于miR-93 在血清、卵巢癌细胞系中与卵巢癌组织中表达水平的差异,课题组将在今后研究中继续探讨。
miRNA 在细胞生长、分化过程中发挥着重要作用,对多种癌细胞的增殖、侵袭及转移产生重要影响[27]。血清中miRNA 具有稳定性、耐受核酸酶活性以及易检测等优点,可以作为肿瘤的非侵入性的生物学标志物。检测血液中表达明显的miRNA 作为恶性肿瘤诊断手段已应用于临床。然而,迄今为止在临床上还没有miRNA 或miRNA 组被用作卵巢癌的生物标记。本研究通过ROC曲线分析结果显示,miR-29c、miR-93与CA125的结合在诊断OvCa方面比CA125更为灵敏和准确,敏感性为89%。以上结果表明,miR-29c、miR-93 和CA125 的组合可能对卵巢癌的诊断具有潜在临床意义。
综上所述,miR-29c、miR-93 可能在卵巢癌的发生发展过程中起重要作用,miR-29c、miR-93 和CA125 的组合提高卵巢癌诊断的灵敏度和特异度,可能对卵巢癌的诊断具有潜在临床意义。miR-29c、miR-93 或许可以作为预测卵巢癌的生物学标志物。本研究的不足之处在于样本量不足,在后续研究中,课题组将继续扩大样本量,进一步证实该研究的可靠性,并检测miR-29c、miR-93在卵巢癌血清和癌灶组织中的表达情况,通过体外实验探究miR-29c、miR-93参与卵巢癌发生发展的分子机制。
