布鲁菌病患者外周血NK 细胞亚型及穿孔素蛋白的临床分析
2023-07-11李宇璞乔鹏飞其其格赵海珍刘瑞军季晓磊
李宇璞,乔鹏飞,其其格,赵海珍,刘瑞军,季晓磊
(1.内蒙古医科大学第一临床医学院,内蒙古 呼和浩特 010059;2.内蒙古医科大学附属医院影像诊断科,内蒙古 呼和浩特 010050;3.内蒙古医科大学附属医院感染性疾病科,内蒙古 呼和浩特 010050)
布鲁菌病(Brucellosis,简称布病)是由布鲁氏菌属(Brucella)细菌引起的全球性人畜共患变态反应性传染病,每年感染者超过50 万[1]。布鲁氏菌为胞内寄生菌,在胞内菌感染的机体抗感染免疫防御机制中,细胞杀伤效应占主导地位[2]。自然杀伤细胞(naturel killer cell,NK)作为机体天然免疫细胞的主要成分,识别外来病原体,识别被病原微生物感染的细胞,如单核、巨噬细胞,并无需依赖抗体,无需预先致敏,通过穿孔素、颗粒酶等发挥细胞毒性作用;同时分泌大量干扰素、白细胞介素等细胞因子、黏附分子受体及趋化因子的受体来发挥杀伤细胞和免疫调节作用。本研究通过流式细胞术测定布病患者外周血NK 细胞表型及穿孔素蛋白、颗粒酶的表达,从而进一步评估布病患者NK细胞功能状态。
1 资料与方法
1.1 一般资料
1.1.1 病例来源 选取内蒙古医科大学附属医院感染科及内蒙古地方病防治中心的布鲁菌病患者,并将同期就诊的健康人作为对照组。共纳入65 例布鲁菌病患者作为实验组,按SAT 可分为两组:将结果为SAT1:50(+~++)的30例,作为慢性布鲁菌病患者组;将结果为SAT1:100(+~++++)的35例,作为急性布鲁菌病患者组。并将同期体检结果为BPT(-)、SAT(-)的30例作为健康对照组。故最终分组为RBPT(-)、SAT(-)组,SAT1:50(+~++)患者组和SAT1:100(+~++++)患者组。
1.1.2 疾病诊断标准(同时符合以下项目者)流行病学史+典型的临床症状体征+虎红平板凝集试验(RBPT)试管凝集试验(SAT)和/或局部活组织病理检查阳性或细菌学诊断阳性。
1.1.3 纳入标准(同时符合以下项目者) 门诊/住院患者,年龄18~65 岁,符合布病诊断标准,自愿签订知情同意书。
1.1.4 排除标准 合并糖尿病、肺部感染、泌尿系统感染、风湿病、肿瘤、心脑血管病及肝、肾、造血系统严重疾病及其他骨关节病,妊娠期或哺乳期,过敏体质、精神病。
1.1.5 样本量估算 病例数依据“样本数须为变量数的5~10倍”的原则进行调整
1.1.6 CD56brightCD16+、CD56dimCD16+、CD56brightNK 细胞穿孔素蛋白、颗粒酶B等均购自BD公司。
1.2 研究方法
1.2.1 样品采集符合纳入标准患者治疗前两天采集人口学特征、流行病学调查,于清晨采集纳入者空腹状态下外周血4 mL,并注入盛有EDTA 抗凝剂的抗凝管中低温送至临床试验中心,6 h 内处理样本,进行细胞表面标记抗体和细胞毒效应分子细胞内染色,利用流式细胞仪检测NK 细胞的表型、NK细胞穿孔素蛋白、颗粒酶B表达量。
1.2.2 实验步骤(NK 细胞的表型、NK 细胞穿孔素蛋白、颗粒酶B表达):
(1)样品(全血)100 μL。
(2)胞膜标记:样品管依次加PerCP5 μL、FITC5 μL,涡旋混匀,室内避光孵育20~30 min(25 min)。
(3)裂解:样品管加1X 裂解液(10X 裂解液555899 1.5 mL+13.5 mL去离子水)2 mL,涡旋混匀,室温避光孵育20~30 min(30 min),离心3000~5000 g/min(1600 r/min)5 min,弃上清液。
(4)PBS2 mL 重悬细胞,涡旋混匀,离心5 min(同上),弃上清液。洗2遍。
(5)固定:样品管加固定液554722 250 μL,重悬细胞。4 ℃避光孵育20 min,离心5 min,弃上清液。
(6)洗涤:样品管加1X 洗脱液(10X 洗脱液554723 1.5 mL+13.5 mL 去离子水)1 mL,涡旋混匀,离心5 min(同上),弃上清液。洗2遍。
(7)胞质标记:样品管加1X 洗脱液50 μL,重悬细胞。依次加APC 5 μL、PE 5 μL,4 ℃避光孵育20~30 min(20 min)。
(8)PBS1 mL,重悬细胞,涡旋混匀,离心5 min(同上),弃上清液,洗1遍。
(9)PBS500 μL重悬细胞,上机,进行流式分析。
1.3 统计学方法
采用SPSS 22.0软件包分析数据,符合正态分布的计量资料以均数±标准差(±s)表示,多组间比较用单因素方差分析,组间两两比较采用snk-q 检验;计数资料以例n(%)表示,组间比较采用χ2检验。检验水准为α=0.05,以P<0.05 表示组间差异有统计学意义。
2 结果
2.1 一般情况
纳入布病患者65 例,包括慢性布鲁菌病患者SAT1:50(+~++)30 例和急性布鲁菌病患者SAT1:100(+~++++)35 例,其中男性40 例、女性25 例,平均年龄48.84 岁,职业分布以农民、兽医为主;主要接触牛羊,以接触羊为主(见表1)。
表1 布鲁菌病及对照组一般情况(n,±s)

表1 布鲁菌病及对照组一般情况(n,±s)
一般资料RBPT(-)、SAT(-)组SAT1:50(+~++)患者组SAT1:100(+~++++)患者组例数性别(男/女)年龄(岁)职业接触史30 15/15 52.43±10.85农民羊30 17/13 50.86±12.25农民羊35 23/12 48.03±15.24农民羊
2.2 患者外周血NK细胞表型特点
应用流式细胞技术对布病患者(SAT1:100+~++++、SAT1:55+~+++)和对照组(SAT 阴性)外周血NK细胞(CD56brightCD16+/-+CD56dimCD16+)细胞进行检测。急、慢性布鲁菌病患者外周血淋巴细胞中CD56dimCD16+和CD56brightNK 细胞细胞比率与RBPT(-)、SAT(-)组比较有所减少,但差异无统计学意义(P>0.05)(见表2)。
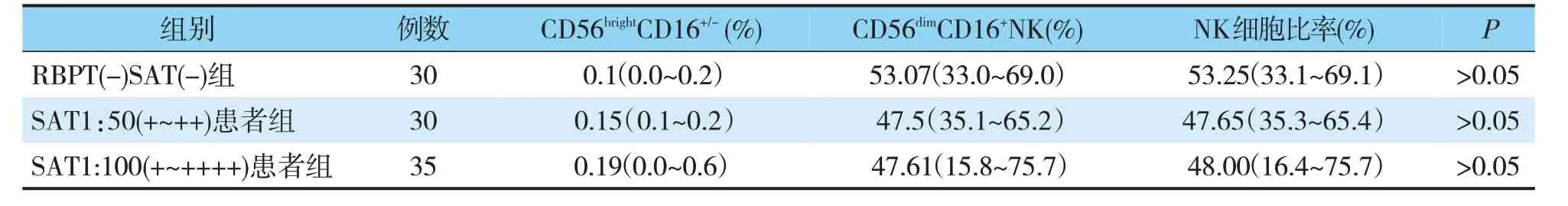
表2 3组外周血外周血NK细胞比例
2.3 穿孔素在急性布鲁菌病患者(SAT1:100+~++++)外周血NK细胞的表达
流式细胞技术检测了穿孔素、颗粒酶B 在NK细胞两亚群CD56dimCD16+和CD56brightCD16+/-NK 细胞上的表达频率。实验结果表明急性布鲁菌病患者(SAT1:100+~++++)外周血NK 细胞颗粒酶B 的表达率与RBPT(-)、SAT(-)组比较差异无统计学意义(P>0.05)。而急性布鲁菌病患者(SAT1:100+~++++)组外周血NK 细胞穿孔素蛋白的表达率与RBPT(-)、SAT(-)组NK 细胞穿孔素蛋白表达率比较差异具有统计学意义(P<0.05)(见表3)。
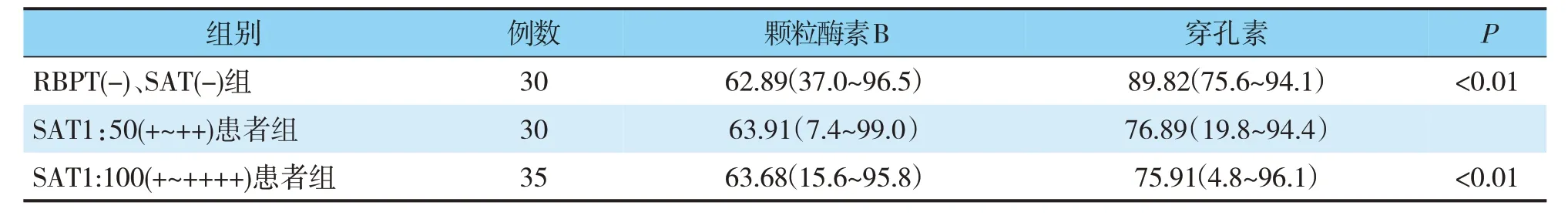
表3 3组外周血外周血NK细胞颗粒酶B、穿孔素蛋白的表达
3 讨论
NK 细胞作为人体抗感染免疫防御系统抵御外来病原微生物侵入的第一道防线,具有强大的溶解细胞的能力,其具备激活不受MHC 限制、不依赖抗体、无需预先致敏、快速非特异性地识别病原微生物、识别被感染的靶细胞、杀伤作用效果早等特性,在机体抗肿瘤和抗病毒的早期发挥重要作用[3]。同时也参与机体获得性免疫调节功能。
在人体,NK 细胞主要分布于外周血循环和淋巴器官,在外周血中占单核细胞的5%~20%。NK细胞表型为CD3-CD56+,根据其功能不同按细胞表面CD56 和CD16 的表达水平不同分为CD56brightCD16+和CD56dimCD16+/-两个不同的细胞亚群,它们在裂解靶细胞的功能上和产生细胞因子的功能上有所不同。外周血和炎症组织中90%的NK 细胞为CD56dim,具有细胞毒性作用,而不足10%为CD56bright细胞,细胞毒活性低于CD56dim细胞,具有分泌免疫调节细胞因子作用[4,5]。赖瀚铃等[6]研究中提示在SLE患者外周血CD3-CD56+NK、CD16+NK、CD107a+NK细胞比例均显著低于对照组,活动亚组SLE 患者CD3-CD56+NK、CD16+NK 细胞比例均显著低于非活动亚组(P<0.05)。张伟等[7,8]研究中梅毒患者与正常对照比较外周血中NK 细胞比值差异无统计学意义(P>0.05)。梅毒患者NK细胞中Tim-3的表达水平明显上调,特别是CD56dimNK细胞,且Tim-3的表达与血清中IFN-γ 水平呈负相关性(P<0.05,r=-0.4506)。潘招军[9]认为在EV71 感染和重症手足口病患儿外周血NK 细胞显著减少,主要表现为CD56dimNK 细胞的减少,而CD56brightNK 细胞无明显变化,外周血CD56dimNK 细胞在手足口病患儿病情较轻时,细胞毒性作用(GL 和GB,CD107a)增加可能与病毒清除相关。EV71 感染患儿中,CD56brightNK 细胞增加,炎性细胞因子与抗炎因子分泌功能严重紊乱,可能参与了EV71 感染的手足口病的重症化。刘贝贝等[10]在艾滋病的研究中得出Siglec-7+NK 细胞亚群功能优于阴性亚群,但在HIV感染中本群发生明显下降,Siglec-7+CD56dimNK细胞亚群数量与CD95的表达呈负相关。EBVcHL 患者与EBV-cHL 患者相比,CD56dimCD16 NK 细胞亚群频率降低[10]。COVID-19患者NK CD57 和CD56dimNK 细胞比例较高,NKT 和CD56bright细胞比例较低[11]。我团队在前期研究中得出布鲁菌病患者外周血NK 细胞计数下降的结论[12]。在本研究中,急、慢性布鲁菌病患者外周血淋巴细胞中CD56dimCD16+和CD56brightNK 细胞细胞比例与RBPT(-)、SAT(-)组比较差异无统计学意义(P>0.05)。
NK 细胞对靶细胞的杀伤有多种途径,如细胞毒性颗粒,其中含有穿孔素蛋白、颗粒酶A/B 和Fas配体等蛋白定向胞吐、特异性分泌溶酶体[13];NK 细胞在与易感性靶细胞接触后分泌干扰素-γ(IFN-γ),IFN-γ 可增强NK 细胞的细胞毒性。黄崇刚等[14]认为手足口病患儿存在NK 细胞穿孔素表达过高,危重型组、重症组、普通型组患儿NK 细胞数低于对照组,其中危重型组、重症组低于普通型组,穿孔素、颗粒酶B 反之,差异具有统计学意义(P<0.05)。然而姜涛等[15]研究则认为普通型手足口病组和重型手足口病组急性期比较,NK细胞穿孔素和颗粒酶B差异均无统计学意义(P>0.05);重型组EV71 手足口病恢复期患儿较急性期明显升高(P<0.05);普通型组EV71 手足口病恢复期患儿较急性期虽稍升高,但差异仍无统计学意义(P>0.05)。在HBV 相关性失代偿期肝硬化(HBV-DLC)患者NK 细胞(包括CD56dimNK 和CD56brightNK 细胞)的功能特性的研究中提示[16]HCs 和HBV-CLC 患者相比,HBV-DLC 患者循环CD56brightNK 细胞频率明显升高,而循环CD56dimNK 细胞明显降低。HBV-DLC 患者外周活化的CD56brightNK 细胞可能表达较低水平的抑制性受体CD158b1/2 和较高水平的活化受体NKG2D,其穿孔素和颗粒酶A/B 的表达也较HCs 明显增加,提示HBV-DLC患者外周CD56brightNK细胞具有较高的免疫激活状态。在HBV-DLC患者中,循环CD56dimNK细胞中CD107a 和穿孔素的表达与细胞溶解能力呈正相关,而循环CD56dimNK细胞中CD107a和穿孔素的表达显著降低,提示循环CD56dim NK 细胞的溶解能力受损。此外,我们还发现循环CD56dimNK细胞穿孔素表达与HBV-DLC 患者的Child-pugh 分级呈负相关。实验组中分泌IFN-γ 细胞数(SFU)较健康对照组增高(F= 25.413,P<0.01)。登革热患者NK 细胞内穿孔素和颗粒酶B 的表达水平发生显著上调,细胞脱颗粒水平也显著增加[17];同时表达穿孔素或颗粒酶B 的NK 细胞比例显著高于CD8+T 细胞。布鲁菌病患者血清中的IgG 抗体、穿孔素和颗粒酶B的浓度也增加(F=13.653,P<0.01)[18]。本研究中急性布鲁菌病患者,即(SAT1:100+~++++)患者组外周血NK细胞穿孔素蛋白的表达率与RBPT(-)、SAT(-)组比较有显著下降。
