WHO发布mRNA疫苗指南的思考及对我国的启示
2023-07-11韩彬曹萌成殷
韩彬 曹萌 成殷

摘 要 随着生物科学技术和制药工艺的进步,mRNA疫苗在新冠疫情背景下进入了快速发展阶段,其具有研发周期短、生产快速、临床有效性高等优势,但在开发和生产领域存在较多技术难题。药品监管机构如何对mRNA疫苗进行全链条的质量控制也成为一个研究热点。WHO在2021年发布了关于mRNA疫苗的技术指南,本文归纳了该指南的技术要点,结合我国实际情况探讨mRNA疫苗监管关注点,并对未来相关指南体系进行展望。
关键词 mRNA疫苗 WHO指南 研发 监管
中图分类号:R951 文献标志码:C 文章编号:1006-1533(2023)09-0067-04
引用本文 韩彬, 曹萌, 成殷. WHO发布mRNA疫苗指南的思考及对我国的启示[J]. 上海医药, 2023, 44(9): 67-70; 75.
Thoughts on the WHO release of mRNA vaccine guidelines and enlightenment to China
HAN Bin, CAO Meng, CHENG Yin
(Shanghai Center for Drug Evaluation and Inspection, Shanghai 201203, China)
ABSTRACT With the advancement of bioscience technology and pharmaceutical manufacturing process, the mRNA vaccines have entered a stage of rapid development under the background of COVID-19, which have the advantages of short R&D cycle, rapid production and high clinical effectiveness. However there are various technical difficulties in the field of their development and production. How the drug regulatory agencies can implement the quality control of the entire chain of mRNA vaccines has also become a research hotspot. The WHO released technical guidelines on mRNA vaccines in 2021. This article summarizes the key points of WHO guideline, discusses the regulatory concerns based on the actual situation in China and prospects the technical guidelines system in the future.
KEY WORDS mRNA vaccines; WHO guideline; research and development; regulatory
以mRNA為基础的疫苗概念可追溯至20世纪90年代[1]。通过研究病原体的基因序列,可以较快速度锁定潜在抗原的编码片段,将其序列融入DNA模板并合成相应的mRNA,进而以脂质纳米包封形成疫苗制剂即可递送至人体[2]。随着确保mRNA的稳定性、提升基于RNA产品的生产水平、减少RNA相关的炎症反应等关键技术取得突破,基于mRNA的疫苗和治疗技术在发展过程中取得了重大进展[3]。在严重急性呼吸综合征冠状病毒2型(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)导致的新冠疫情(COVID-19)背景下,国际上有多款mRNA疫苗获得紧急授权使用或获批上市,并且有越来越多的候选mRNA预防性疫苗进入临床试验阶段[4-5]。针对mRNA疫苗的监管须基于科学的方法,因此,对其相关的安全性、生产事项和监管事项进行研究是目前的一个热点[6]。
WHO近期发布了关于mRNA疫苗的技术指南[7],对用于预防人类传染病的mRNA疫苗的生产、质量控制、非临床和临床评估中的关键因素指出了须关注的方面和监管考量。虽然目前大多数获批的mRNA疫苗用于预防COVID-19,但WHO也指出此技术指南不仅适用于此类产品,也鼓励研发机构可根据各自的优点和风险对每种mRNA疫苗进行评估。在总体原则方面,考虑到mRNA疫苗及其生产工艺的新颖性,指南提醒申请人和生产企业须确保综合全面地考虑与影响产品质量相关的因素,以符合科学性要求及监管机构评估的需要。
WHO此次发布的指南文件主要针对脂质纳米颗粒(lipid nanoparticles,LNP)制剂递送的进行主动免疫的mRNA和自扩增mRNA(self-amplifying mRNA,sa-mRNA),也提出了适当情况下开发多价mRNA疫苗或改变某些病原体的现有疫苗株(例如流感病毒或SARSCoV-2病毒)的具体注意事项,而且除了常规研发注册考量之外,此指南也对在公共卫生紧急情况下对优先疫苗的快速开发提供了建议。该指南的发布对业界和监管都具有重要的指导意义,本文对该指南的技术要点进行了一些归纳,结合我国的实际情况对mRNA疫苗监管的关注点进行了探讨,并展望了未来相关指南体系的发展。
1 WHO关于mRNA疫苗的技术指南体系
考虑到mRNA疫苗相对新型的结构和生产模式[8],结合此次发布的WHO技术指南,应在评估mRNA疫苗的质量、安全和有效性时考虑如下方面:所有和特定病原体和疾病相关的免疫学信息(保护性和免疫致病性);目标抗原的选择及其编码序列的修饰;非编码序列的组成结构和功能(包括polyA尾结构和5cap结构);疫苗的处方及原辅料(包括LNP的构成组分);LNP的生产方法、毒理学和免疫原性;所引入新型辅料的生产方法和针对安全性的临床/非临床研究[如国家监管机构(national regulatory authorities,NRA)有要求,应提供药理学研究信息];疫苗的剂型和给药途径;LNP和疫苗产品的关键质量属性和控制,以及灭菌工艺。
目前mRNA疫苗在只改变目标抗原序列的情况下,被认为可以在同一个平台上进行生产。应分别思考每种疫苗产品的生产控制、非临床和临床开发,同时与NRA早期的沟通咨询也是确保在研疫苗得到有效开发的关键因素。对于组合疫苗和多价疫苗而言,前期同类产品的发展过程可以作为有益参考。
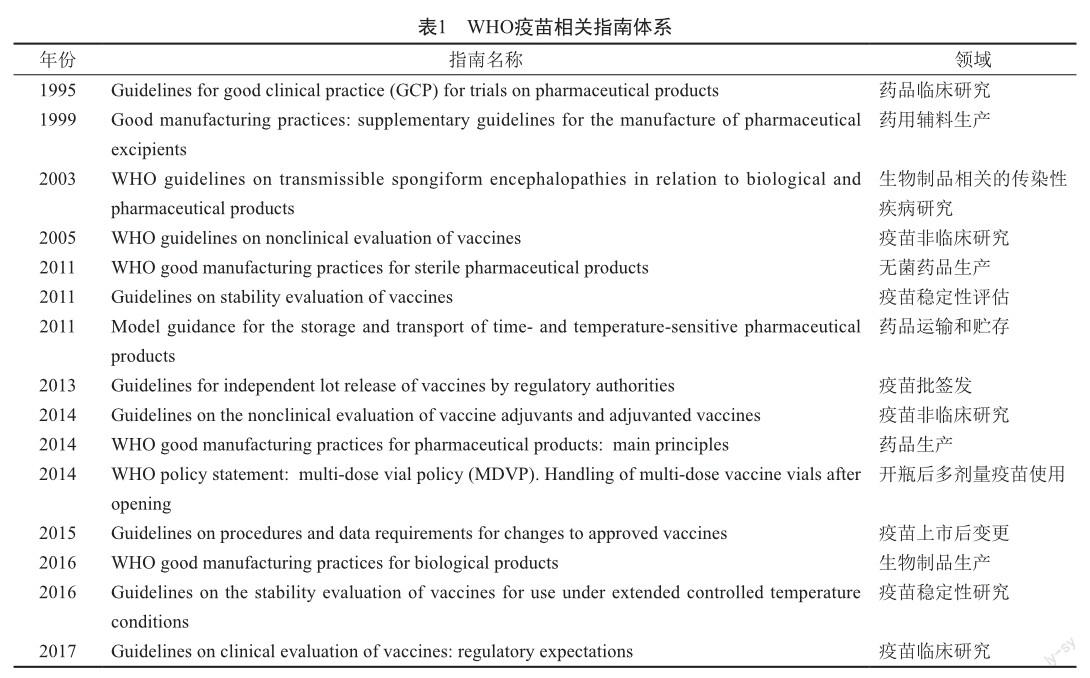
WHO曾发布过适用于疫苗的技术指南,范围包括疫苗非临床/临床研究、药品生产、药品运输和贮存、疫苗稳定性研究和疫苗上市后变更等多个方面。这组成了WHO的疫苗相关指南体系。此次发布的mRNA技术指南可以结合WHO其他相关指南进行综合参考(表1)[7]。
2 指南要点
相对于其他疫苗分支,mRNA疫苗具有开发速度快、生产时间短和有效性强等主要优势[9]。但開发mRNA疫苗须跨越相当高的技术门槛,除mRNA编码序列的修饰和优化、质粒DNA模板的制备、mRNA原液生产和LNP制备以外,mRNA疫苗的稳定性贮存和运输、疫苗剂量的选择也是须解决的技术问题[10]。根据WHO此次发布的技术指南内容,结合mRNA疫苗不同阶段的研发和生产特点,归纳出mRNA疫苗研发过程中应关注的重点问题(表2)。关注要点涵盖原液生产、LNP制备、对mRNA疫苗的非临床和临床评估等环节。
3 对我国mRNA疫苗产业的启示
针对包括mRNA疫苗在内的疫苗研发,我国已发布多项技术指导原则[11-15]。
此次发布的WHO技术指南对NRA在疫苗开发过程中的重要作用进行了相关阐述。指南建议疫苗开发机构在整个开发过程中针对药学研究和非临床审评等问题与NRA展开广泛讨论并得到批准,以保证疫苗开发的顺利开展,例如应针对生产和质量控制中可能影响mRNA疫苗质量、安全性和有效性的任何重大变更与NRA讨论并经其批准;如果已针对杂质的去除进行了完整的工艺验证并证明了生产连续性,则相关杂质残留水平的检测作为质量控制的一部分经NRA批准可以减少或停止;生产商应向NRA提供足够的数据证明产品在贮存、流通和使用条件下的稳定性;NRA可能会要求针对mRNA和LNP(或脂质成分)在机体组织内的分布、所分布的组织以及持续时间进行非临床研究,应寻求这些研究经NRA批准。
在现阶段国内企业纷纷开始布局mRNA疫苗研发和生产管线的背景下,此次发布的WHO技术指南对研发和生产过程的诸多关注要点进行了阐述,有利于mRNA疫苗在开发过程中的质量提升和质量可控,也将促进国内mRNA疫苗产业的有序和健康发展。
4 展望
此次发布的WHO技术指南针对mRNA疫苗的关键质量控制点如细胞库的建立、质粒DNA的质量控制、LNP脂质的质量标准、以及其他原辅料来源等进行了阐述,将和国内指南一道促进我国mRNA疫苗开发和生产的有序及质量可控,也有助于推动产品全球注册审评协调。该技术指南根据现有知识发展而形成,仍存在待进一步完善和细化的内容,例如当前适用范围仅限于采用LNP形式传递靶抗原编码序列至体内形成主动免疫的mRNA和sa-mRNA,而可复制因子、病毒载体和组装于病毒蛋白或转录自质粒DNA的RNA复制子不在该指南的适用范围内;用于治疗的mRNA和sa-mRNA产品、可以表达单克隆抗体的mRNA产品(被动免疫预防或治疗)同样不在该指南的适用范围内。此外还存在mRNA疫苗的生产和质量控制尚未标准化、一些关键质量属性的分析方法和标准尚未标准化、基于动物的分析方法不稳定且难以验证、mRNA疫苗产品新颖性等问题。现有指南偏原则性,尚缺乏具体细则。鉴于疫苗制造技术和临床试验的动态发展,mRNA疫苗是一个快速发展的领域。随着新的研发数据和成果涌现,相信各监管机构还会制定更多相关指南体系的细则来指导相关细分领域的研发和审评。
参考文献
[1] Martinon F, Krishnan S, Lenzen G, et al. Induction of virusspecific cytotoxic T lymphocytes in vivo by liposomeentrapped mRNA[J]. Eur J Immunol, 1993, 23(7): 1719-1722.
[2] Abid H, Haiyin Y, Mengjie Z, et al. mRNA vaccines for COVID-19 and diverse diseases[J]. J Control Release, 2022, 345: 212-215.
[3] Qin SG, Tang SH, Chen YT, et al. mRNA-based therapeutics: powerful and versatile tools to combat diseases[J]. Signal Transduct Target Ther, 2022, 7(1): 166.
[4] Gábor TS, Azita JM, Irena V. COVID-19 mRNA vaccines: platforms and current developments[J]. Mol Ther, 2022, 30(5): 1850-1868.
[5] Fang EY, Liu XH, Li M, et al. Advances in COVID-19 mRNA vaccine development[J]. Signal Transduct Target Ther, 2022, 7(1): 94.
[6] 刘芬, 李雪, 李香玉. 我国新冠疫苗研制生产的监管特点分析[J]. 中国药事, 2022, 36(1): 25-31.
[7] WHO. Evaluation of the quality, safety and efficacy of messenger RNA vaccines for the prevention of infectious diseases[EB/OL]. (2021-07-22)[2021-10-05]. https://www. who.int/publications/m/item/annex-3-mRNA-vaccines-trsno-1039.
[8] Barbier AJ, Jiang AY, Zhang P, et al. The clinical progress of mRNA vaccines and immunotherapies[J]. Nat Biotechnol, 2022, 40(6): 840-854.
[9] 胡瞬, 易有金, 胡涛, 等. mRNA疫苗的开发及临床研究进展[J]. 中国生物工程杂志, 2019, 39(11): 105-112.
[10] Grau S, Ferrández O, Martín-García E, et al. Reconstituted mRNA COVID-19 vaccines may maintain stability after continuous movement[J]. Clin Microbiol Infec, 2021, 27(11): 1698.e1-1698.e4.
[11] 國家药品监督管理局. 新型冠状病毒预防用mRNA疫苗药学研究技术指导原则(试行)[EB/OL].(2020-08-15)[2022-08-01]. https://view.officeapps. live.com/op/view.aspx?src=http%3A%2F%2Fwww. gov.cn%2Fxinwen%2F2020-08%2F15%2F5535069%2Ffiles%2F4c65eca1166c4af6b9fa4a8b3558fb6f. docx&wdOrigin=BROWSELINK.
[12] 国家药品监督管理局. 新型冠状病毒预防用疫苗研发技术指导原则(试行)[EB/OL]. (2020-08-15)[2022-08-01]. https://view.officeapps.live. com/op/view.aspx?src=http%3A%2F%2Fwww.gov. cn%2Fxinwen%2F2020-08%2F15%2F5535069% 2Ffiles%2Ff1bd59453bb94278a626078b35ecfe4c. docx&wdOrigin=BROWSELINK.
[13] 国家药品监督管理局. 新型冠状病毒预防用疫苗非临床有效性研究与评价技术要点(试行)[EB/OL].(2020-08-15)[2022-08-01]. https://view.officeapps. live.com/op/view.aspx?src=http%3A%2F%2Fwww. gov.cn%2Fxinwen%2F2020-08%2F15%2F5535069%2Ffiles%2F98df40b5c7af4175963e95aebe3b981f. docx&wdOrigin=BROWSELINK.
[14] 国家药品监督管理局. 新型冠状病毒预防用疫苗临床研究技术指导原则(试行)[EB/OL]. (2020-08-15)[2022-08-01]. https://view.officeapps.live. com/op/view.aspx?src=http%3A%2F%2Fwww.gov. cn%2Fxinwen%2F2020-08%2F15%2F5535069% 2Ffiles%2Fdbbd590ca01b4e26927c35b8f7c8adf7. docx&wdOrigin=BROWSELINK.
[15] 国家药品监督管理局. 新型冠状病毒预防用疫苗临床评价指导原则(试行)[EB/OL]. (2020-08-15)[2022-08-01]. https://view.officeapps.live. com/op/view.aspx?src=http%3A%2F%2Fwww.gov. cn%2Fxinwen%2F2020-08%2F15%2F5535069% 2Ffiles%2Fab2121f7c0844372b8b199ff8bd8aea1. docx&wdOrigin=BROWSELINK.
