血浆载脂蛋白E在甲状腺乳头状癌发生淋巴结转移中的作用
2023-07-10李超友赵如华霍蓉花吴靖芳
李超友,赵如华,霍蓉花,倪 涛,薛 刚,吴靖芳
0 引 言
甲状腺癌是头颈部和内分泌系统最常见的恶性肿瘤,死亡率虽然很低,但发病率和复发率在世界范围内不断增加[1-2]。分化型甲状腺癌 (differentiated thyroid carcinoma,DTC)的快速增长主要是由甲状腺乳头状癌(papillary thyroid carcinoma,PTC)所驱动[3-4]。大约27%~80%的PTC患者可发生区域淋巴结转移(lymph node metastasis,LNM),是局部复发的重要危险因素[5-6]。
载脂蛋白是多功能蛋白质,可作为脂蛋白组装的模板,还是血循环中主要脂质(胆固醇、甘油三酯和磷脂)的运输载体[7]。异常的脂质生物合成与恶性肿瘤细胞迁移、侵袭和诱导肿瘤血管生成有关[8]。载脂蛋白E(Apolipoprotein E,APOE)主要在肝中合成,并在大脑、脾、肾以及巨噬细胞和脂肪细胞中产生[9-10]。它由299个氨基酸组成,具有三个主要等位基因:APOE-ε2、APOE-ε3和 APOE-ε4[5]。APOE作为蛋白质和脂质的多功能复合物,主要参与脂质代谢和体内平衡,并通过调节细胞因子、生长因子的产生影响血管生成、肿瘤细胞生长和转移[11]。来自巨噬细胞的APOE是参与将脂质输送至肿瘤细胞以及坏死区域巨噬细胞对脂质再循环的主要成分[12]。研究表明,APOE的过度表达与结直肠癌、胶质母细胞瘤、胰腺癌和间变性甲状腺癌等恶性行为有关[10]。Luo等[12]认为非小细胞型肺癌患者APOE水平升高,与TNM分期、淋巴结转移、远处转移和不良预后相关,表明APOE可作为评估非小细胞肺癌进展有用的临床生物标志物。然而,APOE在PTC中的表达谱和功能尙不明确。APOE在PTC发生及进展中的表达谱和功能尙不明确。本研究旨在探讨APOE在PTC发生及淋巴结转移(LNM)中的作用。
1 资料与方法
1.1 研究对象回顾性分析2019年9月至2022年9月河北北方学院附属第一医院耳鼻咽喉头颈外科收治的161例接受甲状腺切除术(全切或部分切除)术后病理诊断为PTC患者(PTC组)的临床资料。其中男17例,女144例,年龄27~76岁,平均年龄(49.97±10.77)岁。31例结节性甲状腺肿患者为对照组,其中男3例,女28例,平均年龄(52.42±12.96)岁。根据术后病理结果将PTC患者分为LNM组(PTC伴淋巴结转移,n=51)和单纯PTC组(PTC不伴淋巴结转移,n=110)。LNM组中男3例,女48例,平均年龄(47.41±12.39)岁;单纯PTC组中男14例,女96例,平均年龄(51.15±9.76)岁。按照APOE中位数水平将PTC组分为:高水平组(>128.90 ng/L,n=80),低水平组(≤128.90 ng/L,n=81)。入选标准:①首次就诊;②经组织病理学诊断为PTC或结节性甲状腺肿;③均自愿接受甲状腺切除术(全切或部分切除)及淋巴结清扫术;④术前实验室相关检查、电子病历资料及术后病理结果无缺失;⑤癌症分期诊断符合美国癌症联合委员会(AJCC)甲状腺癌分期系统(第8版,2017年);⑥血浆标本保存完好,无溶血现象。排除标准:①既往甲状腺手术史;②既往服用降血脂药物;③既往接受抗甲状腺药物、L-甲状腺素替代或抑制治疗或任何可能引起甲状腺功能变化的药物(雌激素、雄激素、锂、糖皮质激素等);④临床或亚临床甲状腺功能减退症或甲状腺功能亢进症;⑤放射性碘治疗史或头颈部辐射暴露史;⑥其他组织病理学的THCA,如甲状腺髓样癌(MTC)或甲状腺未分化癌(ATC);⑦怀孕或哺乳妇女;⑧合并其他原发性或转移性恶性肿瘤。本研究已获得河北北方学院附属第一医院伦理委员会批准(批准号:W2022036),患者或家属均签署知情同意书。
1.2方法
1.2.1 临床资料收集详细记录所有研究对象的一般资料:包括年龄、性别等基线资料,采集入选患者术前晨起空腹肘静脉血,检测脂代谢相关指标:甘油三酯(TG)、总胆固醇(TCHO)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)、载脂蛋白A1(APOA1)、载脂蛋白B(APOB)、载脂蛋白a[LP(a)],术后组织病理报告包括原发肿瘤单双侧、多灶性(2个或2个以上肿瘤)、肿瘤最大径(cm)、转移淋巴结数目、临床分期。
1.2.2酶联免疫吸附测定(ELISA)用于检测对照组和PTC组患者血浆APOE蛋白浓度。使用商业ELISA试剂盒(Elabscience Biotechnology Co.,Ltd),严格按照试剂盒所附说明进行,10 min内使用全波长酶标仪(Multiskan SkyHigh,Thermo Fisher Scientific)在450 nm下测量APOE蛋白的吸光度值(A值)。以时间为横坐标,以A值为纵坐标,绘制APOE的标准曲线并计算其浓度水平。
1.2.3TIMER(Tumor Immune Estimation Resource)数据库分析APOE在甲状腺癌中的表达情况①TIMER数据库分析APOE表达水平:在TIMER数据库差异表达模块输入框中输入基因名称APOE,选择泛癌分析,获得AOPE基因在泛癌组织与癌旁正常组织中的差异表达情况;②TIMER数据库分析APOE基因与免疫细胞的相关性:通过TIMER数据库Gene模块获得APOE在甲状腺癌中的表达与免疫细胞浸润丰度的相关性,包括肿瘤纯度、B细胞、CD8+T淋巴细胞、CD4+T淋巴细胞、巨噬细胞、中性粒细胞、树突状细胞。

2 结 果
2.1 对照组和PTC组APOE及脂代谢指标比较PTC组APOE水平明显高于对照组(P<0.05),HDL-C、APOA1低于对照组(P<0.05)。见表1。
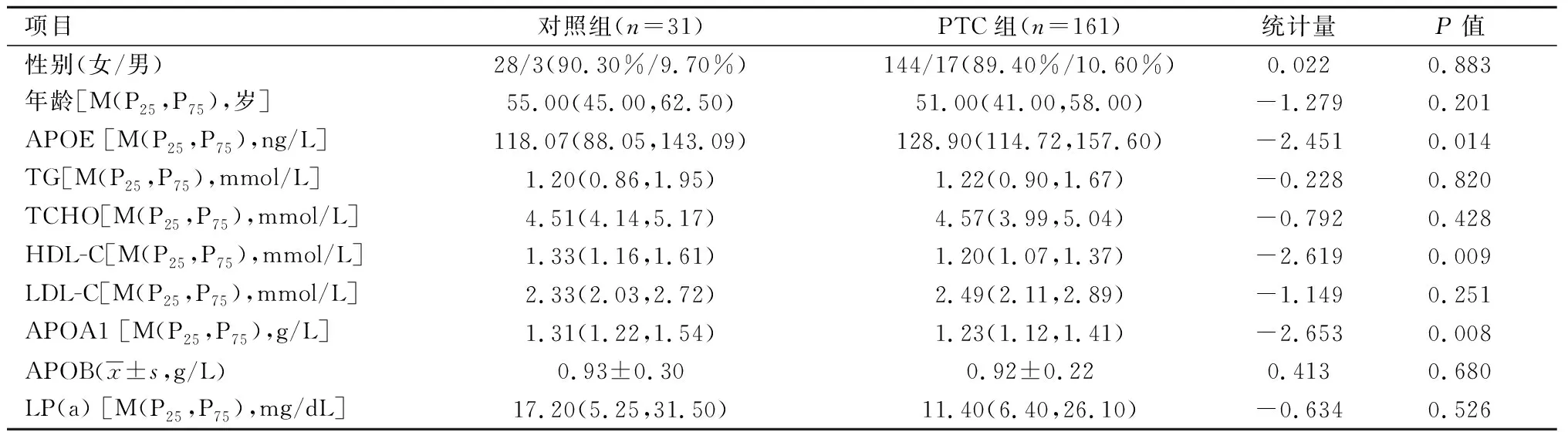
表 1 入组患者APOE及脂代谢指标的比较Table 1 Comparison of APOE and lipid metabolism indexes between PTC group and benign control group
2.2PTC发生的影响因素纳入APOE及脂代谢指标等构建多因素Logistic回归方程,结果发现:APOE是PTC发生的危险因素(P=0.022)。见表2。
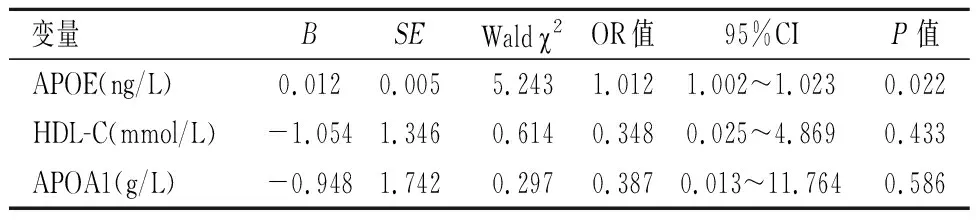
表 2 Logistic回归分析PTC发生的影响因素Table 2 Logistic regression analysis of factors affecting the occurrence of PTC
2.3血浆APOE预测PTC发生的价值APOE预测PTC发生的AUC为0.639,诊断临界值为109.99 ng/L,灵敏度为81.4%,特异度为48.4%,表明APOE具备作为预测PTC进展生物标志物的趋势,具有一定的临床指导意义。见图1。
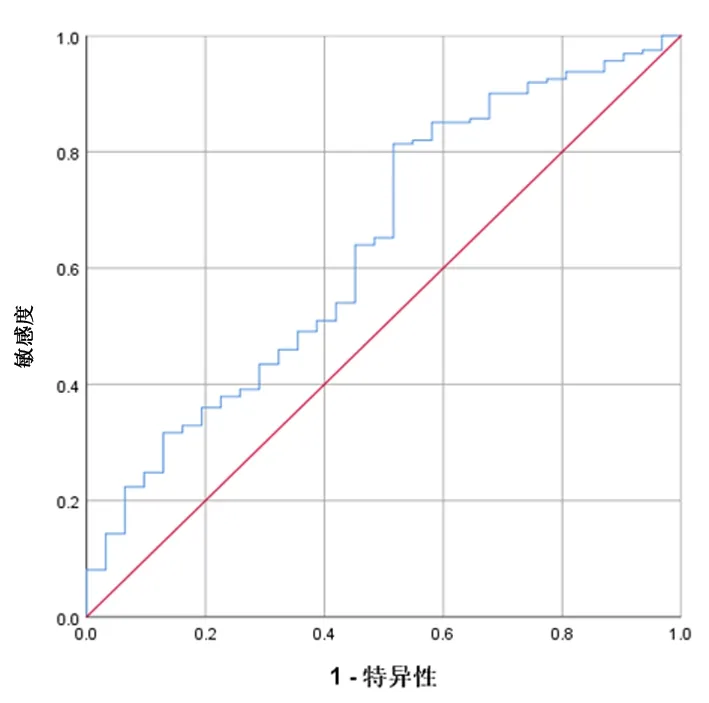
图 1 血浆APOE预测PTC发生的ROC曲线Figure 1 ROC curve of plasma APOE predicting PTC occurrence
2.4单纯PTC组和LNM组APOE及脂代谢指标比较两组年龄、APOE、LDL-C、APOA1、APOB、LP(a)差异有统计学意义(P<0.05),LNM组APOE水平明显高于单纯PTC组(P=0.022)。见表3。
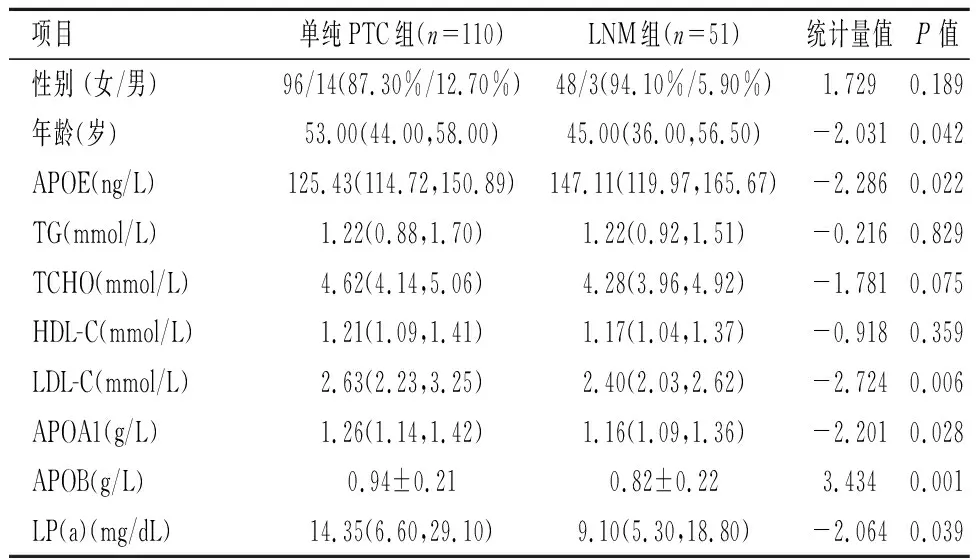
表 3 PTC患者LNM组和单纯PTC组APOE及脂代谢指标比较Table 3 Comparison of APOE and lipid metabolism indexes between LNM group and pure PTC group
2.5PTC发生淋巴结转移的影响因素Logistic多因素回归分析显示:APOE水平升高将增加PTC患者发生淋巴结转移的风险(P<0.05);年龄越小,PTC患者发生LNM的可能性越大(P<0.05);LP(a)对PTC发生LNM具有统计学意义(P<0.05)。见表4。
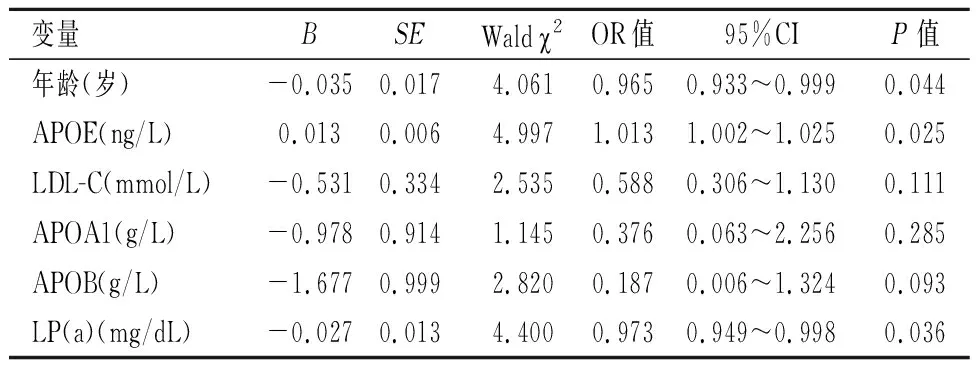
表 4 Logistic回归分析PTC发生LNM的影响因素Table 4 Logistic regression analysis of the influencing factors of LNM in PTC
2.6APOE低水平组与高水平组脂代谢指标和临床病理参数比较高水平组和低水平组之间淋巴结转移数目差异具有统计学意义(P=0.019)。见表5。
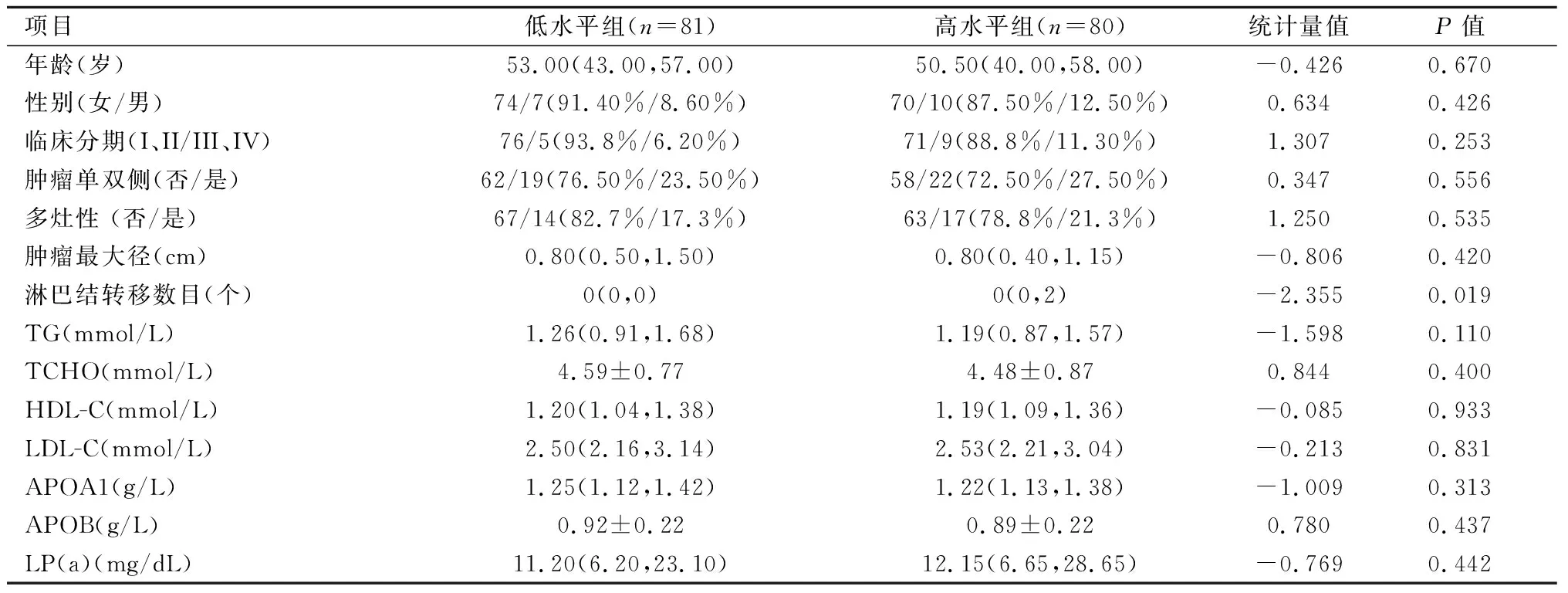
表 5 PTC患者血浆载脂蛋白E高水平组和低水平组相关指标比较Table 5 Comparison of relevant indicators between the high level group and low level group of APOE
2.7影响APOE水平的危险因素淋巴结转移数目为自变量,以APOE水平为因变量,多因素Logistic回归分析显示:淋巴结转移数目越多,APOE的水平越高(OR=1.286,95%CI:1.033~1.602,P<0.05),表明转移淋巴结数目是影响APOE水平的独立危险因素。
2.8TIMER数据库分析APOE在泛癌的表达及与THCA免疫细胞浸润的关系与癌旁正常组织相比,APOE在甲状腺癌(THCA)、乳腺浸润癌(BRCA)、胆管癌(CHOL)、食管癌(ESCA)、头颈部鳞癌(HNSC)、肝细胞癌(LIHC)、前列腺癌(PRAD)、胃腺癌(STAD)、结肠腺癌(COAD)、胰腺癌(PAAD)、嗜铬细胞瘤和副神经节瘤(PCPG)及子宫内膜癌(UCEC)癌症中高表达(P<0.01) ;在多形性胶质母细胞瘤(GBM)、肺鳞癌(LUSC)及皮肤黑色素瘤(SKCM)癌症中低表达(P<0.05),见图2;APOE在THCA中与B细胞(r=0.308)、中性粒细胞(r=0.243)、CD8+T细胞(r=0.089)、CD4+T细胞(r=0.098)、巨噬细胞(r=0.121)、树突状细胞(r=0.266)表达呈正相关,与肿瘤纯度呈负相关(r=-0.008),均具有统计学意义(P<0.05)。
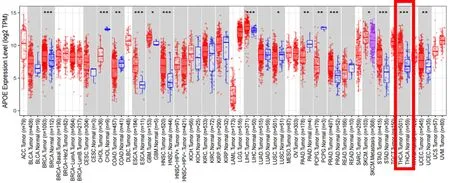
*P<0.05、**P<0.01、***P<0.001图 2 APOE在泛癌和癌旁正常组织中的差异性表达Figure 2 Differential expression of APOE in pan-carcer and adjacent normal tissues
3 讨 论
癌症与代谢紊乱密切相关,细胞内脂质积累与抑制脂质存储机制之间失衡是癌症的特征之一[13-14]。APOE作为一种重要的血浆脂蛋白,参与调节体循环的脂质稳态,并在肿瘤微环境中与炎性因子和抗癌T细胞相互作用诱导炎症性免疫应答,同时介导脂蛋白颗粒进入肿瘤细胞,影响抗凋亡信号、血小板聚集、免疫调节和细胞增殖[10,15]。Liu等[16]报道肺腺癌LNM患者APOE浓度升高。本研究发现PTC及LNM患者的血浆APOE升高增加了PTC发生风险和淋巴结转移的可能性。多因素Logistic回归分析显示,血浆APOE高表达可作为PTC及LNM的独立危险因素。血浆APOE与淋巴结转移数目明显相关,提示高水平血浆APOE增加LNM的风险,与晚期和高危PTC密切相关,符合APOE在其他恶性肿瘤的趋势性。我们猜想APOE的激活限制了固有免疫系统对癌细胞增殖的抑制,从而促进多种类型癌症的肿瘤细胞生长和转移[11]。
脂质代谢紊乱是许多癌症的共同特征和危险因素,包括THCA[17]。血脂异常尤其是TCHO和LDL-C在甲状腺疾病中很常见[18]。Revilla等[13]证实侵袭性恶性肿瘤患者的血清LDL-C和APOB明显降低。本研究脂代谢指标LDL-C、APOB和LP(a)在LNM组和单纯PTC组差异显著,且PTC淋巴结转移患者的LDL-C、APOB、LP(a)水平更低。Raisa等表示存在甲状腺结节的患者HDL-C水平更低[19]。本研究PTC组存在更低水平的HDL-C,并且与PTC的发生呈现出负相关趋势,根据Kim等[20]报道:HDL-C通过减少外周组织的氧化应激来抑制肿瘤发生密切相关,为HDL-C作为保护因素提供了证据。APOA1在PTC组以及LNM组与单纯PTC组表现出的差异性,且APOA1在PTC组及LNM组处于更低水平,与Ma等[17]报道血清APOA1与PTC患者负相关结果一致。
癌症的发生常伴随着肿瘤相关免疫细胞浸润。部分免疫细胞(髓样抑制性细胞、巨噬细胞、树突状细胞、肥大细胞、嗜酸性粒细胞、中性粒细胞和自然杀伤性细胞)有助于形成恶性表型的肿瘤间质[21]。肿瘤相关巨噬细胞(TAMs)广泛浸润于多种肿瘤间质,通过肿瘤免疫逃逸和血管生成,促进肿瘤生长及转移[22]。接触癌细胞的树突状细胞因抗原递呈能力受阻而导致T细胞激活失败[21]。王彰骄等[23]认为升高的树突状细胞与食管鳞状细胞癌进展密切相关,肿瘤免疫抑制微环境可能是导致树突状细胞功能障碍的重要原因。本研究通过TIMER数据库泛癌研究结果显示APOE不仅在THCA中高表达,还在BRCA、CHOL、ESCA、HNSC、LIHC、PRAD、STAD、COAD、PCPG及UCEC中高表达。甲状腺癌中的APOE表达水平与B细胞、中性粒细胞、CD8+T细胞、CD4+T细胞、巨噬细胞、树突状细胞的表达显著相关。可见APOE除执行脂代谢功能外,还具有重要的免疫调节功能[24]。所以推测甲状腺癌中高表达的APOE可能是通过某种信号传导通路介导免疫浸润细胞向促肿瘤表型转化,促进肿瘤免疫逃逸,导致肿瘤细胞恶性增殖及侵袭转移。
综上所述,高水平血浆APOE是预测PTC发生LNM的独立危险因素,具备作为评估PTC发生及进展的新型生物标志物的潜力。靶向APOE调节肿瘤免疫微环境、抑制肿瘤细胞转移在难治性THCA免疫治疗策略具有巨大的临床潜力。由于本研究样本数量少,存在一定的局限性,如未研究APOE具体表型对PTC及LNM的作用,APOE在PTC中的免疫机制有待进一步探究。
