腹部机会CT预测血液透析并发致死性心血管疾病的价值
2023-07-10秦美佳魏景洋佟靖雯孙宗泽
秦美佳,魏景洋,佟靖雯,孙宗泽,张 卓,梁 爽
(1.牡丹江医学院;2.牡丹江医学院附属第二医院,黑龙江 牡丹江 157011)
全球范围内慢性肾脏病(chronic kidney disease,CKD)的发病率不断增长,在世界范围内已成为非常重要的公共卫生问题[1]。CKD患者需要持续进行血液透析(hemodialysis,HD)以清除体内的代谢废物、维持电解质和酸碱平衡。但长期的HD治疗会导致的多种并发症,其中心血管疾病(cardiovascular disease,CVD)是HD患者的常见并发症,同时也是导致患者死亡的主要原因[2]。早期识别HD患者并发CVD死亡的危险因素,对改善患者预后,提高生存率尤为重要。机会CT作为一种机会性筛查手段,通过提取并分析已有CT图像中能够反映身体成分的影像学指标,为包括如CVD及骨质疏松症在内的多种疾病提供基于定量分析的风险预测[3]。该筛查手段基于HD患者常规CT平扫图像,避免了额外的检查,减少不必要的检查辐射,进一步提高平扫CT的扫描价值。本研究基于常规CT图像对腹部多种身体成分进行定量分析,探究致死性CVD发生的相关风险因素,以期为HD患者进行基于多指标分析的综合风险判断。
1 材料与方法
1.1 研究对象选择2018年6月至2019年10月间在牡丹江医学院附属第二医院、牡丹江医学院附属红旗医院肾内科和内分泌科接受HD治疗的患者,按照纳入及排除标准进行筛选。经3年随访,记录随访期间因CVD导致死亡的患者,将该类人群设为死亡组,生存人群设为生存组。随访期间资料缺失及其他原因死亡的对象被排除到实验之外。纳入标准:(1)患者年龄≥18 周岁;(2)患者透析时间≥3个月;(3)具有完整清晰的影像学资料、基线数据、临床病史资料;排除标准:(1)腹膜透析;(2)患者具有恶性肿瘤、器官移植、活动性感染病史、冠心病或心脏起搏器、心脏除颤器植入史;(3)目前出现胸痛、心悸等拟诊为CVD的症状。所有入选的研究对象均遵循知情同意原则、签署知情同意书,并获医学伦理学委员会批准。
1.2 方法
1.2.1 临床资料收集 调阅血液透析患者入院病案,获取包括性别、年龄、体重、身高、体重指数在内的基线指标及包括高血压肾病史、吸烟史、心血管病家族史、糖尿病史、骨质疏松症病在内的临床病史资料。
1.2.2 腹部机会CT筛查及观测指标提取 各研究中心均采用64排及以上CT配置机器进行进行扫描,共计应用研究CT设备3台。于血液透析患者随访开始前进行腹部CT平扫,在CT扫描前叙述检查过程并获得患者理解与配合,缓解患者情绪,患者取仰卧位,叮嘱患者深吸气后屏住呼吸配合检查。扫描范围自膈顶至双侧髂前上棘连线。管电压120 Kv,管电流200~275 mA,层厚5 mm,层距5 mm,螺距0.95,重建层厚0.625 mm,层距0.625 mm。
于PACS系统内调阅2018年6月至2019年10月期间血液透析人群的常规腹部CT平扫图像,进行各影像学定量观测指标的提取工作。
1.2.2.1 腹主动脉钙化积分 将腹部CT图像从图像存储与传输系统(PACS)导入Mask-RCNN算法软件,进行腹主动脉部位钙化成分的识别与分割,并应用Agaston半定量积分法计算L1-L4水平的腹主动脉钙化积分。
1.2.2.2 脂肪组织 将CT图像从PACS导入3D U-Net软件识别并分割患者腹部脂肪。参考平面设置为L1水平,3D U-Net系统基于全自动分割场景自动勾勒计算腹部内脏脂肪面积(visceral fat area,VFA)与皮下脂肪面积(Subcutaneous fat area,SFA),辅以手动调整以消除区域错误识别。同时计算VFA/SFA。
1.2.2.3 椎骨衰减值 基于PACS的基础功能,将最大的椭圆ROI放置在除去皮质骨的中央部分区域的椎体小梁骨以测量L1椎体的CT衰减值。
1.2.2.4 肌肉衰减值将CT图像从PACS中导入OsiriX软件(v7.5.1,Pix meo,Switzerland)以实现对腹部肌肉的自动识别与分割。参考平面设置为L3水平,测量该水平轴位CT图像中骨骼肌平均衰减值(muscle radiation attenuation,MRA)。
1.2.3 随访方法 进行为期3年的随访观察,经由电话、微信、QQ及会面等方式进行,每30天随访1次;根据随访结果记录发生致死性CVD(因心源性猝死、心肌梗死、心力衰竭和其他心血管因素导致的死亡)。排除因脑血管意外、感染、其他原因死亡和随访脱落的实验对象。
1.3 统计学方法采用SPSS 22.0软件进行统计分析。计量资料以“均数±标准差”表示,组间比较采用t检验;定性资料以频数或构成比描述,组间比较采用卡方检验,提取发生CVD的HD患者定量影像学数据与临床变量,应用COX进行回归分析,获得能够预测致死性CVD的风险因素,并报告相对危险度(RR)和95%置信区间(CI),P<0.05为差异有统计学意义。
2 结果
2.1 入组患者发病及生存情况分析在排除随访内容缺失及其他原因导致死亡的患者后,最终经随访发现96例HD患者3年内生存73例,3年内生存率为76.04%,因CVD导致死亡23例,死亡率为20.18%;其中11人死于心力衰竭,占总死亡人数的47.83%;8人死于心肌梗死,占总死亡人数的34.78%;4人死于心率失常,占总死亡人数的17.39%;平均存活时间为(25.17±5.94)月。
2.2 患者临床基本情况分析将3年随访中因CVD导致死亡的人群划分为死亡组,生存人群设为生存组,进行基线、临床病史的组间比较(表1),两组患者在性别、年龄、体重指数及临床病史方面均无差别 (P>0.05),两组具有可比性。
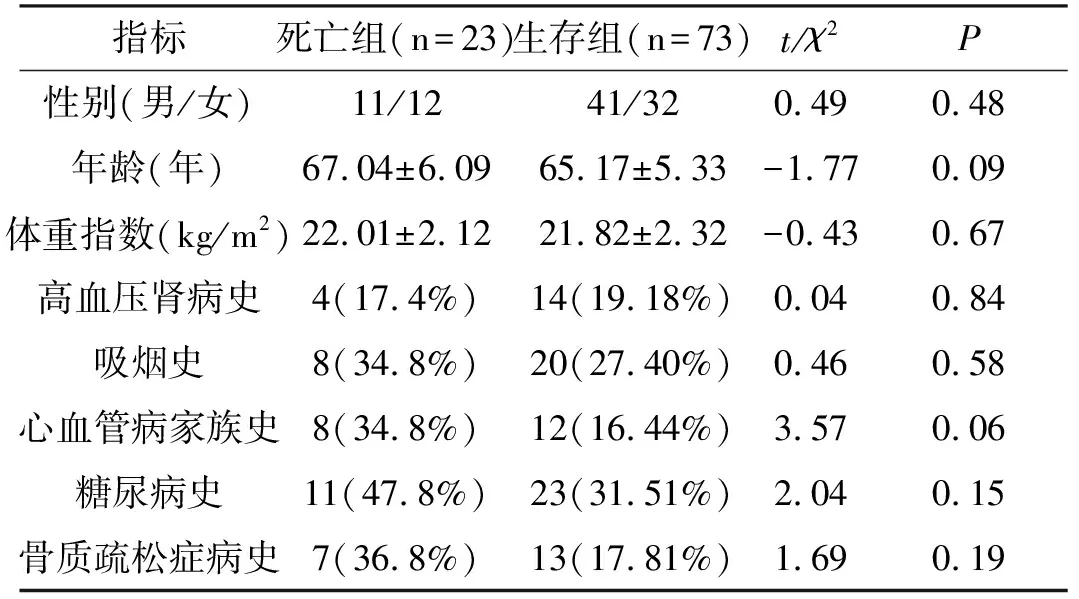
表1 两组患者临床基本情况分析表
2.3 HD患者致死性CVD影响因素的单因素分析与生存组相比,死亡组的透析时间、腹主动脉钙化积分、内脏脂肪组织面积、皮下脂肪组织面积较高,而L1椎体衰减值和骨骼肌平均衰减值明显低于生存组(P<0.05),见表2。

表2 HD患者致死性CVD影响因素的单因素分析
2.4 COX回归分析经COX回归分析(表3),结果显示吸烟史、糖尿病史、透析时间、腹主动脉钙化积分、内脏脂肪组织面积、L1椎骨衰减值是HD患者发生致死性CVD的重要预测因素(P<0.05)。

表3 对HD患者发生致死性CVD的各因素进行COX回归分析
3 讨论
CVD是导致HD人群死亡的主要原因之一,流行病学研究调查显示,约有45%接受HD治疗的患者死于心血管并发症,远高于健康人群[4]。目前临床多采取Framingham风险评分来预测个体未来发生CVD风险及制定相应干预措施。但该评分高估了国人CVD的发病风险[5]。机会性CT能够进一步挖掘影像学图像的价值,为多种疾病提供基于定量分析的风险预测。尤其对于需要进行HD治疗的患者而言,腹部CT图像更容易获取,可以通过分析HD患者腹部常规CT检查的各项身体成分进而预测CVD的发生风险[6]。
本研究在排除性别、年龄等多项因素干扰后,经单因素分析发现死亡组患者透析时间、腹主动脉钙化积分高于生存组。长期透析将不可避免的造成体内同型半胱氨酸、终末期糖基化代谢产物等毒素聚集,影响HD患者健康状态[7]。同时长期的HD治疗加重了对血管内皮细胞的损伤,促使血管平滑肌细胞向炎症介质转化,加重了动脉钙化斑块的形成。研究表明内脏脂肪同样参与动脉粥样硬化改变[8],本研究死亡组人群的VFA、SFA均高于生存组,长期HD治疗与过量的脂肪组织共同参与血管钙化进程进而增加致死性CVD的发生几率。HD在清除毒素同时导致氨基酸、蛋白质等营养物质的丢失及钙磷代谢紊乱,造成骨骼及肌肉组织的过度消耗。本研究死亡组L1椎体和肌肉衰减值均小于生存组,提示相较于生存组,死亡组人群的营养状态较差,更易导致不良结局的发生。
经COX回归分析后,发现吸烟史、糖尿病史、透析时间、腹主动脉钙化积分、内脏脂肪组织面积、L1椎骨衰减值可作为糖尿病患者动脉粥样硬化性心血管疾病的预测因素。吸烟及糖尿病与多种并发症相关,被普遍认为是HD患者并发CVD的经典影响因素[9],其通过引发异常的炎症反应及氧化应激介质加重了内皮功能障碍,共同参与CVD的发生发展,最终导致死亡结局。随着透析时间的延长,HD患者各项身体成分均可发生比较显著的变化。腹主动脉作为人体重要的大动脉,其钙化程度是提示血管钙化的重要标志[10]。钙化的腹主动脉顺应性下降,引起心脏后负荷增加、脉压增大、冠脉灌注下降等血流动力学改变,进一步加剧了CVD的发生概率。除此之外,研究发现腹主动脉钙化与冠脉钙化明显相关[11]。严重钙化的冠状动脉心脏供血量下降,最终将导致心率失常,心肌梗死等不良结局,严重威胁患者预后。肥胖与HD患者预后相关,Takayuki等[12]的研究发现,心血管疾病及其相关死亡率不仅受体脂总量的影响,同样受体脂区域分布的影响,基于CT测量的VFA是HD患者心血管死亡的危险因素。VFA通过参与左室射血分数、左心房直径等心脏功能结构变化进而影响CVD的发生,并且VFA在预测CVD死亡结局方面效果优于冠状动脉钙化评分[13]。陈宝宏等[14]将VFA≥73.6 cm2作为预测HD患者CVD死亡的阈值,此基础上VFA每增加1 cm2,死亡的风险上升3.023倍。在关于机会性CT的诸多研究中,L1椎体衰减值通常被用来预测未来骨质疏松的发生,本研究结果显示L1椎体衰减值是HD患者发生致死性CVD的影响因素,但目前尚未有研究证实两者间的关系。Peter等[15]分析了包括L1衰减值在内的多项影像学指标的纵向改变,但结果显示椎体衰减值的纵向变化尚并不能作为HD患者患CVD死亡的显著预测因素。HD患者体内矿物质骨代谢失调,其中高钙、高磷水平和异常水平的甲状旁腺激素与HD患者死亡率的增加有关,这种钙磷异常代谢状态可能在一定程度上解释了L1椎体衰减值与HD患者预后的关系。
基于腹部CT的身体成分机会性筛查有助于CVD的客观评估和风险分层。目前人工智能的全自动测量已开始逐渐取代手动测量方法,这使得临床大规模筛查成为可能。如Perry等[16]与Stacy等[17]利用半自动及全自动量化计算腹主动脉钙化积分,且在判断HD患者预后面效果优于临床应用的Framingham风险评分。随着自动化技术的发展,将进一步缩短临床风险评估时间,提高临床应用的价值。
本研究具有以下几点局限性,首先,本研究样本量过小,需要进一步扩大研究人群。其次,随访时间过短,本研究的随访时间为3年,部分HD患者可能需要长期观察以确定最终结局,尤其是对于并发症较少的年轻患者。最后,本研究未使用定量CT测量L1及肌肉的衰减值,对各组织成分密度的评估可能与真实值存在一定差异。
综上所述,HD患者发生致死性CVD受多种因素影响,其中基于机会CT的多项影像学指标,如腹主动脉钙化积分、内脏脂肪组织面积、L1椎体衰减值是发生致死性CVD的重要预测因素。
