齐墩果酸对小鼠肠道免疫功能损伤的修复作用
2023-07-10白瀚哲代雨鑫
白瀚哲,王 丹,倪 蕾,代雨鑫,王 畅,商 宇,杨 玉
(佳木斯大学 1.基础医学院微生态-免疫调节网络与相关疾病重点实验室;2.临床医学院;3.附属第一医院血液内科,黑龙江 佳木斯 154000)
肠道免疫系统是人体最大的免疫系统,具有重要的屏障功能。肠道免疫系统的功能损伤会导致继发的细菌移位。移位的细菌可侵入外周血和远隔器官,形成细菌易位,诱发全身性炎症反应、脓毒症和多器官功能障碍综合征[1]。很多因素与疾病会损伤肠道免疫屏障,如炎症性肠病、糖尿病、帕金森病及某些药物如质子泵抑制剂与环磷酰胺等化疗药[2-3]。齐墩果酸(Oleanolic acid,OA)是一种天然的五环三萜类化合物。OA存在于多种植物中,例如女贞子、青叶胆、人参、木瓜等[4]。OA有丰富的生物活性,对很多疾病都具有预防和治疗作用,例如溃疡性结肠炎、多发性硬化症、糖尿病、肝炎及某些癌症[5]。除此之外,OA还具有免疫调节作用。研究表明:OA可以促进淋巴细胞的增殖,增强动物巨噬细胞的吞噬功能。临床研究证实OA可以在一定程度上提高肿瘤患者T淋巴细胞与巨噬细胞的功能[6]。在本研究中,探索了OA对环磷酰胺诱导的肠道免疫缺陷小鼠肠道淋巴细胞亚群与分泌型免疫球蛋白A(secretary immunoglobulin A,sIgA)的合成等免疫指标的影响,并初步证实OA对肠道免疫系统的保护作用。
1 材料与方法
1.1 药品、试剂与仪器设备OA(粉末、纯度HPLC≥98%、货号IO0020)与环磷酰胺(粉末、纯度HPLC≥98%、货号IC3220)均购于北京索莱宝科技有限公司。IgA检测试剂盒购置于武汉云克隆科技股份有限公司。抗体、染色缓冲液与流式缓冲液均购置于杭州联科生物技术股份有限公司。实验主要仪器设备是BD FACS AriaTMCell Sorter流式细胞仪(碧迪医疗器械(上海)有限公司)。
1.2 动物分组与造模SPF级昆明小鼠(合格证号230781211100005414)购置于哈尔滨珍宝制药有限公司,并通过佳木斯大学生物与医学伦理委员会审查。适应性饲养至8周龄,通过随机数字表法将小鼠随机分为正常组、模型组、OA低剂量组[5 mg/(kg·d)]与OA高剂量组[25 mg/(kg·d)],每组8只,均为雌性。模型组与OA各剂量组连续5 d、1次/d腹腔注射环磷酰胺(80 mg/kg),正常组腹腔注射相应体积生理盐水[7]。OA低剂量组[5 mg/(kg·d)]、OA高剂量组[25 mg/(kg·d)]在实验第6天起,1次/d灌胃给予相应剂量的OA(2% Tween 80混悬),正常组与模型组给予相应体积2% Tween 80,连续给药28 d。
1.3 免疫器官指数测定在实验的第34天,将小鼠称重后分别放入干净可透视观察的密闭盒(有通气孔上盖),以每分钟替代箱容积的20%灌注二氧化碳于箱内,实施二氧化碳安乐死。确定动物死亡后摘除胸腺和脾脏,剥离周围的筋膜及组织,并用滤纸吸干血液。计算胸腺指数与脾脏指数,计算公式:免疫器官指数=胸腺(或脾脏)的重量(g)/体重(kg)。
1.4 肠系膜淋巴结T淋巴细胞亚群测定小鼠安乐死后,充分暴露小鼠腹腔,沿肠系膜上溯找到被脂肪组织包裹的肠系膜淋巴结。分离肠系膜淋巴结,置其于200目滤网,以圆底玻璃试管轻轻按压,将其分离为单细胞,并重悬于RPMI1640培养液中。PBS清洗细胞,调整细胞数量为1×106个并重悬于染色缓冲液。加入抗体Anti-Mouse CD3ε-PerCP-Cy5.5(1/20)、Anti-Mouse CD4-APC(1/20)与Anti-Mouse CD8α-FITC(1/20),室温避光孵育25 min。流式缓冲液清洗细胞后,将细胞用4%多聚甲醛溶液固定。次日,流式细胞仪上机检测细胞,FlowJo X软件(版本10.0.7r2)分析流式结果。
1.5 肠黏膜sIgA含量测定分离肠系膜淋巴结的同时,沿盲肠上溯并取3 cm回肠。清除肠道内容物后,用预冷的1 mL生理盐水充分灌洗肠腔。收集生理盐水于EP管,离心,取100 μL上清液用于ELISA分析。ELISA实验的简要步骤如下:制备ELISA检测标准品,并倍比稀释为500 pg/mL、250 pg/mL、125 pg/mL、62.5 pg/mL、31.2 pg/mL、15.6 pg/mL与7.8 pg/mL。实验设标准孔、样品孔与空白孔,分别加入标准品、各组样品与标准品稀释液。按照说明书要求,依次完成温育、加工作液A并温育、洗涤、加工作液B并温育、洗涤、加TMB底物并避光显色、终止反应及酶标仪检测等步骤。
1.6 统计学分析用GraphPad Prism 5软件(版本5.01)完成统计分析与绘图,计量资料以“均数±标准差”表示。胸腺指数等实验数据均采用单因素方差分析法分析整体差异的显著性,并通过多重比较检验各组间差异的显著性,以P<0.05为比较具有统计学意义。
2 结果
2.1 OA对小鼠胸腺指数与脾脏指数的影响模型组动物的胸腺指数与脾脏指数显著低于正常组动物,OA各剂量组动物的胸腺指数与脾脏指数均高于模型组动物,结果详见表1。
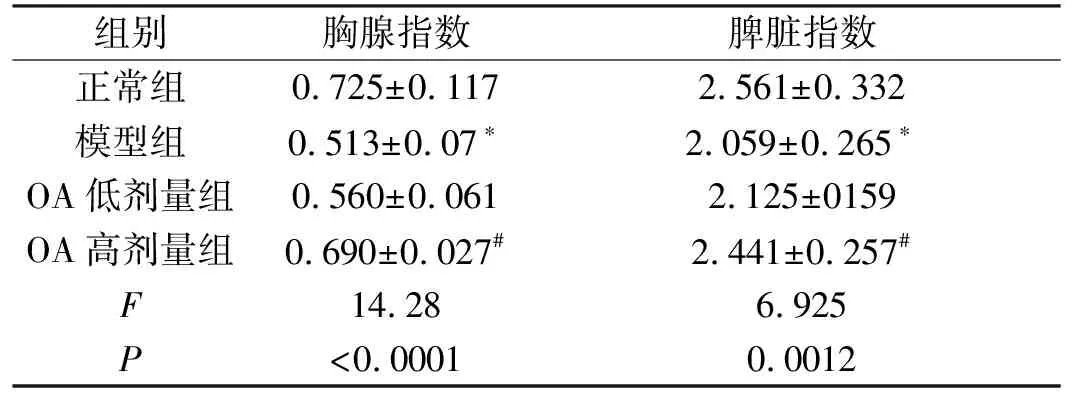
表1 各组动物免疫器官指数的比较
2.2 对肠道T细胞亚群缺陷的影响模型组动物肠系膜淋巴结中CD3+CD4+T淋巴细胞占全部淋巴细胞的百分比显著低于正常组,而OA高剂量组动物CD3+CD4+T淋巴细胞占全部淋巴细胞的百分比显著高于模型组动物,结果如图1与表2所示。与CD3+CD4+T淋巴细胞的结果相似,模型组动物肠系膜淋巴结中CD3+CD8+T淋巴细胞占全部淋巴细胞的百分比显著低于正常组的百分比,而OA低、高剂量组动物的CD3+CD8+T淋巴细胞占全部淋巴细胞的百分比均显著高于模型组动物,结果如图2与表3所示。

表2 各组动物肠系膜淋巴结CD3+CD4+T淋巴细胞的百分比

图1 各组动物肠系膜淋巴结CD3+CD4+T淋巴细胞亚群的流式细胞术分析结果
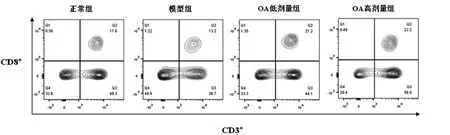
图2 各组动物肠系膜淋巴结CD3+CD8+T淋巴细胞亚群的流式细胞术分析结果

表3 各组动物肠系膜淋巴结CD3+CD8+T淋巴细胞的百分比
2.3 OA可促进肠道sIgA的生成模型组动物肠黏膜sIgA的含量与正常组动物sIgA的含量相比明显下降,而OA高剂量组的动物其肠黏膜sIgA的含量明显高于模型组动物sIgA的含量,说明OA能够促进肠道sIgA的生成,如表4所示。

表4 各组动物肠黏膜sIgA含量的比较
3 讨论
肠道作为消化和吸收营养物质的主要场所,一方面将肠道致病菌与机体内环境隔离开来,另一方面又为数量巨大的肠道益生菌提供定殖的空间。肠道免疫系统的稳定与平衡对于维持肠道内环境的健康至关重要[8]。肠道免疫系统的缺陷会导致各种疾病,如炎症性肠病(克罗恩病、溃疡性结肠炎等)与肠道感染性疾病(抗生素相关腹泻、艰难梭菌相关腹泻和幽门螺杆菌感染等)[8-9]。引起肠道免疫系统缺陷的因素很多,其中包括作为癌症常规治疗手段的化疗。因此,在本研究中以化疗药环磷酰胺构建免疫缺陷动物模型,并基于此模型探讨OA对肠道免疫系统的调节作用。
OA具有多种生物学活性,是天然产物研究的热点分子,目前临床上主要用于急慢性肝炎的辅助治疗。在本次研究中,根据OA对动物免疫器官指数的影响评估造模效果并初步评判OA对小鼠免疫功能的调控作用。实验结果表明,高剂量的OA能够改善免疫缺陷小鼠的免疫器官指数,提示OA在整体上具有免疫促进作用。肠系膜淋巴结及肠道相关淋巴组织是肠道免疫系统的诱导位点,肠道黏膜内的免疫反应在此起始。淋巴细胞在肠系膜淋巴结经历抗原识别、增殖分化,形成效应性淋巴细胞,并迁移至黏膜固有层与黏膜上皮表面。因此,肠系膜淋巴结一方面是机体抵御肠道病原体感染的第一道防线,也是宿主与外环境间黏膜稳态建立和维持的关键节点[10]。本研究中环磷酰胺导致模型组小鼠肠系膜淋巴结中CD3+CD4+T细胞的数量占比下降至32.15%,而CD3+CD8+T细胞的数量占比下降至13.68%,均显著低于正常组动物(P<0.05)。高剂量的OA能够使小鼠肠系膜淋巴结中CD3+CD4+T与CD3+CD8+T细胞的数量占比分别增加至42.7%与18.33%,表明小鼠肠道的免疫功能抑制有所恢复。sIgA是肠道最主要的抗体,其合成后被分泌于肠黏膜表面发挥抗菌作用[11]。尽管派氏集合淋巴结是sIgA的主要诱导位点,但是肠系膜淋巴结同样通过其微环境中淋巴细胞分泌的IL-6、IL-10、IL-4、IL-5等细胞因子对sIgA的合成发挥重要的促进作用[12]。肠系膜淋巴结负责空肠、回肠、盲肠和升结肠区域的引流[10]。本研究中观察了OA对小鼠回肠黏膜表面sIgA合成分泌的影响,结果表明OA能够明显增加免疫缺陷小鼠肠黏膜表面sIgA的含量。
综上所述,本研究中发现OA对免疫缺陷动物的肠道免疫功能抑制具有修复作用,OA是具有潜在转化价值的肠道免疫调节剂,有望用于化疗后肠道副作用等疾病的预防与治疗。本研究从免疫器官与免疫细胞层次探讨了OA的药理作用,但是没有在分子层面阐述其机制,将在今后的研究中予以进一步探索与阐明。
