子宫颈鳞状细胞癌中超保守核糖核酸339的表达及其临床病理意义
2023-07-10陆红梅
仇 姝, 陆红梅, 周 洁
(扬州大学附属医院扬州市妇幼保健院, 1. 妇产科, 2. 病理科, 江苏 扬州, 225000;3. 扬州大学附属医院 病理科, 江苏 扬州, 225000)
子宫颈癌(CC)是妇科最常见的癌症类型[1]。CC的致病因素包括多次宫颈损伤、人类乳头状瘤病毒持续感染和细菌感染等[2]。CC病理类型包括鳞状细胞癌(CSCC)和腺癌,其中CSCC最为常见。CC细胞的侵袭、转移、复发和耐药是CC常见的不良预后因素,最终导致CC患者死亡。超保守RNA(UCR)是一类长度超过200个碱基对(bp)的基因组序列家族,在人类、小鼠和大鼠基因组的同源区基因之间具有完全的一致性[3]。UCR具有转录活性,因此被命名为转录UCR(T-UCR)[4], 大多数T-UCR并不翻译成蛋白质,只是通过RNA的形式发挥生物学活性。研究[5-6]表明UCR参与了人类恶性肿瘤的发生发展过程,但UCR在CSCC中的作用仍知之甚少。本课题组前期研究[7]发现,在肾癌中超保守RNA339(uc.339)呈高表达,并与临床特征具有相关性,预实验也提示在CSCC中uc.339表达水平升高。本研究探讨uc.339在CSCC中的表达及其临床病理意义,探讨uc.339对CC细胞增殖的影响,现报告如下。
1 资料与方法
1.1 一般资料
选取2020年1月—2022年6月扬州大学附属医院和扬州市妇幼保健院妇产科手术切除的102例CSCC及癌旁正常宫颈组织标本,新鲜标本组织采集后放入液氮罐里储存。CSCC诊断由病理科医师负责。患者年龄39~70岁,平均年龄54.92岁。纳入标准: ① 诊断为CSCC者,分期根据国际妇产科联盟(FIGO)2018年标准作为参考; ② 未合并其他原发性肿瘤者; ③ 术前未进行放射治疗和药物化疗者; ④ 患者签署知情同意书; ⑤ 患者临床资料完整。排除标准: ① 病历资料缺失者; ② 不能配合或中途退出患者; ③ 术前接受放疗和药物化疗者。
1.2 细胞和质粒
CC细胞株C33A细胞购自中国科学院上海生科院细胞资源中心。CC细胞孵育在含10%胎牛血清的DMEM培养基(HyClone公司)中,培养基中添加双抗青霉素/链霉素(Invitrogen公司)。将CC细胞放置在37 ℃、5%CO2的细胞培养箱中培养。uc.339-mimic及Scramble对照、si-uc.339和si-NC对照均购自苏州GenePharma有限公司。使用Lipofectamine 2000试剂(Invitrogen公司)将uc.339模拟物或抑制物等转染到C33A细胞中,实验分组包括uc.339过表达组及Scramble对照组、降低uc.339表达组和si-对照组。
1.3 实时荧光定量聚合酶链反应
根据试剂说明书使用Trizol从CSCC冷冻组织中提取总RNA(Invitrogen), 总RNA通过Nanodrop 2000(Invitrogen)定量。cDNA使用miScript逆转录(RT)试剂盒生成(Qiagen GmbH,德国)。使用miScript SYBR进行实时荧光定量聚合酶链反应(qRT-PCR),U6小核糖核酸被用作内参。对于mRNA研究, cDNA使用FastKing RT Kit(北京天根公司)获得,然后使用Green qPCR Master Mix(Bimake,美国)进行qRT-PCR,GAPDH被用作mRNA内参。相关引物序列见表1。所有PCR反应在Applied Biosystems 7500 PCR仪器上进行qRT-PCR实验。反应条件: 预变性95 ℃下30 s, 然后95 ℃下5 s至60 ℃下45 s, 共计40个聚合酶链反应(PCR)扩增循环,所得实验数据均与内参对比后再进行统计学分析。

表1 相关引物序列
1.4 细胞克隆形成实验
转染后,取实验组和对照组处于对数生长期的CC细胞,胰酶消化充分吹打制备单细胞悬液,按每孔1×103细胞密度均匀铺于6孔板上,置于37 ℃、50 mL/L的CO2培养箱中培养7~14 d, 观察细胞生长情况。待肉眼可见克隆时,终止培养。使用4%多聚甲醛固定克隆细胞30 min; 采用0.1%结晶紫在室温下染色20~30 min,洗去染色液,干燥后进行拍照、计数,观察细胞生长和克隆能力。
1.5 MTT检测细胞增殖
CC细胞(3×105个/mL)接种于96孔板(100 μL/孔)后培养24、48、72 h时,分别加入MTT溶液20 μL与DMSO溶液150 μL, 低速振荡10 min, 采用酶标仪检测各孔光密度(OD)值。
1.6 生物信息学预测和双荧光素酶报告基因检测
通过miRGen、Targetscan以及https://blast.ncbi.nlm.nih.gov/Blast对uc.339的下游靶基因微小RNA(miRNA)进行预测。分别构建野生型(WT-uc.339)与突变型(MUT-uc.339)荧光素酶报告载体, WT-uc.339、MUT-uc.339分别与miR-339-5P mimics、miR-NC共转染后检测双荧光素酶的活性。双荧光素酶报告实验的主要步骤: 将样本和双荧光素酶报告试剂盒置于室温中,每孔加入100 μL萤火虫荧光素酶检测试剂,迅速加入20 μL样本,混匀后酶标仪读数,空白对照组为细胞裂解液对照; 每孔中再加入100 μL海肾荧光素酶试剂,混匀后读数。比值计算: 海肾荧光素酶测定值除以萤火虫荧光素酶测定值。
1.7 统计学分析

2 结 果
2.1 CSCC组织中uc.339的表达情况
102例CSCC组织中, qRT-PCR检测结果显示, uc.339在癌组织中表达水平为(5.79±1.86), 高于癌旁正常宫颈组织的(1.72±1.36), 差异有统计学意义(t=12.410,P<0.05)。见图1。
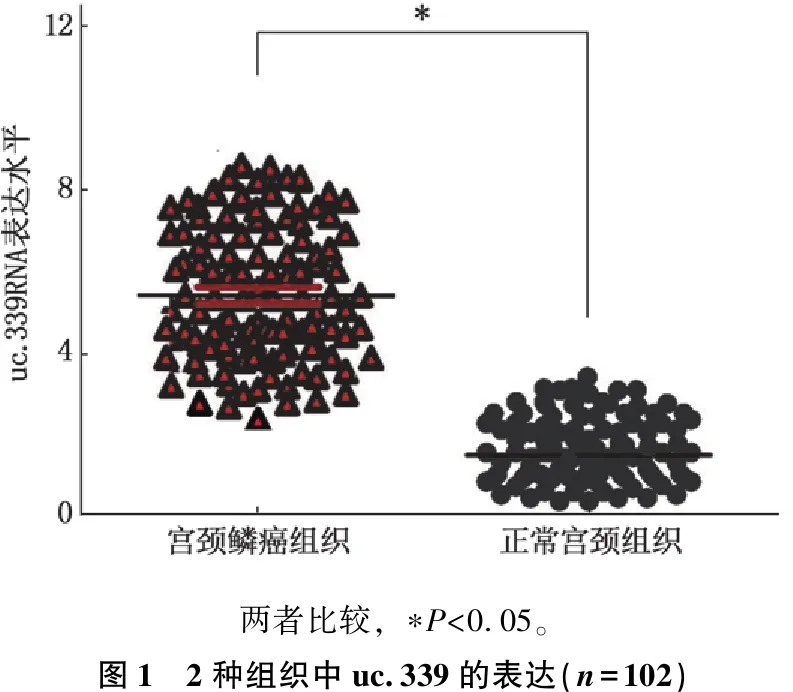
两者比较, ∗P<0.05。图1 2种组织中uc.339的表达(n=102)
2.2 uc.339的RNA表达水平与CSCC临床特征的关系
根据uc.339表达水平将CSCC病例分为高表达组82例(表达量高于正常宫颈组织)和正常或低表达组20例(表达量等于或低于正常宫颈组织)。分析显示uc.339的表达与宫颈鳞癌的肿瘤大小(Pearson′sR=7.909)和病理分级(Pearson′sR=-4.859)密切相关(P<0.05), 而与患者年龄、HPV感染、淋巴结转移和TNM分期无相关性(P>0.05), 见表2。

表2 宫颈鳞癌组织中uc.339的表达及其病理意义
2.3 uc.339对CC细胞增殖和生长的影响
MTT实验表明, uc.339过表达组72 h时的OD450 nm值为(0.93±0.05), 高于Scramble对照组的(0.64±0.04), 而降低uc.339表达组72 h时的OD450 nm值为(0.35±0.02), 低于si-对照组的(0.69±0.03), 差异均有统计学意义(P<0.05)。细胞克隆形成实验显示,uc.339过表达组的细胞克隆数目多于Scramble对照组,而降低uc.339表达组的细胞克隆数目少于si-对照组,差异有统计学意义(P<0.05)。见图2。
2.4 uc.339下游microRNA的预测及验证
通过生物信息学预测[8]uc.339的下游miRNA, 包括miR-95-5P、miR-663b和miR-339-5P。通过qRT-PCR实验,在C33A细胞中改变uc.339的表达后仅有miR-339-5P随之变化,即过表达uc.339后, miR-339-5P的表达水平下降; 降低uc.339表达后, miR-339-5P的表达水平升高,提示miR-339-5P是uc.339的下游靶基因。见图3。进一步结合双荧光素酶报告实验发现, uc.339基因序列中含有与miR-339-5P互补的核苷酸序列; miR-339-5P过表达可降低WT-uc.339的荧光素酶活性,差异有统计学意义(P<0.05),而对MUT-uc.339的荧光素酶活性无显著影响(P>0.05), 提示miR-339-5P与uc.339的结合是特异性的, miR-339-5P是uc.339的直接下游靶基因。见图4、表3。在102例标本中,通过qRT-PCR实验得出miR-339-5P在CSCC中的表达水平为(0.75±0.11), 低于癌旁正常组织的(2.81±0.48), 差异有统计学意义(P<0.05)。

A: 细胞克隆形成图; B: uc.339过表达组与Scramble组、降低uc.339表达组与si-对照组的克隆形成数目比较(2组比较, ∗P<0.05)。图2 细胞克隆形成实验

图4 uc.339与miR-339-5P的靶向结合示意图
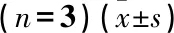
表3 双荧光素酶报告实验结果
2.5 回复实验验证uc.339/miR-339-5P对增殖影响
改变uc.339和miR-339-5P表达后,观察对增殖的影响。实验分为6组,即过表达uc.339组(1组),敲低uc.339表达组(2组),过表达uc.339组+过表达miR-339-5P组(3组),敲低uc.339表达组+敲低miR-339-5P表达组(4组),过表达uc.339组+敲低miR-339-5P表达组(5组),以及敲低uc.339表达组+过表达miR-339-5P组(6组); 另设立对照组(NC组,未转染任何质粒)。结果显示,上述各组中miR-339-5P的表达是随着uc.339和miR-339-5P的表达改变而改变。MTT实验证实,过表达miR-339-5P可以抑制uc.339对CC细胞增殖的促进作用,而降低miR-339-5P的表达可进一步激发CC细胞的增殖能力,促进CC细胞的生长。见图5、表4。

与NC组比较, ∗P<0.05。图5 各组miR-339-5P的表达
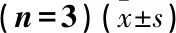
表4 回复实验对CC细胞增殖活性(OD值)的影响
3 讨 论
CC细胞来源于宫颈移行带交界处的鳞状细胞及宫颈管内的柱状细胞[1]。近年来,随着中国宫颈细胞学涂片早癌筛查的普及,CC及其癌前病变能被早期发现和诊疗,这也使得CC的发病率和病死率出现显著下降趋势[9]。在非编码RNA中,有一类长链非编码RNA被命名为超保守RNA(UCR), 其在人类、小鼠和大鼠等高度生物中同源区基因序列具有完全一致性[3-4]。研究[3-5]表明, UCR通过RNA干扰、调控和修饰参与了编码基因功能的调控,在肿瘤组织中UCR表达水平异常,能发挥促进或抑制肿瘤的作用,特别是对肿瘤细胞的增殖、凋亡、侵袭和转移以及预后产生重要的影响。uc.339是一种外显子T-UCR,部分嵌入ATP5G2宿主基因中,基因序列ID为KC508659.1。研究[10]发现, uc.339在一些肿瘤中表达水平异常,能发挥独特的生物学作用,例如在原发性非小细胞肺癌中uc.339的表达水平高于邻近非肿瘤肺组织,体内和体外实验均表明uc.339促进了肺癌细胞的生长。蒋记心等[11]研究认为,在非小细胞肺癌组织中uc.339表达量显著低于癌旁正常肺组织,与临床分期有相关性,并与p53基因的表达呈负相关,发挥着抑癌基因的作用。在结直肠癌组织中, uc.339表达水平上调,发挥致癌基因的作用[5]。在肝癌细胞的胞外囊泡中发现了uc.339的丰富表达,能促进肝癌细胞的增殖和生长[12]。夏群等[7]发现了在肾透明细胞癌中uc.339表达水平上调,通过活化K-RAS信号通路,从而促进肾癌的发生发展。
本研究结果表明,在102例CSCC中, uc.339表达水平上调,支持了uc.339作为致癌基因而发挥作用。进一步统计分析发现, uc.339表达水平与宫颈鳞癌的肿瘤大小和病理分级密切相关,而与患者年龄、HPV感染、淋巴结转移和TNM分期无关,表明uc.339在CSCC中表达水平越高,肿瘤细胞分级越低,肿瘤越容易增殖。肿瘤增殖后体积增大为癌细胞的恶性潜能提供了基础,提示uc.339是促进生长的致癌基因,该结论在MTT增殖活性实验和细胞克隆形成实验中得到了进一步的验证,最终会影响CSCC患者的生存和预后。在临床病理意义中,虽然uc.339表达水平与淋巴结转移(P=0.055)和TNM分期(P=0.068)无关,可能与本研究获取的标本数量偏少有关。
通过生物信息学[8]预测uc.339的下游miRNA, 包括miR-95-5P、miR-663b和miR-339-5P。在C33A细胞中改变uc.339的表达后仅有miR-339-5P随之变化,结合双荧光素酶报告实验结果得出miR-339-5P是uc.339的下游直接靶基因。miR-339-5P是一种微小RNA, 其在肿瘤组织中表达水平下调,可发挥抑癌基因的作用,例如在喉癌顺铂耐药细胞中miR-339-5P表达水平显著下调,而上调miR-339-5P可减弱喉癌细胞对顺铂的耐药性,并通过靶向TAK1抑制自噬,从而降低喉癌的顺铂耐药性[13]。在前列腺癌组织和细胞系中, miR-339-5P的表达水平下调,并与Gleason评分、淋巴结转移和TNM分期显著相关; 过度表达miR-339-5P则能抑制前列腺癌细胞的增殖、迁移和侵袭,表明miR-339-5P在前列腺癌中发挥抑癌基因的作用[14]。在肺腺癌组织中, miR-339-5P表达水平也是下调,过表达miR-339-5P可显著抑制肺腺癌细胞的侵袭和迁移,说明其是一种新的肺腺癌抑制剂,通过负性调节BCL6而发挥作用[15]。在脑胶质瘤组织中, miR-339-5P的表达显著低于非癌组织, miR-339-5P能降低U251细胞的侵袭指数和迁移率,机制上解释为miR-339-5P通过抑制PTP4A1/HMGB1信号通路而抑制脑胶质瘤U251细胞的血管生成模拟、迁移和侵袭[16]。本研究结果表明,CSCC组织中miR-339-5P的表达水平显著低于癌旁正常组织,提示miR-339-5P失活与CC的进展密切相关。对于miR-339-5P失活或表达下调的原因,本研究认为可能是被超保守RNA uc.339直接抑制的结果,即CSCC组织中uc.339呈现高表达状态,从而阻碍了miR-339-5P的表达,最终促进了CC细胞的增殖和生长过程。
综上所述, CSCC组织中uc.339表达水平上调,发挥致癌基因的功能; 高表达的uc.339通过下调miR-339-5P表达后促进CC细胞的增殖和生长。
