肾交感神经消融对慢性心力衰竭大鼠线粒体功能的影响
2023-07-10罗仪山郭志琴李韶南陈平安
罗仪山 郭志琴 刘 真 李韶南 陈平安
1.广州市第一人民医院急诊科,广东广州 510180;2.广州市第一人民医院心内科,广东广州 510180;3.广州市番禺区中心医院心内科,广东广州 511400
心力衰竭(简称“心衰”)是一种发病率和病死率很高的临床综合征,交感神经系统(sympathetic nervous system,SNS)及肾素- 血管紧张素- 醛固 酮 系 统(renin-angiotensin-aldosterone System,RAAS)的过度激活在其发生发展中起重要作用。虽然β 受体阻滞剂、血管紧张素转化酶抑制剂(angiotensin-converting enzyme inhibitor,ACEI)和 血管紧张素受体拮抗剂(angiotensin Ⅱ type1receptor blocker,ARB)等药物能抑制SNS、RAAS 改善心衰预后,心衰患者的五年生存率也只有50%。因此,探寻一些新的心衰的治疗方法一直是学者们研究的热点。
肾交感神经消融(renal denervation,RDN)通过消融肾动脉外膜的交感神经,进而降低全身交感神经活性,起到改善心功能的作用[1]。本课题组的前期研究也显示,它是一种安全有效的治疗心衰方法[2]。但有研究显示RDN 后肾交感神经会再生,从而影响RDN 的疗效[3],具体机制尚不明确。线粒体是心肌细胞的“动力源”,心衰与线粒体功能障碍密切相关[4],而交感神经活性与线粒体功能有关[5],推测RDN 可以通过改善心衰大鼠心肌细胞线粒体功能从而对心衰有益。本研究通过检测心肌细胞三磷酸腺苷(adenosine triphophate, ATP)浓度以及线粒体外膜转运酶Tom-20 表达量来探究RDN 及抑制RDN 后肾交感神经再生对慢性心衰大鼠心肌细胞线粒体功能的影响。
1 资料与方法
1.1 心衰大鼠模型的制备
选取7 周龄健康SD 大鼠,雌雄不限(雄性160 ~220 g,雌 性100 ~150 g,广 东 省 医 学 实验动物中心提供),用腹主动脉缩窄法(transverse aortic constriction,TAC)制备大鼠慢性心衰模型[6]。大鼠术前禁食24 h,饮水不限,10% 水合氯醛(0.3 ml/100 g)麻醉成功后将其仰卧位固定于手术台,腹部备皮,常规消毒铺巾后沿腹中线开腹,游离出部分腹主动脉后使用4-0 缝线将6#针头(外径约0.64 mm)与腹主动脉一起在肾动脉上方结扎,迅速拔出针头。将肠管恢复原位,腹腔给0.5 ml 头孢唑肟(辽宁美亚制药有限公司,国药准字H20090513,规格:10 mg/ml),逐层缝合腹壁肌肉及皮肤。大鼠苏醒后放回笼中,自由饮食。实验操作遵守广州市第一人民医院医学伦理委员会规定(伦理号:2017-203)。
1.2 RDN方法
对TAC 术后18 周大鼠行RDN,术前禁食24 h,饮水不限,10%水合氯醛(0.3 ml/100 g)麻醉成功后将其仰卧位固定于手术台,腹部备皮,常规消毒铺巾后沿腹中线开腹,轻柔拨开肠管,分离出左侧肾动脉,并用2-0 缝线于其下穿过,用湿润的棉球保护周围组织,防止损伤。将溶于无水乙醇的10%苯酚溶液顺着缝线滴落,作用于左肾动脉周围,消融10 min[7]。对右侧肾动脉进行同样的处理。两侧肾动脉交感神经消融完成后恢复肠管,腹腔给予0.5 ml 头孢唑肟,逐层缝合腹壁肌肉层及皮肤。大鼠苏醒后放回笼中,自由饮食。
1.3 实验动物分组
随机选取TAC 后大鼠为心衰组(n=3,暴露双侧肾动脉但不消融肾交感神经),RDN 后大鼠又根据腹腔注射药物的不同分为RDN 组(n=3,RDN 术后8 周腹腔注射生理盐水),Nogo-B 组(n=4,RDN术后8 周腹腔注射神经再生抑制剂Nogo-B[8]),NEP 组(n=3,RDN 术后8 周腹腔注射Nogo-B 拮抗剂NEP-40)。Nogo-B 组大鼠每天腹腔注射给药0.02 mg Nogo-B(Alpha Diagnostic Intl Inc.,美国),持续2 周,NEP 组大鼠每天腹腔注射给药0.025 mg NEP-40(ApexBio,美国,货号:B5247),持续2 周。RDN 组每天给相应体积生理盐水,持续2 周。
1.4 组织取材
TAC 术后44 周(即给药完成后16 周)处死大鼠,收集心脏及肾动脉标本并用4℃ PBS 液清洗。将心脏标本装于冻存管,于液氮中迅速冷冻,随后保存于-80℃冰箱。将肾动脉置于4%多聚甲醛中固定然后石蜡包埋。
1.5 HE染色
将包埋有肾动脉的蜡块切成厚度5 μm 切片,脱蜡水化后行HE 染色,脱水透明后用中性树脂封片。光学显微镜观察肾动脉神经变化,通过比较肾动脉外膜神经纤维数目评估RDN 术,神经再生抑制剂Nogo-B 及其拮抗剂NEP-40 对肾动脉周围神经的影响。
1.6 ATP的测定
心肌细胞ATP 浓度根据增强型ATP 检测试剂盒S0027(碧云天,中国上海)操作说明书用ELISA法测得。用ATP 裂解缓冲液裂解大鼠心肌细胞,4℃下12 000 g 离心5 min,取上清液测定ATP 浓度,根据ATP 标准曲线计算其浓度。
1.7 Western blot
从超低温冰箱中取出大鼠心肌组织约100 mg,快速剪碎后加入1 ml 裂解液,充分研磨,然后将组织匀浆以12 000 g 在4℃低温离心机中离心10 min,将上清液吸取至新的EP 管中,即为总蛋白溶液。测定蛋白浓度并配平各组目的蛋白上样量。用SDS-PAGE 蛋白凝胶分离浓缩,切胶,转膜,封闭后,用1 ∶2000 稀释的Tom-20 抗体(Proteintech,美国)室温孵育1.5 h,二抗孵育后显色曝光。用BandScan 软件半定量分析条带,β-actin 作为内参以校正目的蛋白的表达量。
1.8 统计学方法
使用SPSS 24.0 统计学软件进行数据处理,计量资料用均数±标准差(s)表示,两两比较采用t检验,多组间比较采用单因素方差分析(one-way ANOVA),P< 0.05 为差异有统计学意义。
2 结果
2.1 HE染色结果
与心衰组比较,RDN 后大鼠肾动脉外膜神经纤维明显减少。RDN 后各注药组肾动脉周围神经纤维数目由多到少依次为:NEP 组、RDN 组、Nogo-B 组(图1)。
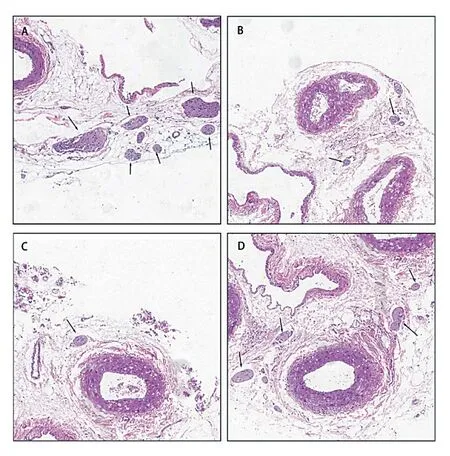
图1 HE 染色(100×)
2.2 生化检查结果
与心衰组(0.877±0.412 nmol/g)比较,RDN 组[(4.325±1.855)nmol/g,t=3.143,P=0.035]、Nogo-B 组[(5.115±1.925)nmol/g,t=3.692,P=0,014]及NEP 组[(3.793±0.432)nmol/g,t=8.457,P=0.001]ATP 浓度均明显升高,差异均有统计学意义(P< 0.05)。RDN、Nogo-B 及NEP 三组间ATP 浓度差异无统计学意义(P> 0.05)。
2.3 Western blot结果
与心衰组(0.148±0.053)比较,RDN 组(0.421±0.119,t=3.641,P=0.022)、Nogo-B 组(0.352±0.088,t=3.511,P=0.017)、NEP 组(0.401±0.123,t=3.262,P=0.031)心肌细胞Tom-20 表达量升高,差异有统计学意义(P< 0.05)。RDN、Nogo-B 及NEP 三组间Tom-20 表达量差异无统计学意义(P> 0.05)(图2)。
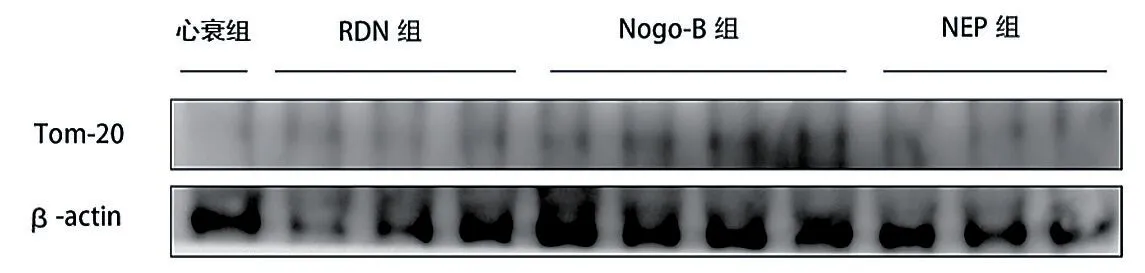
图2 各组大鼠心肌细胞Tom-20 表达量的Western blot检测结果(以β-actin 作为内参)
3 讨论
RDN 主要通过降低交感神经活性起到降低血压、改善心功能的作用,有研究显示其还可降低RAS活性[1]、影响一些小分子生物活性物质的活性[9],这些物质与心功能有着密切关系,但心衰时RDN 对心肌细胞线粒体功能的影响尚不明确。
线粒体是人体心肌细胞的主要产能部位,其功能异常与心衰密切相关[10],ATP 是心肌细胞的主要供能物质。心肌细胞ATP 的产生主要依赖于脂肪酸氧化驱动的线粒体氧化磷酸化,少量依赖于葡萄糖氧化或糖酵解。在衰竭心脏中脂肪酸和葡萄糖氧化被抑制,而糖酵解不能为病变心脏提供足够的能量[11],因此衰竭心脏心肌细胞中ATP 含量下降。本研究结果显示与未接受RDN 的心衰大鼠相比,RDN 组的大鼠心肌细胞ATP 含量明显上升,这可能与RDN 降低心衰大鼠全身交感神经兴奋性,心脏ATP 消耗减少有关。目前临床上常用的治疗心衰药物,如β 受体阻滞剂、ACEI、ARB 也可通过抑制交感神经活性减少心脏能量消耗,从而改善预后。
Tom-20 是线粒体外膜转运体Tom-40 复合物的转入受体,是线粒体蛋白运输系统的关键亚基,对线粒体蛋白导入的特异性起重要作用[4]。研究显示缺血会降低线粒体Tom-20 表达量,而缺血预处理可以维持Tom-20 的含量并通过改善线粒体的结构和功能来保护心脏[12]。此外,体外实验中过表达Tom-20 可减少ROS 生成,恢复线粒体功能,防止细胞死亡[13]。而衰竭心脏的心肌细胞中Tom-20 表达量降低[14],本研究显示RDN 逆转了这一趋势,RDN组心肌细胞中Tom-20 表达量上调,显示RDN 可通过线粒体蛋白运输机制参与心肌保护。本研究推测心肌细胞Tom 表达水平的上升会增加线粒体某些蛋白的运输,从而改善心肌细胞线粒体的结构和功能。
研究显示RDN 后存在肾交感神经再生现象[15],Nogo-B 是外周神经轴突生长抑制剂[8],本研究采用对RDN 后的大鼠使用Nogo-B 的方法观察Nogo-B是否能抑制肾动脉交感神经再生。肾动脉的HE 染色结果显示RDN 后各注药组神经纤维数目为NEP组>RDN 组>Nogo-B 组,表 明RDN 后Nogo-B 抑制肾动脉神经纤维再生,NEP 促进肾动脉神经纤维再生。但生化检查及Western blot 结果显示各注药组大鼠心肌细胞ATP 含量及Tom-20 表达量差异无统计学意义,表明抑制RDN 后交感神经再生对线粒体功能无明显影响。这一结果出现的可能原因与样本量偏少或观察时间不够长有关,也有可能与RDN 后肾动脉周围神经纤维的再生只是解剖学再生,并非功能性再生有关[6]。
本研究显示,RDN 可以改善心衰大鼠心肌细胞线粒体功能,抑制RDN 后肾交感神经再生对慢性心衰大鼠心肌细胞线粒体功能无明显影响。由于本研究样本量偏少、观察时间不够长,有关RDN对心衰后心肌细胞线粒体功能的具体影响及其机制尚需进一步探讨。
