陆地棉2-酮戊二酸依赖型氧化酶GhAOP2-like基因的克隆和功能分析
2023-07-08赵存鹏刘素恩王凯辉张晓慧赵丽英郭宝生耿军义
李 丹,赵存鹏,刘素恩,王凯辉,张晓慧,赵丽英,郭宝生,耿军义
(河北省农林科学院 棉花研究所,农业农村部黄淮海半干旱区棉花生物学与遗传育种重点实验室,国家棉花改良中心河北分中心,河北 石家庄 050051)
2-酮戊二酸依赖型氧化酶(2-oxoglutarate-dependent dioxygenase,2OGD)基因超级家族是参与植物代谢的最大基因家族之一,主要参与天然产物的氧化过程,尤其是萜类化合物[1]。2OGD通常使用亚铁Fe(Ⅱ)作为辅因子,2OG和O2作为辅助底物,产生副产物CO2和琥珀酸盐(R+2OG+O2→ R-OH+琥珀酸盐+CO2)[2]。2OGD的这种催化反应与多种生物过程有关,包括脯氨酸羟基化、核酸和组蛋白的氧化去甲基化以及许多代谢物的生物合成[2]。
Kawai等[2]对6种植物中的479个2OGD进行了系统发育分类。根据氨基酸序列的相似性,将其分为3类:DOXA、DOXB和DOXC。DOXA类包括大肠杆菌AlkB的植物同源物,它是参与烷基化核酸和组蛋白氧化去甲基化的2OGD的原型[2-3]。DOXB类在所有植物类群中都是保守的,并参与细胞壁蛋白质合成中的脯氨酸4-羟基化[2,4]。DOXC类参与各种植物化学物质的代谢,包括赤霉素、花青素、类黄酮、生长素、硫代葡萄糖苷等[1-2]。
硫代葡萄糖苷(Glucosinolates,GSL)是主要存在于十字花科植物中的一种次生代谢物质。近年研究表明,GSL在十字花科植物应对生物胁迫和非生物胁迫中具有重要作用[5]。GSL可分为3类:脂肪族GSL、吲哚族GSL和芳香族GSL[6]。AOPs是脂肪族GSL的合成基因[7],属于DOXC类[1],其中AOP2及其同源基因已被证明参与烯基GSL(脂肪族GSL中的一种)生物合成[8-12]。Kliebenstein等[8,10]发现,功能性AOP2的表达与烯基GSL的积累之间存在完全相关。
干旱和盐渍是影响植物生长和农作物产量的重要环境因子[13]。本研究前期测定了耐旱耐盐品种冀2658在干旱和盐胁迫下12,24 h的根蛋白质组,发现GhAOP2-like(2-oxoglutarate-dependent dioxygenase AOP2-like)蛋白在2种处理下均上调表达,说明GhAOP2-like在陆地棉响应干旱和盐胁迫时具有重要功能。但是,关于AOP2的功能研究主要集中在十字花科植物中,锦葵科中尚未见报道。所以研究陆地棉中GhAOP2-like响应干旱和盐胁迫的机制具有重要意义,同时也是对AOP基因家族功能的完善。为了解析GhAOP2-like响应胁迫的机理,对GhAOP2-like进行了克隆和初步功能研究。
1 材料和方法
1.1 试验材料
试验材料为河北省农林科学院棉花研究所培育的耐旱耐盐棉花(Gossypiumhirsutum)品种冀2658。
1.2 基因克隆
利用COTTONOMICS(http://cotton.zju.edu.cn/)网站上在线软件将包含GhAOP2-like序列前后各2 000 bp的一段序列提取出,用软件Premier 5在GhAOP2-like序列前后设计引物,以冀2658的cDNA为模板进行基因克隆。引物序列:Forward primer:ATGGGTGTCCAAGCTGAAATT;Reverse primer:TTAATTGGAAATTGGTGGTGAGA。
1.3 生物信息学分析
GO富集分析用Gene Ontology数据库(http://www.geneontology.org/)。用ExPASy-ProtParam(https://web.expasy.org/protparam/)对蛋白进行理化性质分析;用SignalP 5.0 Server(http://www.cbs.dtu.dk/services/SignalP)和TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM)分别对蛋白的信号肽及跨膜结构进行预测;用SPOMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=np%20sa_sopma.html)和Phyre2(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)分别对蛋白进行二级结构和3D模型预测。利用PSI(http://bis.zju.edu.cn/psi/)进行GhAOP2-like的亚细胞定位预测。利用NCBI上PSI-BLAST Iteration 1程序(https://blast.ncbi.nlm.nih.gov/Blast.cgi?PROGRAM=blastp&PAGE_TYPE=BlastSearch&LINK_LOC=blasthome)对序列进行Blast比对,用Fast Minimum Evolution方法进行聚类分析。
1.4 试验材料的干旱胁迫、盐胁迫和激素处理
将冀2658种子种植在灭菌的沙子中,待子叶展开,将幼苗轻轻取出,冲洗干净根部后,将植株移到水培装置中,培养至二叶一心时期,取植株的根、茎和叶片进行GhAOP2-like组织特异性表达分析,每个组织设置3个生物学重复;剩余植株进行干旱胁迫、盐胁迫和激素处理。模拟干旱胁迫用25.16%的PEG-6000溶液,盐胁迫用150 mmol/L NaCl溶液。为了避免2种胁迫因溶液渗透压不同引起的试验误差,本试验所用溶液的浓度在室温25 ℃下的渗透压基本相等,PEG-6000溶液的渗透压计算见参考文献[14]。激素处理浓度分别为100 μmol/L ABA、100 μmol/L MeJA、150 μmol/L GA3。取处理后0,6,12,24,48 h的幼苗根部提取RNA进行qRT-PCR验证GhAOP2-like表达量的变化,每个时间点取3个生物学重复。
1.5 RNA提取和qRT-PCR验证
用BioFlux Plant Total RNA Extraction Kit(DNA-free)试剂盒(购自BioFlux)按照说明书制备总RNA。第一链cDNA合成和qRT-PCR分别采用HiScript Ⅱ Q RT SuperMix for qPCR(+gDNA wiper)试剂盒和ChamQ Universal SYBR qPCR Master Mix(均购自诺唯赞)进行,在BIO-RAD CFX96实时系统中进行qRT-PCR。基因的相对表达量采用2-ΔΔCt方法分析,试验进行3次技术重复,用软件SPSS 进行显著性差异分析,以棉花Actin1作为参考基因。定量引物序列为:GhAOP2-like:Forward primer:TGGAAAGGAAACAAAAGAACGC;Reverse primer:CCAAGTCCAAAGCCTTCATACAAC。Actin1:Forward primer:ATCCTCCGTCTTGACCTTG;Reverse primer:TGTCCGTCAGGCAACTCAT。
2 结果与分析
2.1 GhAOP2-like的筛选
本研究前期利用TMT(Tandem Mass Tags)技术对干旱和盐胁迫12,24 h的根部蛋白质组进行了分析。结果发现,GhAOP2-like在2种胁迫下均呈现上调表达的趋势,且差异表达倍数较高,表达水平稳定(表1)。GO富集分析显示,GhAOP2-like参与氧化还原过程。此外,利用Cotton Omics Database(http://cotton.zju.edu.cn/download.html)中TM-1_V2.1-CDS数据进行Blast比对获得TM-1中GhAOP2-like基因序列,TM-1_v2.1_final.annotation中数据显示GhAOP2-like参与萜类合成。

表1 GhAOP2-like在干旱和盐胁迫下的差异表达倍数Tab.1 The FC value of GhAOP2-like under drought and salt stresses
2.2 GhAOP2-like的克隆
利用同源克隆法从冀2658中克隆得到GhAOP2-like的CDS序列(图1-A),序列全长972 bp,编码323个氨基酸。选取TM-1_V2.1-CDS数据库进行Blast比对,发现GhAOP2-like位于D13染色体上,并与G.raimondii-CDS数据库中GhAOP2-like序列完全一致。
A.GhAOP2-like基因PCR扩增产物的电泳;B.GhAOP2-like蛋白三维模型。M.DNA分子量标记;G.GhAOP2-like 的CDS条带。A.Electropherogram of PCR amplified product of GhAOP2-like;B.3D model of GhAOP2-like protein.M.DNA Marker;G.CDS sequence of GhAOP2-like.
2.3 GhAOP2-like蛋白的生物信息学分析
利用ExPASy-ProtParam分析得到GhAOP2-like蛋白的分子式为C1654H2525N429O478S19;分子质量为36.676 97 ku;理论等电点为5.20;总亲水性平均数为-0.223;不稳定指数为42.71。GhAOP2-like蛋白包含323个氨基酸,其中亮氨酸占8.4%,谷氨酸占8.4%,丝氨酸占7.1%,甘氨酸占6.8%。
预测显示,GhAOP2-like不含信号肽,不含跨膜结构域。二级结构中,α-螺旋占8.55%,延伸主链占32.02%,无规则卷曲占53.29%,β-折叠占6.14%。3D模型预测如图1-B,模型的置信度达到100%,氨基酸序列的覆盖度达到93%,因此,可以认为该蛋白结构的预测是可靠的。PSI结果显示GhAOP2-like定位在细胞质中。
2.4 GhAOP2-like氨基酸同源序列的聚类分析
利用NCBI上CPSI-BLAST Iteration 1程序对GhAOP2-like的氨基酸序列进行Blast比对,用Fast Minimum Evolution方法对比对到的部分序列进行聚类分析。从图2看出,棉属与其他物种的AOP序列明显被分成2组,但是与同样来自锦葵科的木槿(Hibiscussyriacus)的AOP序列关系最近。来源于棉属的AOP1和AOP2序列被明显分开,但序列之间差异较小。

图2 GhAOP2-like蛋白与同源序列的聚类分析Fig.2 The cluster analysis of GhAOP2-like protein sequence and its homologous sequences
2.5 GhAOP2-like组织特异性表达
取植株的根、茎、叶片和发育中的种子进行GhAOP2-like组织特异性表达分析,如图3-A所示,GhAOP2-like在根中表达量最高,推测GhAOP2-like可能对根部发育具有重要作用。为了进一步验证GhAOP2-like在不同组织中的表达量,在Cotton Omics Database搜索了TM-1和海7124中GhAOP2-like的组织表达,发现GhAOP2-like同样在根中表达最高(表2)[15]。
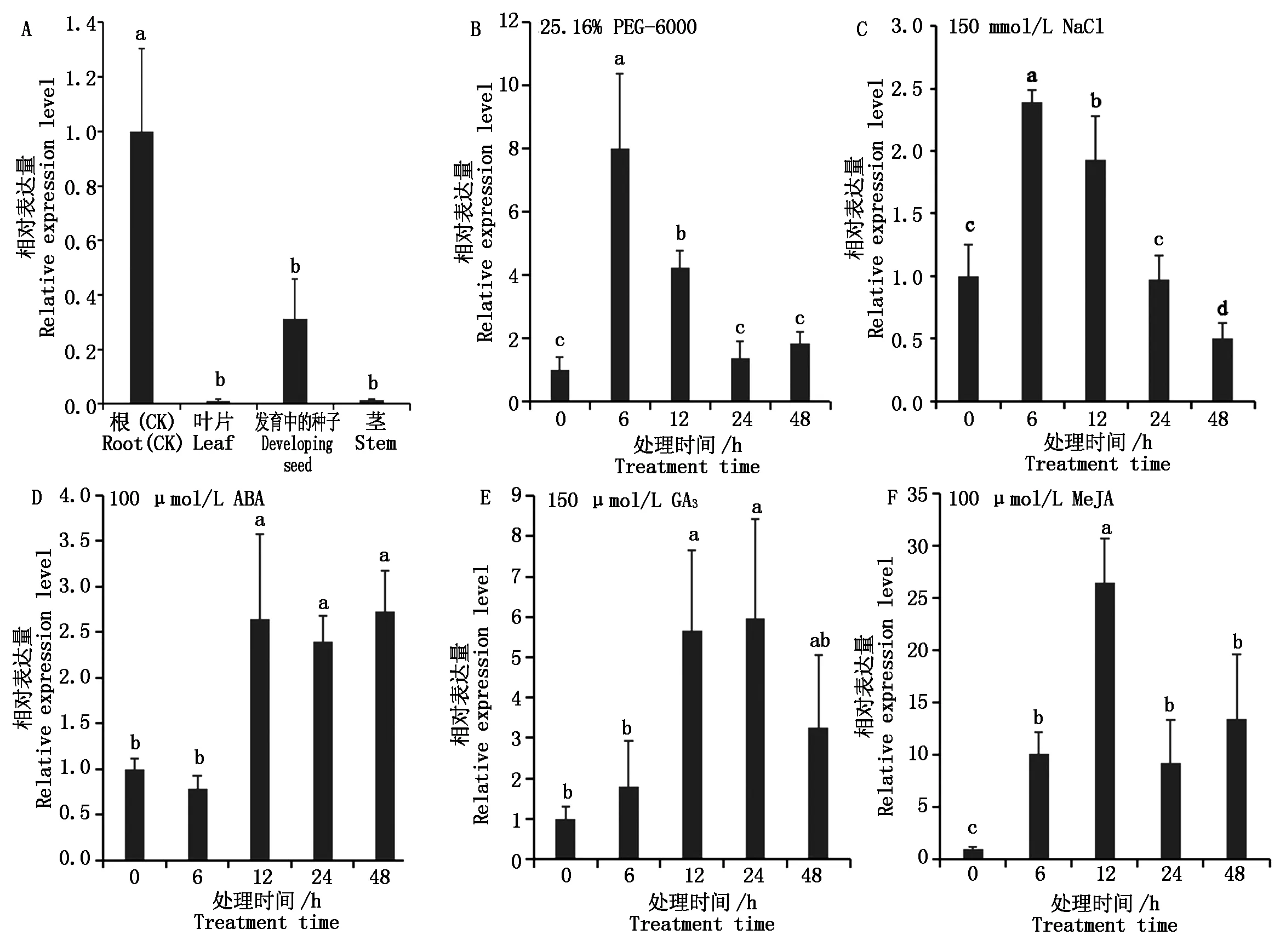
A.GhAOP2-like组织特异性表达分析;B.干旱处理;C.盐处理;D.ABA处理;E.GA3处理;F.MeJA处理。不同小写字母代表不同组织或不同处理时间的差异显著性(P<0.05)。A.The tissue-specific expression analysis of GhAOP2-like;B.Drought treatment;C.Salt treatment;D.ABA treatment;E.GA3 treatment;F.MeJA treatment.Different lowercase letters indicate signnificant differences among different tissues or different treatment times(P<0.05).

表2 TM-1和海7124中GhAOP2-like在不同组织中的相对表达Tab.2 Relative expression level of GhAOP2-like from TM-1 and Hai 7124 in different tissues
2.6 干旱、盐胁迫以及激素处理下GhAOP2-like表达量变化
用qRT-PCR对干旱、盐胁迫下冀2658根部GhAOP2-like的表达量进行验证,从图3-B—F中看出,与对照相比,GhAOP2-like在干旱和盐胁迫后表达量升高,这与蛋白质组测序结果一致。同样,在3种激素处理后,GhAOP2-like表达量也呈现不同程度地上升趋势,但在MeJA处理下表达量差异倍数最高,这可能是植物内不同激素间相互调控导致的。
3 结论与讨论
AOP基因家族参与十字花科植物中脂肪族GSL的合成。不少研究发现,在环境胁迫下,植物中GSL的积累可参与渗透调节、提高水分吸收和运输、增强植物的抗氧化能力[7]。因此,AOP基因对植物逆境下的生长发育具有非常重要的作用。
在拟南芥中,Kliebenstein等[7-8]鉴定出了AOP1、AOP2和AOP33个基因。其中AOP2能催化产生烯烃基硫苷。另外,Neal等[10]发现,AOP2至少以3个等位基因的形式存在于不同的拟南芥种质资源中,并证明其中一个等位基因AOP2-2在功能上能够形成烯基形式硫苷。在甘蓝和芥蓝中,分别克隆了AOP2的同源基因BoGSL-ALK[9-10]和BoaAOP-like[12],它们都能催化产生脂肪族GSL。目前,关于AOP或AOP-like的功能研究主要集中于十字花科植物中,而且已发现的含有GSL的16个科中不包含锦葵科[16]。所以,陆地棉中AOP2-like可能像TM-1_v2.1_final.annotation中注释的一样参与其他萜类的合成。
研究发现,植物中GSL代谢应答模式根据胁迫的时间、强度、植物所处生长时期而具有多样性[7]。Salehin等[17]在拟南芥中过表达AOP2可提高脂肪族GSL含量,并且GSL含量增加可能通过产生ROS促进气孔关闭从而提高植物耐旱性。盐胁迫下,脂肪族GSL可作为参与植物渗透调节作用的元素影响水平衡[18]。Martínez-Ballesta等[18]研究发现,脂肪族GSL可能与盐胁迫下根系增殖有关,并且脂肪族GSL含量的变化可以影响拟南芥种子的萌发,改变水通道蛋白的丰度。但在高浓度盐溶液下,GSL降解酶活性会提高,GSL的降解产物具有解毒的作用[19]。在芥蓝中,Zheng等[12]克隆了一个BoaAOP-like基因,能够调控脂肪族GSL的合成。BoaAOP-like定位于细胞质,与GhAOP2-like亚细胞定位预测结果一致。BoaAOP-like在根中表达量最高,并且在BoaAOP-like瞬时过度表达的植物中能够提高AOP2.1的表达水平。在本研究前期测定的蛋白质组中,盐胁迫下水通道蛋白丰度确实发生改变,其中9个上调,1个下调,但这是否与GhAOP2-like的调控有关还需进一步验证。而在干旱胁迫下,只有1个水通道蛋白下调,说明GhAOP2-like调控干旱和盐胁迫的机制不同。此外,GhAOP2-like在TM-1和海7124根部的高表达说明GhAOP2-like对根部的生长发育确实具有重要作用,可能调控脂肪族GSL类似物或萜类的合成,参与植物中渗透调节以维持水分平衡促进根系生长,并且在干旱胁迫下参与调节ROS的生成。
MYB家族是植物体内最大的一类转录因子,参与多种代谢途径的调控[20]。其中MYB28、MYB29、MYB76正调控脂肪族GSL合成[21]。在甘蓝中,BoAOP2的表达与BoMYB28、BoMYB29表达呈正相关[22]。拟南芥Col-0(拟南芥Col-0天然缺失AtAOP2基因)中过表达甘蓝BoAOP2导致AtMYB28、AtMYB29的表达量和硫苷都有所增加。另外将BoAOP2在MYB28/29双突变体中过表达,与对照相比,硫苷含量没有明显变化,说明BoAOP2过表达无法在双突变体中实现硫苷积累[11]。此外,BoAOP2还可上调AtMYC2的表达[11]。研究表明,MYC2除了参与硫苷的合成,也是茉莉酸(Jasmonic acid,JA)信号通路的主要调控因子,MYC2参与JA调控的植物发育、侧根和不定根形成[23],这可以解释Martínez-Ballesta等[18]发现的脂肪族GSL与根系增殖相关。而且,MYC2也调节JA信号通路与其他植物激素(如脱落酸、水杨酸、赤霉素和生长素)之间的相互作用。由此可见,AOP2参与多个代谢网络,可能在植物防御中起关键作用。本研究发现,GhAOP2-like的表达确实受到多种激素的调控,并且在MeJA处理下表达变化最强烈。所以,和AOP2一样,GhAOP2-like也可能受到转录因子MYC2、MYB28、MYB29的调控,参与多种激素之间的协同作用,从而提高植物抗旱耐盐的能力,但还需进一步论证。
