氨氮质量浓度对厌氧发酵产甲烷特性及产甲烷菌群落的影响
2023-07-07朱教宁张静璇李永平史向远王秀红
朱教宁 ,高 莉 ,张静璇 ,李永平 ,汤 昀 ,史向远 ,王秀红
(1.山西农业大学山西有机旱作农业研究院,山西太原 030031;2.农业农村部有机旱作农业重点实验室,山西太原 030031;3.有机旱作农业山西省重点实验室,山西太原 030031;4.山西农业大学资源环境学院,山西太原 030031)
我国作为农业大国,每年都会产出大量的农业废弃物。据测算,全国年产畜禽粪污量约为38亿t,且以年均5%~10%的速度递增[1]。2016年,山西省畜禽粪便产生量为3 410.97万t,总生化需氧量和总氨氮产生量分别为70.85万t和7.72万t,其中以鸡粪的占比最大[2]。调查结果显示,我国年产农作物秸秆约为9.5万t,其中玉米秸秆产生量最多,约占秸秆总量的42%[3]。畜禽粪便不经过合理处置随意堆放,易对土壤、水体和大气环境造成严重污染,且会直接危害人类健康;而农作物秸秆不加处理直接燃烧,同样会导致环境污染。厌氧发酵技术不仅能耗低,还能产生清洁能源沼气,规模可大可小、适应性强,已成为处理畜禽粪便和作物秸秆最为有效的技术之一[1,4]。由于混合发酵能够平衡发酵原料的营养,增强发酵体系的缓冲能力,采用混合原料进行厌氧发酵已成为当前沼气工程的趋势所在[5]。
鸡粪中富含氮,而富氮类发酵原料在其厌氧消化过程中的氨氮抑制是引起发酵系统不稳定、产气效率下降的主要因素[6-7]。氨氮可直接抑制甲烷合成酶的活性,破坏产甲烷菌细胞内的质子平衡,从而降低产甲烷菌的活性,造成厌氧发酵系统失衡[6]。国内外许多学者已对鸡粪在不同发酵条件下的氨氮抑制问题开展了相关研究工作。周曼[7]研究认为,鸡粪高温(45℃及55℃)干式厌氧发酵运行中,氨氮质量浓度逐渐达到约5 000 mg/L时,系统的挥发性脂肪酸(VFAs)出现持续累积,产气效率降低,到反应后期时产气几乎停滞。乔玮等[8]在鸡粪发酵过程中发现,当进料浓度由5%提升至10%后,氨氮质量浓度由2.5 g/L提升至6.1 g/L,系统受到抑制,甲烷产量下降100%。BUJOCZEK等[9]在高浓度鸡粪的中温发酵中发现,随着发酵时间的延长,氨氮会逐渐积累至6 578 mg/L,产甲烷量较氨氮为4 000 mg/L时少50%。但是,关于鸡粪和玉米秸秆混合发酵的氨氮抑制问题讨论较少,不同氨氮质量浓度对其产甲烷特性和微生物群落的影响还尚不明确。因此,本试验将鸡粪和玉米秸秆以一定比例混合后作为发酵原料,研究不同氨氮质量浓度对鸡粪和玉米秸秆混合厌氧发酵产甲烷特性、发酵系统过程参数及产甲烷菌群落的影响,以期为鸡粪和玉米秸秆混合发酵的规模化沼气工程的稳定运行提供理论支持。
1 材料和方法
1.1 试验材料
鸡粪为山西省太谷县鸿昊养殖专业合作社青年鸡鸡粪,去除鸡毛等杂质后于4℃的环境中保存待用;玉米秸秆取自山西农业大学东阳试验示范基地,自然风干后粉碎待用;接种物为实验室鸡粪与玉米秸秆混合发酵后的消化液。试验原料的基本性质见表1。
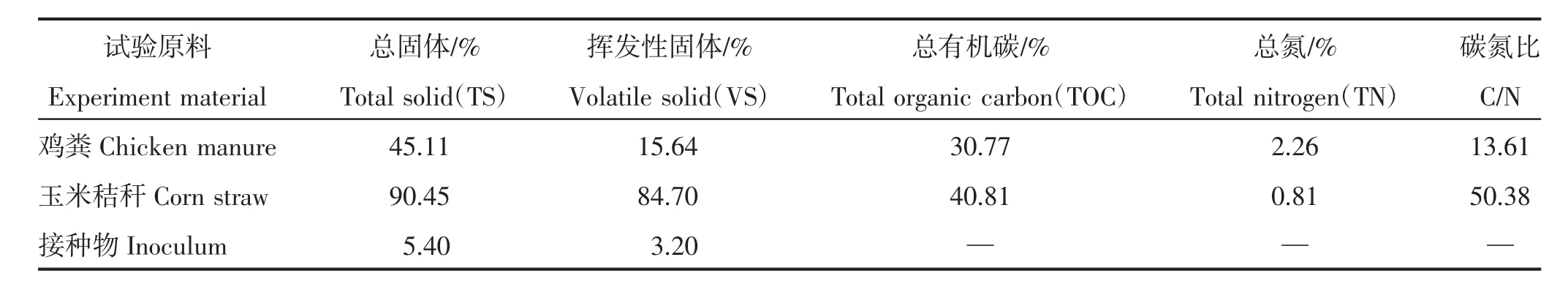
表1 试验原料的基本性质Table 1 Basic characteristics of experiment material
1.2 试验装置
试验装置为实验室自制的1 L厌氧消化发生器,具体构造和原理参照汤昀等[10]对试验装置的描述。
1.3 试验设计
试验采用一次性进料和出料的批次发酵方式,按照前期研究的结论[10],设定鸡粪和玉米秸秆的VS质量比为6∶4,发酵料液VS质量分数6%,接种物占比30%,料液总质量为600 g,反应温度为中温35℃,发酵时间为37 d。添加一定浓度的NH4Cl溶液使发酵系统的初始氨氮质量浓度分别为1 500、3 000、4 500、6 000 mg/L,记为 T1~T4 处理;以不外加NH4Cl溶液的处理为对照,记为CK(本底氨氮质量浓度为764.32 mg/L),各处理均设置5次重复。每天测定沼气产量,每2 d测定1次甲烷含量,发酵第 0、5、15、25、35 天分别取样测定 1 次发酵料液的pH值、总氨氮质量浓度、挥发性脂肪酸质量浓度等理化指标。
1.4 测定项目及方法
TS质量分数和VS质量分数分别采用烘干法和灼烧法测定,差重法计算结果[11];TOC质量分数和TN的质量分数分别采用TOC分析仪和凯氏定氮法测定[12];沼气产量采用排水集气法测定;甲烷含量采用安捷伦7980B气相色谱仪测定,具体方法参照庞震鹏等[13]的报道;pH值采用PHS-3C酸度计测定;总氨氮(TAN)的质量浓度采用蒸馏中和滴定法(HJ 537—2009)测定;VFAs的质量浓度采用比色法测定[11]。
1.5 计算方法
1.5.1 原料日产甲烷量
单位质量发酵原料(以VS计)的日产甲烷量。日产甲烷量为日产沼气量与甲烷含量的乘积,除以原料的质量即为原料日产甲烷量,算法见公式(1)[14]。
式中,V甲烷为单位质量 VS的日产甲烷量[mL/(d·gVS)];V为日产沼气量(mL/d);W为沼气中的甲烷含量(%);M为发酵原料的VS质量(g)。
1.5.2 游离氨(FAN)质量浓度
游离氨(FAN)与 TAN、pH值、温度存在公式(2)[15]中的等式关系,其质量浓度由计算获得。
式中,Ka为解离平衡常数;pKa在35℃时为8.95;pH为发酵液的pH值。
1.6 原料产甲烷量动力学分析
采用修正的Gompertz模型[16]公式(3)对鸡粪和玉米秸秆混合厌氧发酵过程中的原料产甲烷量进行动力学拟合。
式中,Y甲烷为t时刻的原料累积产甲烷量(mL/gVS);P为反应结束时的原料累积产甲烷量,即原料的产甲烷潜力(mL/gVS);V甲烷,m为最大原料产甲烷速率[mL/(d·gVS)];e=2.72;r为迟滞时间(d)。
1.7 微生物测定分析方法
在产气末期(发酵第30天)对发酵料液取样进行微生物分析,每处理取3个重复样品。采集的样品委托北京百迈克生物科技有限公司进行DNA的提取、扩增和高通量测序。具体操作方法为:采用TGuide S96磁珠法土壤/粪便基因组DNA提取试剂盒完成DNA的提取。产甲烷古菌使用双端引物 Arch349F(5′-GYGCASCAGKCGMGAAW-3′)和Arch806R (5′-GGACTACVSGGGTATCTAAT-3′)对16S V3和V4进行扩增。扩增和纯化后的样品通过Illumina Novaseq测序平台进行高通量测序,从而进行发酵过程产甲烷微生物的群落分析。
2 结果与分析
2.1 产甲烷性能
甲烷是沼气的主要成分,甲烷含量越多,其热值越高,因此,本试验以产甲烷量评价不同氨氮质量浓度条件下的产气效率。
2.1.1 原料日产甲烷量
由图1可知,各处理原料日产甲烷量的整体变化趋势大体一致,均为先升高后降低。但是,其到达高峰的时间和峰值却不尽相同。CK和T1处理的原料日产甲烷高峰均出现在发酵第9天,峰值分别为13.44、12.02 mL/(d·gVS);当氨氮质量浓度为3 000 mg/L(T2处理)时,原料日产甲烷峰值的出现时间滞后,为发酵第11天,峰值为9.74 mL/(d·gVS);当氨氮质量浓度进一步提高为4 500 mg/L(T3处理)和6 000 mg/L(T4处理)时,其原料日产甲烷峰值的出现时间分别延长至发酵第16、20天,峰值分别为9.59、6.12 mL/(d·gVS),分别较CK降低28.65%和54.48%。由此可见,氨氮质量浓度越高,各处理原料日产甲烷量到达高峰所需要的时间越长,峰值也越低。这可能是因为高氨氮质量浓度抑制了产甲烷菌的活性[17]。

图1 不同氨氮质量浓度下各处理的原料日产甲烷量Figure 1 Material daily methane production of treatments under different ammonia mass concentration
2.1.2 原料累积产甲烷量
由图2可知,不同氨氮质量浓度下,各处理的原料累积产甲烷量基本呈快速增长到趋于平缓的变化趋势。随着氨氮质量浓度的提高,增长的斜率逐渐减小,快速增长期与平缓期拐点出现的时间依次延后。这表明增加氨氮质量浓度,降低了厌氧发酵产甲烷的速率且浓度越高速率越低,该结果与高文萱等[18]的报道结果一致。反应结束时,各处理的原料累积产甲烷量由高到低的排序为CK>T1>T2>T3>T4。T1处理与CK无显著差异(P>0.05),T2~T4处理均显著低于 CK(P<0.05),氨氮质量浓度为 3 000、4 500、6 000 mg/L(T2~T4处理)时,其原料累积产甲烷量为119.50、96.60、64.52 mL/gVS, 较 对 照 分 别 降 低16.66%、32.67%、55.03%。由此可知,原料累积产甲烷量随氨氮质量浓度的增加而降低,氨氮质量浓度为3 000 mg/L及以上时,对发酵系统的产甲烷过程产生了明显的抑制;其中T4处理的原料累积产甲烷量较CK下降超过50%,6 000 mg/L的氨氮质量浓度已超过了IC50(半抑制浓度)。

图2 不同氨氮质量浓度下各处理的原料累积产甲烷量Figure 2 Material cumulative methane production of treatments under different ammonia mass concentration
众多学者的研究结果表明,修正的Gompertz模型能较好地拟合有机物厌氧发酵的产气动力学过程[19-21]。为此,本试验采用修正的Gompertz模型对各处理反应体系的原料产甲烷量进行了拟合(表2)。由表2可知,各处理R2均大于0.995,理论产甲烷量与实测值差异较小,拟合结果较好。拟合数据显示,最大原料产甲烷速率和理论原料累积产甲烷量均随氨氮质量浓度的升高而降低,这与本试验结果一致。CK的理论原料累积产甲烷量和最大原料产甲烷速率分别为139.26 mL/gVS和11.61 mL/(d·gVS)。氨氮质量浓度为1 500 mg/L的处理拟合值与CK相差较小;当氨氮质量浓度>1 500 mg/L时,理论原料累积产甲烷量和最大原料产甲烷速率均较CK降低,分别下降16.79%~53.18%和33.76%~61.67%。另外,氨氮质量浓度的升高,会延长迟滞时间,CK的迟滞时间为2.93 d,当氨氮质量浓度上升为1 500、3 000 mg/L时,迟滞时间分别增加至3.69、4.87 d,为CK的1.26、1.66倍;当氨氮质量浓度为4 500、6 000 mg/L 时,迟滞时间为 8.39、13.69 d,已增加至CK的2.86、4.67倍。
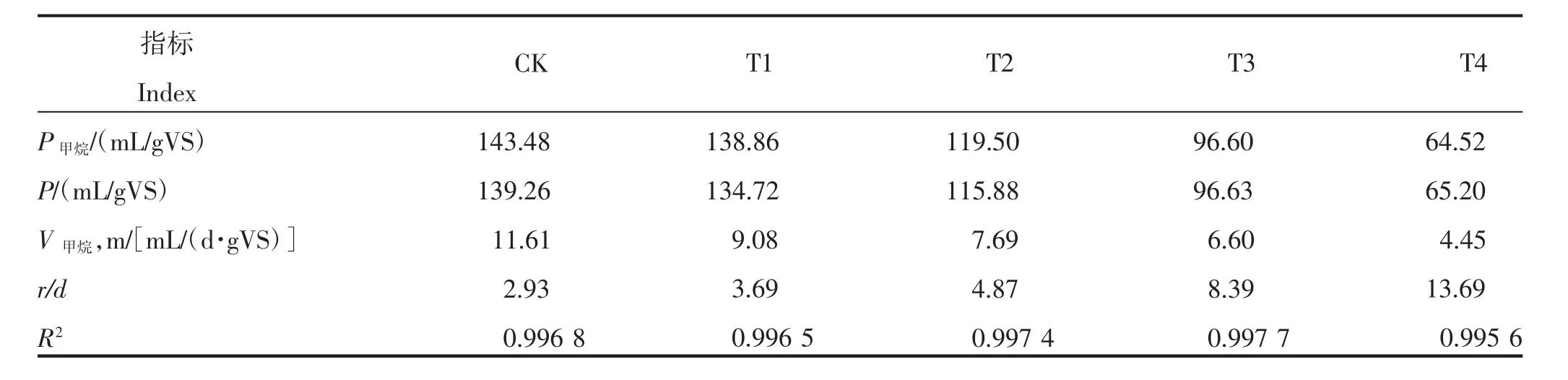
表2 不同氨氮质量浓度下各处理原料产甲烷动力学拟合结果Table 2 Fitting results of material methane production kinetics of treatments under different ammonia mass concentration
2.2 发酵系统pH值和VFAs变化
图3为各处理pH值和VFAs的变化曲线图。由图3可知,添加NH4Cl溶液的处理组初始pH值均较CK低,且氨氮质量浓度越高,pH值越低。这是因为外加NH4Cl溶液后增加了系统中NH4+的浓度,使得反应式NH4++OH-NH3·H2O向右进行,进而系统pH值下降。随着厌氧发酵反应的进行,各处理组pH值整体上呈现先降低后升高的变化趋势。发酵第5天,各反应体系中水解酸化菌迅速将大分子有机物转化为VFAs等中间产物,引起pH值降低。随后CK和T1处理的pH值开始逐渐升高,T2~T4处理则继续下降,反应进行到第15天时降为最低,分别为 7.64、7.44、7.24。由图3可知,各处理的 VFAs质量浓度呈先升高后降低的整体趋势。反应开始后,各处理的VFAs质量浓度均迅速升高,随着反应的继续进行,CK与T1组的VFAs被产甲烷菌快速消耗,且消耗速度远大于VFAs的产生速度,VFAs的质量浓度快速下降。T2的变化趋势与CK近似,但是VFAs的下降速度明显放缓,这是因为产甲烷菌较水解酸化菌更容易受氨氮抑制,产甲烷菌的活性受限使得VFAs的消耗速度降低,相应的产甲烷速率明显下降,产甲烷高峰期滞后,这与孟晓山等[22]的研究结果一致。T3和T4处理组氨氮质量浓度高,产甲烷菌活性受到严重抑制,VFAs的质量浓度在反应前期不降反升,发酵第15天时的VFAs分别达到峰值 4 295.89、6 841.79 mg/L,VFAs严重累积,之后随着产甲烷菌活性的慢慢恢复,VFAs的质量浓度开始下降,这与T3和T4处理产甲烷峰值延迟至第16、20天相对应。
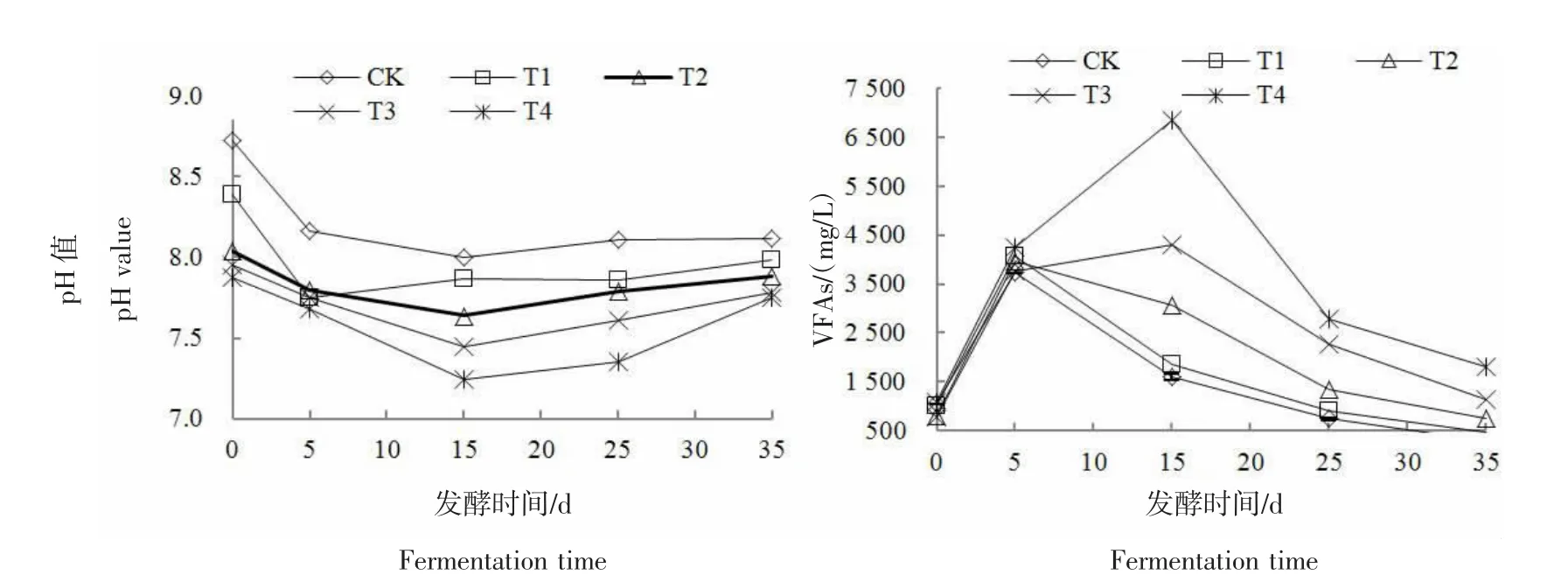
图3 不同氨氮质量浓度下各处理的pH值及VFAsFigure 3 pH value and VFAs of treatments under different ammonia mass concentration
2.3 发酵系统TAN和FAN的变化
由图4可知,各处理TAN质量浓度整体呈先升高后降低并趋于稳定的趋势,整个发酵过程中波动较小。反应初始阶段,鸡粪中含氮有机物质快速分解为氨氮,导致各处理发酵系统中的TAN增加。随后,CK和T1处理中的氨氮被产甲烷菌生长利用,氨氮质量浓度在发酵第5天后开始降低。T2~T4处理由于产甲烷菌受到不同程度的抑制,TAN未被及时利用继续慢慢升高,之后随着产甲烷菌活性的恢复,TAN开始缓慢降低,整个发酵过程TAN均维持在一个较高的水平上。至反应结束时,T2~T4处理的TAN质量浓度分别为3660.62、5912.22、9004.38mg/L。反应体系中氨氮的存在形式有两种,包括NH4+和FAN,二者对产甲烷菌均有毒害作用,而FAN的毒性更大[23]。FAN的变化情况见图4,各处理初始FAN的质量浓度较高,为283.58~697.14 mg/L,这主要是由于初始pH值较高(7.87~8.72)引起的,随着反应的进行FAN先降低后升高,整体上初始氨氮质量浓度越高,FAN的质量浓度越高。有研究认为,200 mg/L是厌氧发酵系统的FAN抑制阈值[24-25]。CK和T1处理的FAN除了初始值高于200 mg/L的FAN抑制阈值外,其余发酵时段均低于这一抑制阈值。值得注意的是,发酵第15天时,T2~T4处理的FAN质量浓度均处于200 mg/L以下,这是因为发酵前期高氨氮质量浓度抑制了产甲烷菌的正常代谢,造成了VFAs积累、pH值下降;由公式(2)可知,温度一定,TAN的变化较稳定时,pH值降低FAN也随之降低。TAN、VFAs、pH值和FAN的这种相互关系导致此时系统出现了“抑制型稳态”,即系统各指标在正常范围内,但产甲烷量很低[26-27]。其余发酵时间,T2~T4处理的FAN质量浓度均高于200 mg/L,至反应结束时T2~T4处理的 FAN质量浓度分别达 288.38、375.01、535.30 mg/L。
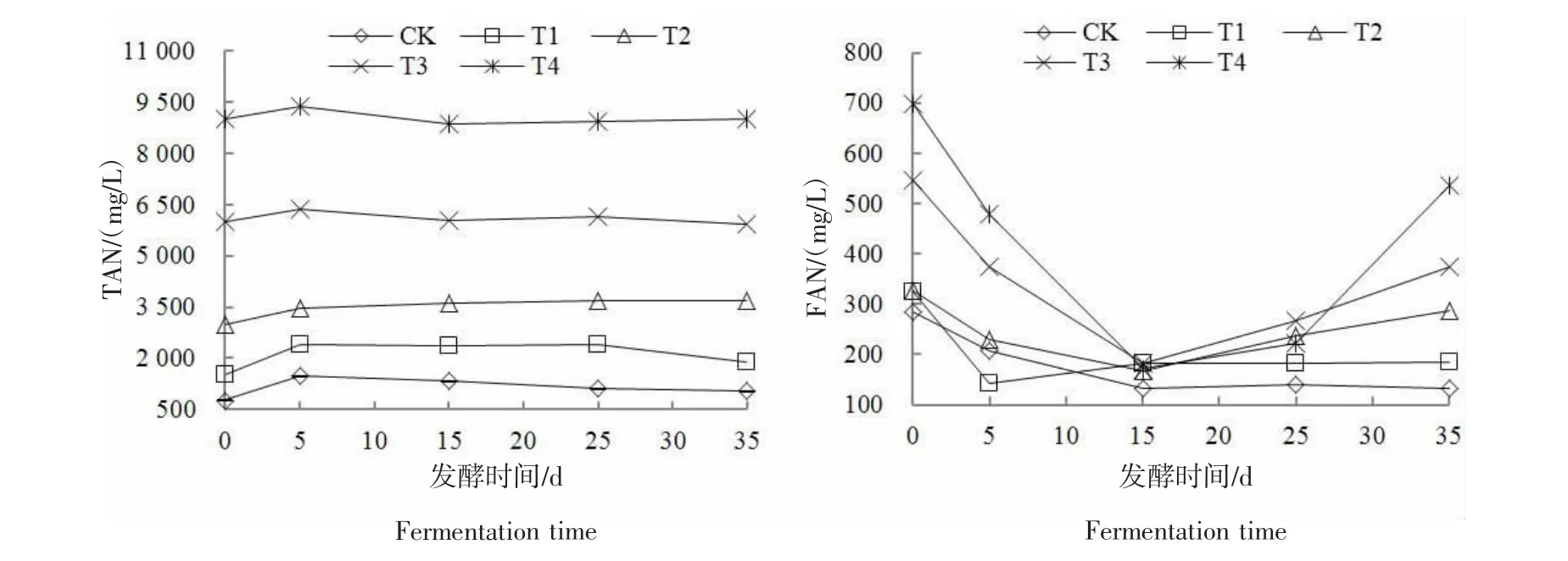
图4 不同氨氮质量浓度下各处理的TAN及FANFigure 4 TAN and FAN of treatments under different ammonia mass concentration
2.4 产甲烷菌群落的变化
由图5可知,CK和T1处理中甲烷鬃菌属(Methanosaeta)为优势菌属,相对丰度分别为42.38%、27.37%;甲烷八叠球菌属(Methanosarcina)、甲 烷 囊 菌 属 (Methaanoculleus) 和Candidatus_Methanoplasma的相对丰度分别为4.23%、2.64%、0.05%和6.02%、8.50%、0.38%。随着氨氮质量浓度的提升,Methanosaeta的相对丰度整体下降,而 Methanosarcina、Methaanoculleus和Candidatus_Methanoplasma的相对丰度逐渐上升。当氨氮质量浓度为3 000 mg/L时,Methanosaeta的相对丰度降至 15.36%,而 Methanosarcina、Methaanoculleus和Candidatus_Methanoplasma的相对丰度分别上升至9.98%、12.04%和1.75%。当氨氮质量浓度进一步提升至 4 500、6 000mg/L时,Methanosaeta的相对丰度继续下降至12.88%、6.69%,Methanosarcina和Methaanoculleus的相对丰度则分别提高至22.05%、26.80%和 12.33%、18.77%,二者取代Methanosaeta成为优势菌属,Candidatus_Methanoplasma的相对丰度也分别提升至2.43%、8.56%。
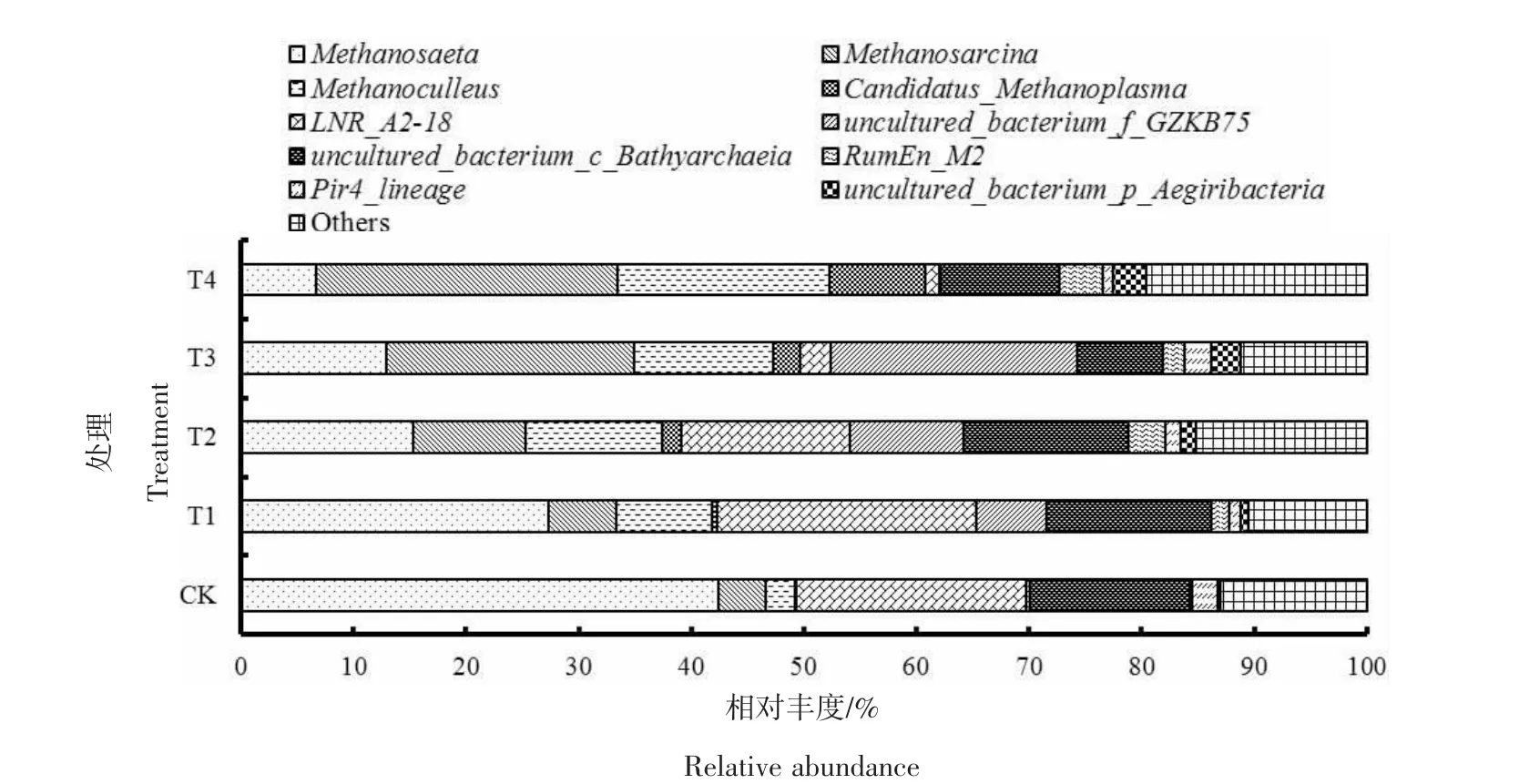
图5 各处理产甲烷菌的相对丰度(属水平)Figure 5 Relative abundance of methanogens under different treatments(genus)
据报道,Methanosaeta为严格的嗜乙酸型产甲烷菌属,在低氨氮质量浓度的厌氧发酵系统中,往往占据主导地位,但对氨氮特别是FAN较为敏感,氨氮质量浓度高时其含量会明显下降[28]。孟晓山等[22]研究发现,当氨氮投加量超过4 000 mg/L时,发酵系统的产甲烷菌群结构发生改变,Methanosaeta逐渐被具有较强氨氮耐受能力的Methanosarcina和Methaanoculleus替代;YANG等[15]的研究结果也表明,随着氨氮的质量浓度由2 g/L提高至5 g/L,嗜乙酸型产甲烷菌属Methanosaeta减少,而氢营养型产甲烷菌属Methaanoculleu增加,这与本试验结果一致。Methanosarcina是一种兼性营养型产甲烷菌属,能同时利用乙酸和氢气进行产甲烷活动,且其自身为不规则的细胞团结构,对高质量浓度氨氮具有较强的抗性[29]。Methaanoculleus为氢营养型,研究人员发现在高氨氮环境中Methaanoculleus的相对丰度会大幅提升[30],但是由于氢营养型产甲烷菌属的产甲烷速率明显低于嗜乙酸型产甲烷菌属,高氨氮质量浓度的厌氧发酵体系的产甲烷效率普遍较低[31],这与本试验中氨氮质量浓度≥3 000 mg/L时,产甲烷量降低相吻合。Candidatus_Methanoplasma为甲基型和氢型混合营养产甲烷菌属[32],在本试验中其相对丰度随着氨氮质量浓度的升高而增加。孙娟等[33]的研究结果表明,在发酵系统VFAs质量浓度越高Candidatus_Methanoplasma的相对丰度越大,这与本试验结果相符。
3 讨论
玉米秸秆为富碳物料,干物质含碳量通常在80%以上,将二者混合进行厌氧发酵有利于平衡原料的碳氮比,在一定程度上减缓氨氮抑制[34]。但是在本试验中,氨氮质量浓度在3 000 mg/L时即出现了明显的氨氮抑制,说明玉米秸秆的添加对鸡粪氨氮抑制的缓解效果并不明显,这与JAN等[35]、孙辰[36]的研究结果一致。张玉秀等[37]也研究认为,通过添加富碳物料调节C/N来缓解氨氮抑制,其反应过程较慢,仅在系统未被完全抑制前有一定的效果。
在本试验条件下,当氨氮质量浓度≥3 000 mg/L时,产甲烷菌群发生了明显的改变,表现为优势菌群由嗜乙酸型产甲烷菌属向氢营养型产甲烷菌属转变,表明产甲烷途径已由氢利用型为主取代了乙酸利用型为主[22]。因此,有学者通过微生物长期驯化和接种、增强发酵系统中氨氮耐受能力较强的产甲烷菌株的群落数来缓解氨氮抑制。蒋建国等[38]通过长期驯化可使餐厨垃圾厌氧消化在氨氮质量浓度为3 000 mg/L的环境中长期稳定运行;FOTIDIS等[39]通过长期驯化,将氨氮抑制的阈值由5 000 mg/L提升至7 000 mg/L。然而,微生物的生长速度较慢,驯化接种往往耗时过长,很难应对发酵体系中氨氮质量浓度的快速上升,因此,接种驯化在高负荷、高氨氮质量浓度环境中的缓解效率还有待进一步探讨[38,40]。
4 结论
(1)随着氨氮质量浓度的升高,鸡粪和玉米秸秆混合厌氧发酵的原料累积产甲烷量逐渐降低。氨氮质量浓度<3 000 mg/L时,对发酵系统无明显抑制作用;氨氮质量浓度≥3 000 mg/L时,厌氧发酵系统受到氨氮抑制,FAN质量浓度随氨氮质量浓度的提升不断增加,VFA质量浓度逐渐升高直至出现累积,原料累积产甲烷量不断下降。(2)修正的Gompertz模型较好地反映了各处理组反应体系的产气动力学过程,获得了不同氨氮质量浓度条件下鸡粪与玉米秸秆混合厌氧发酵的理论原料累积产甲烷量和最大产甲烷速率。拟合结果表明,随初始氨氮质量浓度的提升,理论原料累积产甲烷量和最大产甲烷速率逐渐降低,迟滞时间延长。(3)氨氮质量浓度<3 000 mg/L时,嗜乙酸型产甲烷菌属Methanosaeta为优势产甲烷菌。当氨氮质量浓度≥3 000 mg/L时,随着氨氮质量浓度的提升,Methanosaeta的相对丰度逐渐降低,其主导地位逐渐被氨氮耐性更高的氢营养型产甲烷菌属Methanosarcina和Methaanoculleus取代。
