设施番茄灰霉病病原菌的分离与鉴定
2023-07-07杨永青狄洁增康立茹
高 婧 ,刘 燕 ,杨永青 ,狄洁增 ,王 永 ,康立茹 ,2,肖 猛
(1.内蒙古自治区农牧业科学院,内蒙古呼和浩特 010031;2.内蒙古农业大学,内蒙古呼和浩特 010018;3.阜新蒙古族自治县住房和城乡建设服务中心园林绿化服务部,辽宁阜新 123100)
我国关于番茄的病害有40余种,常见的有番茄灰霉病、番茄早疫病、番茄晚疫病、番茄病毒病、番茄叶霉病、番茄溃疡病等,其中番茄灰霉病自20世纪80年代起在我国开始蔓延,对设施番茄的生产也造成了极大威胁[4]。番茄灰霉病是由灰葡萄孢菌(Botrytis cinerea)引起的一种半腐生型病害,其病原菌寄主广泛,可侵染蔬菜、水果、花卉等多种植物,易造成严重的产量损失[5]。该病害在温度低湿度大条件下易发病,苗期和成株期均可发病,主要为害花器、果实、叶片和茎秆,但以成株期青果受害最重。发病时造成落花、果实腐烂,严重时茎秆整段腐烂导致整株枯死。一般减产20%~30%,严重地块减产可达60%以上[6]。番茄灰霉病发病后传播速度快,尤其设施番茄棚室较小,湿度较高[7],且重茬种植较为普遍,造成病原菌的大量积累,冬春季节温度低、通风不足,使得番茄灰霉病极易发生,对设施番茄的生产造成了极大威胁[8]。
近年来,随着番茄连年种植以及种植面积的不断扩大,番茄灰霉病在种植区的发病面积也不断增加,且危害日益严重,已成为番茄设施栽培的主要限制因素[4]。本试验采集了内蒙古呼和浩特市周边地区设施番茄灰霉病的病样,分离获得病原菌并进行鉴定,旨在明确当地番茄灰霉病病原菌的种类,为进一步研究设施番茄灰霉病的发生规律和综合防治奠定基础。
1 材料和方法
1.1 材料
1.1.1 供试材料
供试样本采自内蒙古自治区呼和浩特市根堡村基地、内蒙古自治区农牧业科学院试验地、乌兰察布市冷凉蔬菜院士工作站试验地。
供试番茄品种:普罗旺斯。
1.1.2 供试培养基
马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA):去皮马铃薯200 g煮汁,滤出汁液中加入葡萄糖 20 g,琼脂 15~20 g,蒸馏水定容到 1 L;121 ℃高温灭菌30 min。
2018年8月3日,辽宁省沈阳市沈北新区发生一例非洲猪瘟疫情,经过中国卫生与流行病学中心确认,该疫情为我国首次发生的非洲猪瘟疫情。疫情发生后,农业农村部根据《非洲猪瘟疫情应急预案》启动了二级应急响应,采取了封锁、扑杀、无害化处理以及消毒等措施,禁止所有生猪、易感动物和产品运入或流出封锁区,同时沈阳市全面禁止生猪向外调运。在各部门配合下,此次疫情得到很好的控制,没有发生大面积的传播感染。但是因为非洲猪瘟一直以来都被我国列为一类动物疫病,是重点防控的外来病,近年一直在俄罗斯和东欧国家传播,我国有必要对该动物疫病进行研究。
水琼脂培养基(water agar,WA):1 L蒸馏水中加入琼脂粉15~20 g,121℃高温灭菌30 min,灭菌结束后迅速摇匀,备用。
1.1.3 供试试剂
D2000 DNA Marker(BM101-01,北京全式金生物技术有限公司)、100 bp DNA Ladder(BM301-01,北京全式金生物技术有限公司)、卡那霉素(K1377,Sigma-Aldrich),聚合酶链式反应(PCR)引物由北京厚生博泰科技有限公司合成。
1.2 试验方法
1.2.1 病原菌的分离与纯化
用常规组织分离法分离病原菌。采集发病初期茎秆,流水冲洗表面,取病样病健交界组织,切成0.3 cm×0.3 cm大小的薄片,75%酒精处理3~5 s,无菌水冲洗3遍,晾干置于WA培养基上于25℃恒温培养箱中培养。采集发病较轻且有霉层的果实,用接种针挑取少量霉层或刺入病斑处,在含50 mg/mL卡那霉素的WA培养基上进行划线,25℃培养恒温培养1~2 d,待长出菌丝后,将边缘菌丝转接到PDA培养基上。继续培养3 d后进行单孢分离,挑取少量菌丝放入装有无菌水的离心管中,振荡摇匀后将原液按10的倍数稀释3个梯度。每个梯度取50 μL液体涂布于WA培养基上,挑取单菌落到PDA培养基上,继续培养,将纯化好的菌株保存备用。
1.2.2 病原菌的形态学鉴定
活化保存菌株,在PDA培养基上观察病原菌菌落的形状、大小、颜色,菌丝生长形态、致密度、菌核等的特征。然后在显微镜(BX51,奥林巴斯,日本)下观察病原菌的菌丝、分生孢子和分生孢子梗等形态特征。镜下观察时,载玻片上滴无菌水,再用接种针挑取菌落边缘少量菌丝置于水中,盖上盖玻片,滤纸沿边缘吸去多余水分,制成临时玻片,观察并拍照记录。
1.2.3 病原菌的生长特性测定
菌株生长速度和产孢量的测定:挑选2株菌落形态有明显差异的病原菌活化,用5 mm打孔器在菌饼取样,接种于90 mm平皿中央(每个平皿含PDA培养基20 mL),每株菌接种3皿,25℃恒温培养,用十字交叉法测量培养7 d的菌落直径。测量完毕后的平皿中加入10 mL无菌水获得分生孢子液,用血球计数板计算分生孢子数量。每组试验重复3次。
1.2.4 病原菌的致病力测定
用72孔穴盘培育番茄育苗,幼苗移栽56 d后,挑选粗细均匀的健康茎秆作为接种材料,表面消毒后用灭菌牙签刺出伤口,取培养7 d的病原菌菌饼(直径5 mm),菌丝面朝里贴在伤口上,以不接菌的PDA培养基作为空白对照,用保鲜膜包裹伤口防止菌饼掉落,置于塑料盒中25℃保湿培养。待第5盘坐果时,挑选2~3盘直径约8 cm青果作为接种材料,果面消毒后,用灭菌牙签刺出伤口,接菌方法同茎秆接菌。待出现水浸状病斑时,采集样本进行病原菌的再分离,分离方法同1.2.1。
1.2.5 病原菌的分子鉴定
采用真菌DNA提取试剂盒(18812ES50,翌圣生物科技股份有限公司)提取病原菌基因组DNA。将纯化后的菌株接种到PDA培养基上,25℃恒温培养7 d后收集菌丝,按照真菌DNA提取试剂盒的说明书提取菌株基因组DNA,ddH2O溶解后于-20℃保存备用。利用真菌内转录间隔区(internal transcribed spacer,ITS)通用引物(ITS1/ITS4)对菌株基因组DNA进行PCR扩增[9]和测序,引物合成和扩增产物测序均由北京厚生博泰科技有限公司完成。
PCR 反 应 体 系 (50 μL):2 ×EasyTaq PCR SuperMix(AS111,翌圣生物科技股份有限公司)25 μL、引物对 ITS1/ITS4(5 μmol/L)各 2 μL、DNA模板(100 ng/μL)2 μL、ddH2O 1 μL。PCR 反应程序:94℃预变性5 min;94℃变性45 s,55℃退火40 s,72℃延伸40 s,35个循环;最后72℃延伸10 min。取5 μL PCR产物经1.0%琼脂糖凝胶电泳检测,剩余产物送往北京厚生博泰科技有限公司测序。
将测序结果在NCBI网站(http://www.ncbi.nlm.nih.gov/BLAST/)上进行比对,根据比对结果从GenBank数据库中下载同源性较高的序列,与自测序列进行比对和修饰,以核盘菌属(Sclerotinia sclertiorum)作为外群,应用DNAMAN软件中Maximum likelihood算法构建系统发育树。
2 结果与分析
2.1 田间症状
北方日光温室番茄越冬茬和早春茬容易发生番茄灰霉病,一般从12月到翌年3月是发病高峰期。番茄灰霉病发生在全生长期,中后期较严重,可同时为害叶片、茎秆、花、果实(图1)。叶片先从叶缘尖端开始发病,病斑呈典型“V”字形,并向内轮纹状扩展延伸,湿度大时病斑处会长出丝状霉层。花期是侵染高峰期,病原菌侵染后残留在花瓣或柱头上,继而侵染果柄、绿果、果面,造成落花、落果。青果染病后,果面呈灰白色,软腐,病斑近圆形,果实病部长出大量灰色霉层,后期在霉层上还会长出黑色不规则颗粒状的菌核。茎部侵染时,先呈现水浸状小病斑,逐渐发展为长椭圆形,湿度大时出现灰色霉层。严重时病部茎秆干枯,病部以上失水、枯死。

图1 番茄灰霉病田间症状Figure 1 The symptoms of tomato gray mold in fields
2.2 病原菌的分离与纯化
病样果实和茎秆采自内蒙古自治区呼和浩特市根堡村基地、内蒙古自治区农牧业科学院试验地、乌兰察布市冷凉蔬菜院士工作站试验地的越冬茬设施番茄种植棚。利用常规组织分离法对病样进行病原菌分离,在果实上分离到4株菌,编号为G1~G4,茎秆上分离到3株菌,编号为JW1~JW3。单孢分离后获得纯培养,置于4℃保存待用。
2.3 病原菌的形态学鉴定
通过观察菌株的菌落形态和显微镜下形态学的观察对分离物进行形态学鉴定。所有供试菌株的菌落近圆形,边缘整齐,菌丝呈放射状(图2A和图2E)。以菌株G4和JW1为例,菌丝初为灰白色丝绒状,后期颜色加深,培养10 d时,菌株G4的菌丝开始成团隆起,逐渐有黑色素产生,到培养15 d时,形成大量黑色菌核(图2B);菌株JW1在培养12 d时才有少数菌丝团隆起,到培养15 d时,仅在培养皿边缘有黑色素产生(图2F)。经显微镜观察,菌株G4和JW1分生孢子形态相似,均为无色、单孢、椭圆形或卵圆形(图2D和图2H),分生孢子梗丛生,灰色,有隔膜,顶端分支(图2C和图2G)。根据形态学鉴定结果,确定所有分离菌株均为半知菌亚门,葡萄孢属(Botrytis spp.)真菌。
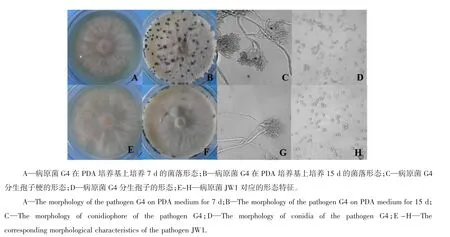
图2 病原菌的形态学鉴定Figure 2 Morphology identification of the pathogens
2.4 病原菌的生长特性测定
根据形态学鉴定结果,选取菌落形态差异明显的菌株G4和菌株JW1分别测定生长速度和产孢量,由图3可知,在PDA培养基上菌株JW1的生长速度明显快于菌株G4,到培养7 d时,菌株JW1几乎长满整个培养皿,菌落直径为84.24 mm,而菌株G4的菌落直径为76.14 mm,二者存在显著差异(P<0.05)。用血球计数板测定2个菌株分生孢子的数量,菌株JW1的产孢量为3.05×107个/mL,菌株G4的产孢量为3.47×107个/mL,2株菌的产孢量没有显著性差异(P>0.05)。

图3 病原菌的生长速度和产孢量Figure 3 The growth speed and conidia amount of the pathogens
2.5 病原菌的致病性测定
选取菌株G4和菌株JW1,根据科赫氏法则对番茄品种“普罗旺斯”的茎秆和果实进行接种(图4)。接种3 d后,离体茎秆和果实上均出现病斑,病斑早期呈现水浸状,逐渐向外扩展,中心软腐状,后期茎秆和果实的病斑边缘处均产生灰色菌丝。对发病茎秆和果实进行病菌再分离,得到了相同的病原物,表明分离获得的灰葡萄孢菌是引起番茄灰霉病的病原菌。
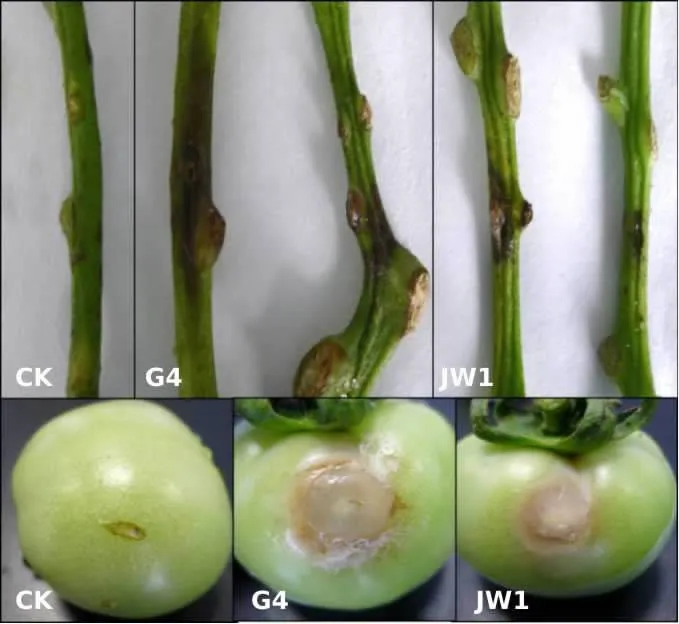
图4 菌株G4和JW1接种番茄茎秆和果实后的症状Figure 4 The symptoms of tomato stems and fruits after inoculation with G4 and JW1 strains
2.6 病原菌的分子生物学鉴定
利用真菌通用引物ITS1/ITS4对分离菌株ITS序列进行PCR扩增,所有分离菌株均扩增出序列大小约为530 bp的条带,将ITS测序结果在NCBI网站上进行BLAST比对分析(图5)。结果表明,所有分离得到的病原菌与灰葡萄孢菌(Botrytis cinerea)序列的同源性均在99%以上(表1)。从GenBank数据库中下载已报道的B.cinerea序列(序列登录号为KP151610),以核盘菌(Sclerotinia sclerotiorum,序列登录号为KM272352)作为外群,利用DNAMAN软件构建基于ITS序列的系统发育树(图6),所有菌株均与B.cinerea聚为一类,证明分离菌株为灰葡萄孢菌。
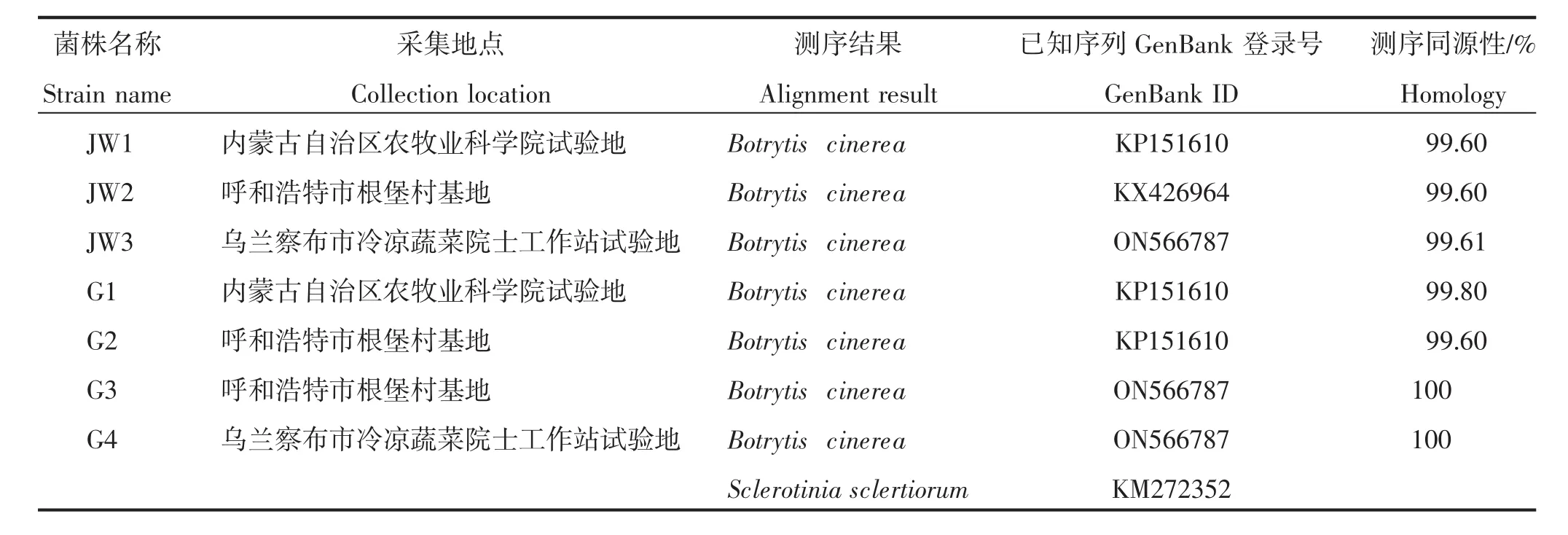
表1 番茄灰霉病病原菌Table 1 The pathogens of tomato gray mold
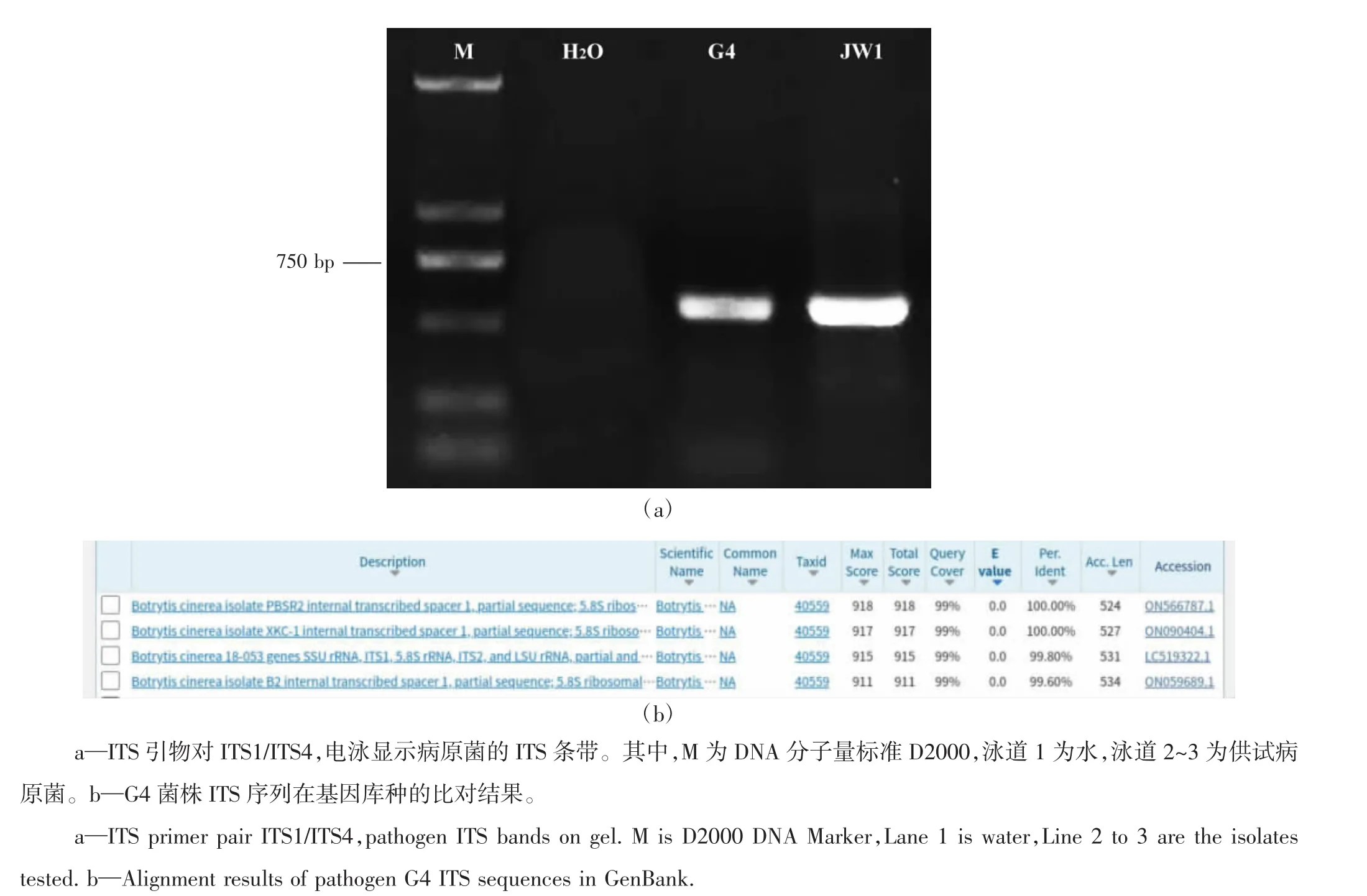
图5 病原菌的分子鉴定Figure 5 Molecular identification of pathogens

图6 基于ITS序列的系统发育树Figure 6 Phylogenetic tree based on ITS sequence
3 结论与讨论
番茄灰霉病是当前番茄生产上重要的世界性病害,尤其以设施栽培条件下发生较重。引起番茄灰霉菌的病原菌为灰葡萄孢菌(Botrytis cinerea),其寄主范围广,可以侵染 586属 1 400种植物,包含多种粮食作物、经济作物、蔬菜和观赏植物[10]。本试验从呼和浩特市和乌兰察布集宁地区设施番茄种植地区采集分离到的7株灰霉病菌株,通过形态学结合分子生物学鉴定均为灰葡萄孢菌(B.cinerea),与董友磊[11]、石晓红等[12]和田志革等[13]的研究结果一致,他们都对当地的设施番茄灰霉病进行分离鉴定,结果都确定灰葡萄孢菌是引起番茄灰霉病的病原真菌,而LI等[14]还从加工番茄病果中分离到一株灰霉病病原菌,分子鉴定为富氏葡萄孢盘菌(Botryotinia fuckeliana),是灰葡萄孢菌的有性世代。这说明番茄灰霉病已经逐步扩展到露地番茄,但是致病菌存在一定的差异。在分离获得的7株菌中,菌株JW1、G4在菌落形态上差异较大,菌株JW1菌丝旺盛,很少产生菌核,而菌株G4菌丝放射状明显,培养至10 d左右开始产生大量黑色菌核。据国内外学者的研究表明[15-18],B.cinerea在 PDA培养基上的形态特征表现出丰富的多样性,可分为菌丝型、孢子型和菌核型3种类型[15],所占比例分别是 39%、28%和33%,没有明显的优势类型[19]。本试验比较了两种形态菌株的生长特性和致病性,产孢量没有显著差异,在人工接种茎秆和果实时发病率均为100%。
在内蒙古地区对设施番茄灰霉病缺乏系统的调查和研究,本试验在采样过程中发现,番茄灰霉病在内蒙古多个地区发生较为普遍,日光温室越冬茬和早春茬栽培期危害严重,塑料大棚春夏茬也有少量发病情况,一旦有连阴天或降温天,温度低、湿度大,病害就会大范围流行。因此,明确番茄灰霉病的病原菌,获得致病菌株,可以用于防治设施番茄病害药剂筛选、品种抗性鉴定的等进一步研究,对掌握病害发生规律和研究病害防治措施具有重要意义。
