川芎嗪对银屑病小鼠皮损内TNF-α、IL-17、VEGF表达的影响
2023-07-06朱玉婷晏文应理晟王进京
朱玉婷,晏文△,应理晟,王进京
银屑病是一种常见且易复发的慢性、炎症性皮肤病,全世界有超过1.25亿人受累[1]。目前,银屑病的确切病因及发病机制尚未完全明确,但多数研究认为肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)[2]、白细胞介素(interleukin,IL)-17[3]及血管内皮生长因子(vascular endothelial growth factor,VEGF)[4]等细胞因子在其发生、发展中起关键作用。川芎嗪(tetramethylpyrazine,TMP)是从川芎中提取的一种生物活性单体,属酰胺类生物碱。研究显示,TMP可降低TNF-α、IL-17、VEGF 等细胞因子的表达,对多种内科疾病均有疗效[5-7]。因此,笔者推测川芎嗪对银屑病的治疗可能有类似的作用机制。本研究以细胞因子TNF-α、IL-17、VEGF 为切入点,探讨TMP对咪喹莫特乳膏诱导的小鼠银屑病样皮损的治疗作用机制,以期为川芎嗪治疗银屑病提供动物实验依据,为银屑病的治疗提供更多的选择。
1 材料与方法
1.1 材料 SPF级BALB/c小鼠,雌雄各15只,体质量19~22 g,7周龄,购自湖南斯莱克景达实验动物有限公司[动物生产许可证号:SCXK(湘)2019-0004],动物饲养、实验操作均在遵义医科大学动物实验中心进行[动物使用许可证号:SYXK(黔)2018-0006]。实验动物处置严格遵循“3R”原则,实验获得遵义医科大学实验动物伦理委员会批准[KLLY(A)-2020-068]。实时荧光定量PCR仪(瑞氏Roche公司);光学显微镜(日本NIKON 公司)。5%咪喹莫特乳膏(四川明欣药业有限公司,国药准字H20030129,批号:40200907);注射用盐酸川芎嗪(平光制药股份有限公司,国药准字H20031302,批号:202007031);PrimeScriptTMRT reagent 试剂盒、TB Green Premix Ex Taq Ⅱ(日本TaKaRa 公司);逆转录实时荧光定量PCR(qRT-PCR)引物(北京擎科生物科技有限公司);兔抗鼠TNF-α、IL-17、VEGF单克隆抗体(北京博奥森生物技术有限公司);DAB 染色液试剂盒(福州迈新生物技术开发有限公司)。
1.2 研究方法
1.2.1 动物处理 将30只BALB/c小鼠适应性喂养1周后剔除其背部4 cm×2 cm 区域毛发,随机分为正常组、模型组、低TMP组、中TMP组、高TMP组,每组6只。正常组涂抹凡士林62.5 mg/d,连续7 d。模型组及TMP各组涂抹5%咪喹莫特乳膏62.5 mg/d,连续7 d,涂抹3 d 后背部皮肤出现明显炎症表现,形成银屑病样皮损。第4 天开始,低、中、高TMP 组分别予腹腔注射20、40及100 mg/kg盐酸川芎嗪注射液[8],正常组及模型组注射等量生理盐水,连续用药9 d。每天拍摄各组小鼠皮损照片,通过银屑病皮损面积和严重程度指数(PASI)评分对皮损严重程度进行评估(从红斑、浸润、鳞屑3个方面进行评分,分值0~4 分,0=无皮损;1=轻度;2=中度;3=重度;4=极重度)。药物干预结束,取适量小鼠背部皮损2份,一份用于病理诊断及免疫组化检测;一份用于qRT-PCR检测。
1.2.2 qRT-PCR 法检测小鼠皮损内TNF-α、IL-17、VEGF mRNA 的表达 根据试剂说明,提取各样本总RNA,逆转录合成cDNA,配制扩增反应体系,于实时荧光定量PCR仪上进行扩增,引物序列见表1。扩增条件:95℃30 s;95 ℃5 s,60 ℃20 s,65 ℃15 s,40个循环。采用2-ΔΔCt法计算目的基因的相对表达量。

Tab.1 The primer sequences for qRT-PCR表1 qRT-PCR引物序列
1.2.3 皮损组织病理学检测 所有皮损组织用10%福尔马林溶液固定,常规石蜡包埋并切片,HE 染色,光学显微镜下观察皮损组织学改变。
1.2.4 免疫组化染色检测皮损内TNF-α、IL-17、VEGF 的蛋白表达 所有皮损组织切片经脱蜡、水化,抗原修复,阻断内源性的过氧化物酶,TNF-α(1∶500)、IL-17(1∶500)、VEGF(1∶300)一抗孵育,二抗孵育,DAB 显色,苏木素复染,脱水、透明、封片,光学显微镜观察并采集图片,采用Image Pro Plus 6.0软件进行半定量分析。
1.3 统计学方法 采用SPSS 23.0软件进行数据分析。符合正态分布的计量资料以表示,qRT-PCR 原始数据予对数转换后符合正态分布,多组间均数比较采用单因素方差分析,组间多重比较使用LSD-t法(方差齐)或Tamhane's T2(方差不齐)。以P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠皮损表现 TMP 注射第1 天(涂抹咪喹莫特乳膏3 d 后),小鼠背部皮肤呈现明显炎症反应(明显红斑、鳞屑);随着药物干预时间延长,模型组小鼠皮损逐渐加重,呈现典型银屑病样皮损表现,而TMP 组小鼠皮损逐渐减轻。TMP 注射9 d 后,模型组小鼠背部仍可见明显红斑、鳞屑,TMP各组小鼠背部红斑、鳞屑较模型组明显减少,中、高TMP组小鼠背部红斑减轻尤为明显,未见明显鳞屑,见图1。皮损PASI 评分结果显示:TMP 干预3、6 及9 d,与正常组比较,仅9 d 时高TMP 组与正常组的PASI 评分差异无统计学意义(P>0.05),3 d时,模型组与TMP各剂量组PASI 评分差异无统计学意义(P>0.05),6 d时,模型组与低、中及高TMP组PASI评分依次降低(P<0.05),9 d时,中TMP 组与低、高TMP 组PASI评分差异无统计学意义(P>0.05),见图2。

Fig.1 General view of skin lesions in four groups of mice图1 各组小鼠皮损大体观

Fig.2 Comparison of PASI scores of skin lesions between the five groups of mice图2 各组小鼠背部皮损PASI评分比较
2.2 各组皮损内TNF-α、IL-17、VEGF mRNA 相对表达水平比较 与正常组比较,模型组TNF-α、IL-17、VEGF mRNA相对表达水平均升高(P<0.05);与模型组比较,中、高TMP 组的TNF-α mRNA 相对表达水平降低(P<0.05),低、中、高TMP 组的IL-17 mRNA 相对表达水平也降低(P<0.05),高TMP 组VEGF mRNA 相对表达水平降低(P<0.05);与低TMP 组相比,中、高TMP 组的TNF-α、IL-17 mRNA相对表达水平降低(P<0.05),高TMP 组VEGF mRNA相对表达水平降低(P<0.05);与中TMP组相比,高TMP组IL-17及VEGF mRNA相对表达水平降低(P<0.05),见表2。
Tab.2 Comparison of relative expression levels of TNF-α,IL-17 and VEGF mRNA in skin lesions between the five groups of mice表2 各组皮损内TNF-α、IL-17、VEGF mRNA相对表达水平比较(n=6,)
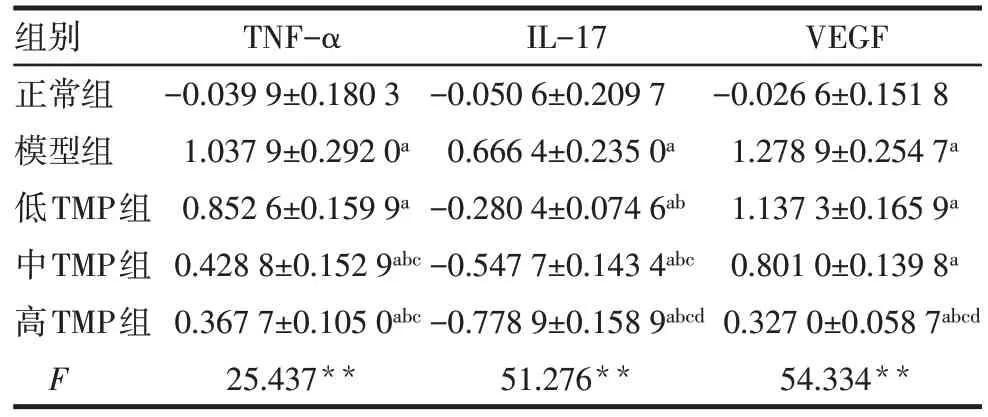
Tab.2 Comparison of relative expression levels of TNF-α,IL-17 and VEGF mRNA in skin lesions between the five groups of mice表2 各组皮损内TNF-α、IL-17、VEGF mRNA相对表达水平比较(n=6,)
**P<0.01;a与正常组比较,b与模型组比较,c与低TMP 组比较,d与中TMP组比较,P<0.05;表中数据为原始数据经对数转换后所得。
组别正常组模型组低TMP组中TMP组高TMP组F TNF-α-0.039 9±0.180 3 1.037 9±0.292 0a 0.852 6±0.159 9a 0.428 8±0.152 9abc 0.367 7±0.105 0abc 25.437**IL-17-0.050 6±0.209 7 0.666 4±0.235 0a-0.280 4±0.074 6ab-0.547 7±0.143 4abc-0.778 9±0.158 9abcd 51.276**VEGF-0.026 6±0.151 8 1.278 9±0.254 7a 1.137 3±0.165 9a 0.801 0±0.139 8a 0.327 0±0.058 7abcd 54.334**
2.3 各组皮损的病理表现及皮损中TNF-α、IL-17、VEGF蛋白表达
2.3.1 HE 染色 模型组小鼠的皮损组织呈现为典型的银屑病样病理改变,表皮出现过度角化,其间可见少量角化不全,颗粒层减少,棘层肥厚,表皮突向下方伸长;而低、中及高TMP 组小鼠皮损的银屑病样病理改变较模型组依次减轻,见图3。
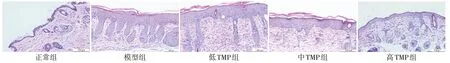
Fig.3 HE staining results of skin lesions in five groups(×200)图3 各组皮损HE染色结果(×200)
2.3.2 各组TNF-α、IL-17、VEGF 蛋白相对表达水平比较 与正常组比较,TNF-α、IL-17、VEGF 在模型组及低、中、高TMP 组皮损的表皮细胞胞浆内均有表达。与模型组比较,中、高TMP 组TNF-α 相对表达水平降低(P<0.05),低、中、高TMP 组IL-17、VEGF 相对表达水平降低(P<0.05);与低TMP 组比较,高TMP组TNF-α、VEGF相对表达水平降低(P<0.05),中、高TMP 组IL-17 相对表达水平降低(P<0.05);与中TMP 组比较,高TMP 组VEGF 相对表达水平降低(P<0.05),见图4、表3。

Fig.4 Immunohistochemical results of TNF-α,IL-17 and VEGF in skin lesions of different groups(×200)图4 各组皮损内TNF-α、IL-17、VEGF免疫组化结果(×200)
Tab.3 Comparison of relative expression levels of TNF-α,IL-17 and VEGF proteins in skin lesions between the five groups of mice表3 各组皮损内TNF-α、IL-17、VEGF蛋白相对表达水平比较 (n=6,IOD,)

Tab.3 Comparison of relative expression levels of TNF-α,IL-17 and VEGF proteins in skin lesions between the five groups of mice表3 各组皮损内TNF-α、IL-17、VEGF蛋白相对表达水平比较 (n=6,IOD,)
**P<0.01;a与正常组比较,b与模型组比较,c与低TMP组比较,d与中TMP组比较,P<0.05。
组别正常组模型组低TMP组中TMP组高TMP组F TNF-α 0.004±0.002 0.019±0.003a 0.017±0.003a 0.014±0.001ab 0.013±0.001abc 98.959**IL-17 0.002±0.001 0.022±0.001a 0.015±0.001ab 0.009±0.001abc 0.008±0.001abc 718.474**VEGF 0.001±0.001 0.021±0.003a 0.019±0.001ab 0.012±0.001ab 0.008±0.001abcd 367.192**
3 讨论
银屑病主要的组织病理学表现为表皮增生、血管生成增加及免疫细胞浸润[9]。目前其具体发病机制尚不明确,多数研究认为银屑病发生、发展的核心主要是T 细胞,尤其是辅助性T 细胞所介导的免疫反应[10]。当机体免疫系统紊乱时,T细胞、树突状细胞等多种免疫细胞被激活,同时分泌TNF-α、IL-17、干扰素-1(interferon-1,IFN-1)等细胞因子,在多种细胞因子的共同作用下,角质形成细胞(keratinocyte,KC)过度增殖并释放VEGF、血管生成素等来促进真皮浅层血管新生,而KC的增殖又可促进更多炎性细胞因子的分泌,从而放大机体内的炎症级联反应,最终导致银屑病的发生。当前,银屑病的治疗药物多以西药为主,短期疗效虽佳,但无法根治。近年来,生物制剂对银屑病的治疗显示出更好的疗效,但因价格昂贵且需长期维持治疗同样限制了其临床应用,且安全性及长期疗效亦不确定[11]。因此,进一步研究银屑病的发病机制,寻找更加安全、有效的治疗药物仍是皮肤科学界的研究重点。相对于西药及生物制剂的应用限制,中药治疗银屑病有其独特的优势。
TMP系从中药川芎中分离提纯所得到的一种酰胺类的生物碱[12]。研究证实,其具有扩张血管及抑制血小板聚集[13]、抗肿瘤[14]、清除氧自由基及抑制缺血再灌注损伤[15]、抗炎[16]等多种药理作用。长久以来,TMP临床上多被用于治疗心脑血管疾病[17-18]。尽管近年来其在肝脏[19]、肺[20]、脊髓损伤[21]等疾病中的治疗作用也逐渐被报道,但在皮肤疾病中,尤其是对银屑病的治疗作用仍鲜见报道。现有研究表明,TMP 可通过下调TNF-α[22]、IL-17[23]、VEGF[24]等多种细胞因子水平,从而减轻机体炎性损伤,达到治疗疾病的作用。本研究通过外用咪喹莫特乳膏成功诱导小鼠银屑病样皮损,利用TMP 进行治疗后发现,TMP 组小鼠的银屑病样皮损的大体表现及组织病理学表现均较模型组明显好转,且随着用药时间的延长,低、中及高TMP 组小鼠背部皮损PASI 评分亦呈逐渐降低趋势。此外,模型组小鼠皮损内TNF-α、IL-17 及VEGF 的mRNA 及蛋白表达水平较正常组均升高,而低、中、高TMP组的表达量较模型组呈降低趋势,证实TMP尤其是高TMP组可显著下调小鼠银屑病样皮损内TNF-α、IL-17、VEGF 的表达水平。
综上所述,TMP 可通过降低小鼠银屑病样皮损内的TNF-α、IL-17、VEGF 的表达水平,抑制皮损的炎症反应,缓解其病情严重程度;其中,高剂量组治疗效果尤为显著。
