棉田杂草龙葵种子萌发对温度的生理响应
2023-07-06李龙龙马子晴陈召霞黄兆峰黄红娟魏守辉
李龙龙,马子晴,陈召霞,黄兆峰,黄红娟,魏守辉
(中国农业科学院植物保护研究所/ 植物病虫害综合治理全国重点实验室,100193 北京)
龙葵(Solanum nigrumL.)是茄科一年生草本植物,广泛分布于欧洲、亚洲和美洲的温带和热带地区,主要以种子进行繁殖和传播[1]。龙葵对农产品产量和质量的影响在多种作物中都有报道,目前已成为我国棉田恶性杂草[2-4]。有效控制龙葵对作物优质高产至关重要,在现有的杂草控制措施中,机械和化学除草是田间最常用的方法,而这些控制方法成功的关键取决于杂草的消长动态以及是否达到最大出苗数量[5]。因此,为提高杂草防除的有效性,明确龙葵的萌发出苗规律是对其进行防控的重要前提。
种子萌发是由多种酶催化的生理生化代谢过程,而酶活性与温度密切相关,因此温度是影响种子萌发的重要因素之一。研究龙葵种子萌发与温度的关系对预测其出苗时间非常关键。前人研究表明,不同龙葵种群的种子萌发对温度的响应不同,其适宜萌发的温度范围存在较大差异。其中:瑞典龙葵种群的萌发温度范围为13~34 ℃,适宜温度范围为26~30 ℃[6];我国河北龙葵种群的萌发温度范围为15~30 ℃,最适温度为25 ℃[7];印度龙葵种群的适宜萌发温度范围为26~30 ℃[8];而以色列龙葵种群萌发的温度范围为20~35 ℃,适宜温度为25~30 ℃[9]。Ma 等[10]通过研究我国北方6 个龙葵种群种子萌发对温度的响应,发现各龙葵种群种子萌发的温度范围为15~35 ℃,其中新疆、吉林和黑龙江种群的最适萌发温度为30 ℃,而内蒙古、河南和辽宁种群的最适萌发温度分别为25 ℃、20 ℃和15 ℃。上述研究均以萌发率为指标来分析龙葵的萌发与温度的关系,并没有探讨龙葵种子生理生化特征的变化。因此,本研究拟通过测定不同温度条件下萌发龙葵种子的抗氧化酶活性、淀粉酶(amylase,AMS)活性及丙二醛(malondialdehyde,MDA)含量等生理指标,探究温度对龙葵种子萌发的影响,以揭示其种子萌发对温度的生理响应机理,为龙葵的萌发出苗预测提供依据。
1 材料与方法
1.1 供试材料
供试的6 个龙葵种群种子于2018 年、2019年采自新疆、内蒙古、黑龙江、吉林、辽宁和河南(表1)。田间采集已完全成熟的黑色龙葵果实,于室内将浆果搅碎,用去离子水彻底冲洗种子1~2 min,然后在通风干燥条件下晾干,装入牛皮纸袋中于室温条件下保存备用。

表1 龙葵种群种子的采集信息Table 1 Information on the seed collection of Solanum nigrum populations
1.2 试验设计
用质量分数为2%的NaClO 溶液对大小和颜色均匀、籽粒饱满的6 个龙葵种群的种子进行消毒,浸泡10 min 后用无菌水冲洗干净。将消毒后的种子均匀排列于铺有2 层滤纸、直径为9 cm的一次性培养皿中,每个培养皿中放40 粒种子,然后加入5 mL 无菌水,用封口膜密封后放入智能人工气候培养箱(宁波江南仪器厂)中培养,每个处理3 次重复。培养期间,根据培养皿失水情况适当补充无菌水,使种子保持湿润状态。各处理分别设置培养箱恒温为10、15、20、25、30、35、40 ℃,光照时间/ 黑暗时间为12 h/12 h,相对湿度为50%。培养48 h 后,每皿中选择大小一致、未萌发的种子(胚根长度<1 mm)作为样品。
1.3 测定方法
1.3.1抗氧化酶活性和MDA 含量。称取约0.1 g龙葵种子,加入1 mL 提取液进行冰浴匀浆;8 500 r·min-1、4 ℃离心10 min,取上清,置冰上待测。参照超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)、过氧化氢酶(catalase,CAT)、MDA 试剂盒(北京索莱宝科技有限公司)说明书进行操作和反应。用紫外-可见分光光度计测定吸光值,并计算酶活性和MDA 含量。以上所有生理生化指标的测定均为3 次生物学重复。
1.3.2淀粉酶活性。称取约0.1 g 龙葵种子,液氮下研磨成粉末,加入pH 为2 的磷酸缓冲液9 mL混匀,转移至离心管中,5 200 r·min-1、4 ℃离心15 min,取上清液为待测样品酶液。采用酶联免疫法测定淀粉酶活性,设3 次生物学重复。
1.4 数据统计与分析
在Microsoft Excel 2019 中整理数据,用SPSS 19.0 软件对所有数据进行方差分析,用Tukey 检验进行多重比较(0.05 水平),用Origin 2018 软件进行绘图。
2 结果与分析
2.1 温度对龙葵种子SOD 活性的影响
SOD 能清除种子萌发过程中产生的活性氧,同时生成过氧化氢(H2O2),控制膜脂过氧化[11]。由图1 可以看出,6 个龙葵种群种子的SOD 活性随着温度的升高表现出先升高后降低的趋势。10 ℃时,各种群龙葵种子的SOD 活性均较低。在10~35 ℃范围内,随着温度上升,6 个种群龙葵种子的SOD 活性逐渐升高;35 ℃时,各种群龙葵种子的SOD 活性达到峰值,其中LN2209 种群SOD活 性 最 高,NMG1704、HLJ2134、JL1697、HN2160次之,XJ1600 的SOD 活性最低。但当温度上升至40 ℃时,各种群龙葵种子的SOD 活性骤降,其中XJ1600 的SOD 活性最高,而LN2209 的SOD 活性最低。
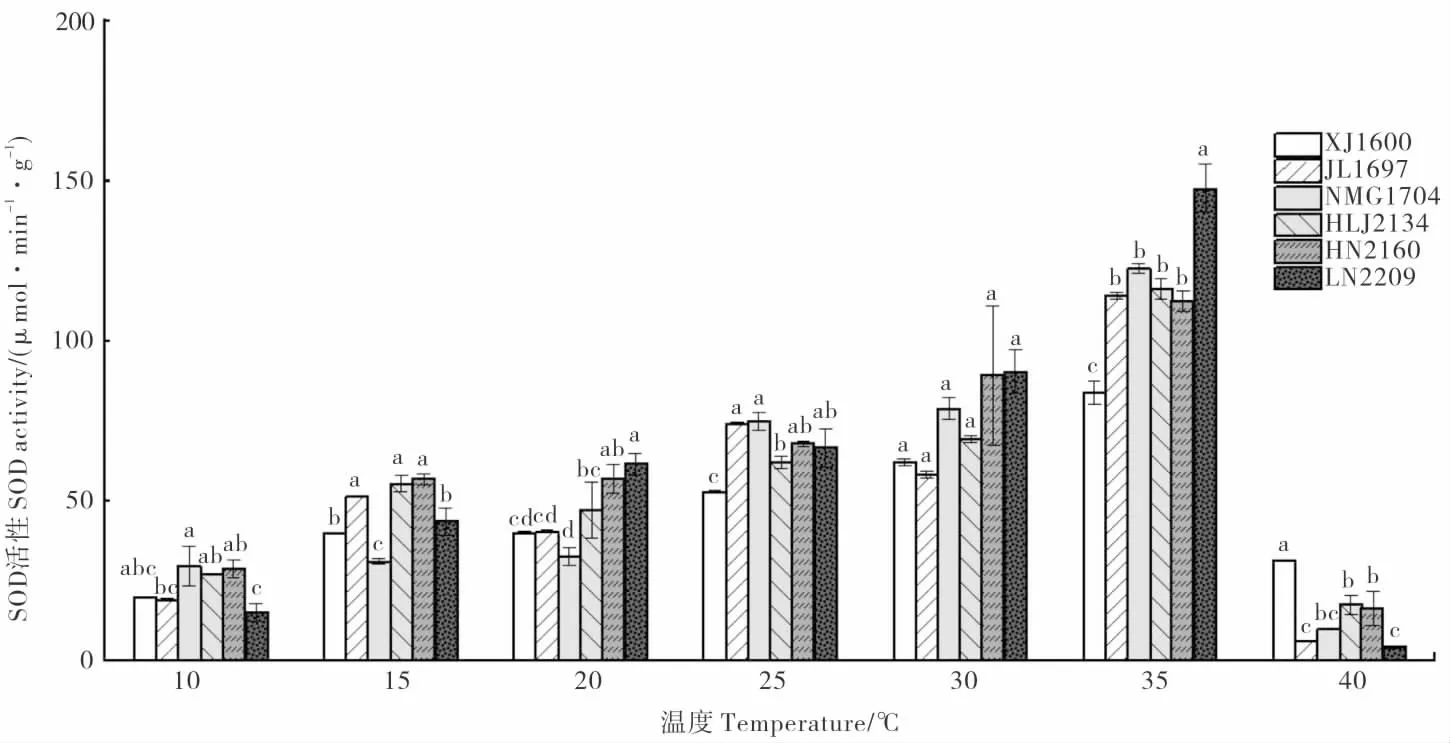
图1 不同温度处理龙葵种子SOD 活性的比较Fig.1 Comparison of the SOD activity in Solanum nigrum seeds treated by different temperatures
2.2 温度对龙葵种子POD 活性的影响
POD 能催化H2O2分解,并与SOD 等组成过氧化防御系统,使种子萌发过程中活性氧维持在正常水平[12]。从图2 可以看出,随着温度的增加,POD 活性先略有增加后大幅降低。10~25 ℃处理的各种群龙葵种子的POD 活性逐渐增加,但增加幅度较小。25~40 ℃时,各种群龙葵种子的POD 活性变化加剧。其中,HN2160 和LN2209 在30 ℃时POD 活性大幅升高并达到峰值,35 ℃时POD 活性大幅下降。XJ1600、HLJ2134、JL1697 和NMG1704 在35 ℃时的POD 活性大幅升高并达到峰值。温度上升至40 ℃时,JL1697、NMG1704、HN2160 和LN2209 的POD 基本失活,而XJ1600 和HLJ2134 的POD 仍有一定活性。
2.3 温度对龙葵种子CAT 活性的影响
CAT 是细胞内H2O2的重要清除剂,H2O2的含量越高,CAT 对其分解就会越快,其活性可以反映种子萌发过程中抵抗逆境胁迫的能力[13]。在不同温度下,各种群龙葵种子的CAT 活性不同,随着温度的增加,CAT 活性先增加后降低(图3)。XJ1600、NMG1704、HLJ2134 和HN2160 的CAT 活 性 在35 ℃时最高,JL1697 和LN2209 的CAT 活性在30 ℃时最高。40 ℃时,各种群龙葵种子的CAT 活性较35 ℃时明显降低,且种群间差异不显著。

图3 不同温度处理龙葵种子CAT 活性的比较Fig.3 Comparison of the CAT activity in Solanum nigrum seeds treated by different temperatures
2.4 温度对龙葵种子中MDA 含量的影响
MDA 是膜脂过氧化产物,其含量的变化能够反映种子萌发时细胞膜受损伤程度[14]。由图4所示,随着温度的升高,龙葵种子中MDA 含量发生明显变化,总体呈现先下降后上升的趋势,不同种群龙葵种子的MDA 含量出现峰值的温度不 同。XJ1600、JL1697、NMG1704 和HLJ2134的MDA 含量在40 ℃时达到最高值,而HN2160和LN2209 的MDA 含量在35 ℃时达到最大值。高温胁迫可明显提高各种群龙葵种子的MDA 含量,说明各龙葵种群种子的膜脂过氧化水平均随温度胁迫程度增加而增加。与其他种群相比,HN2160 的MDA 含量波动幅度较大,说明该种群对温度较敏感。

图4 不同温度处理龙葵种子MDA 含量的比较Fig.4 Comparison of the MDA contents in Solanum nigrum seeds treated by different temperatures
2.5 温度对龙葵种子AMS 活性的影响
AMS 是种子萌发初期重要的水解酶,能促进小分子糖类物质的产生,从而为种子萌发和幼苗生长提供营养及能量[15]。除HLJ2134 外,其他种群龙葵种子的AMS 活性随温度的升高呈现先上升后下降的趋势 (图5)。XJ1600 和JL1697的AMS 活性在35 ℃时达到峰值。HN2160 的AMS 活性在10~20℃时较其他种群的高。与35℃时相比,40 ℃时,NMG1704 和HLJ2134 的AMS活 性 无 明 显 变 化,XJ1600、JL1697、HN216 0 和LN2209 的AMS 活性下降,但仍保持一定的活性。
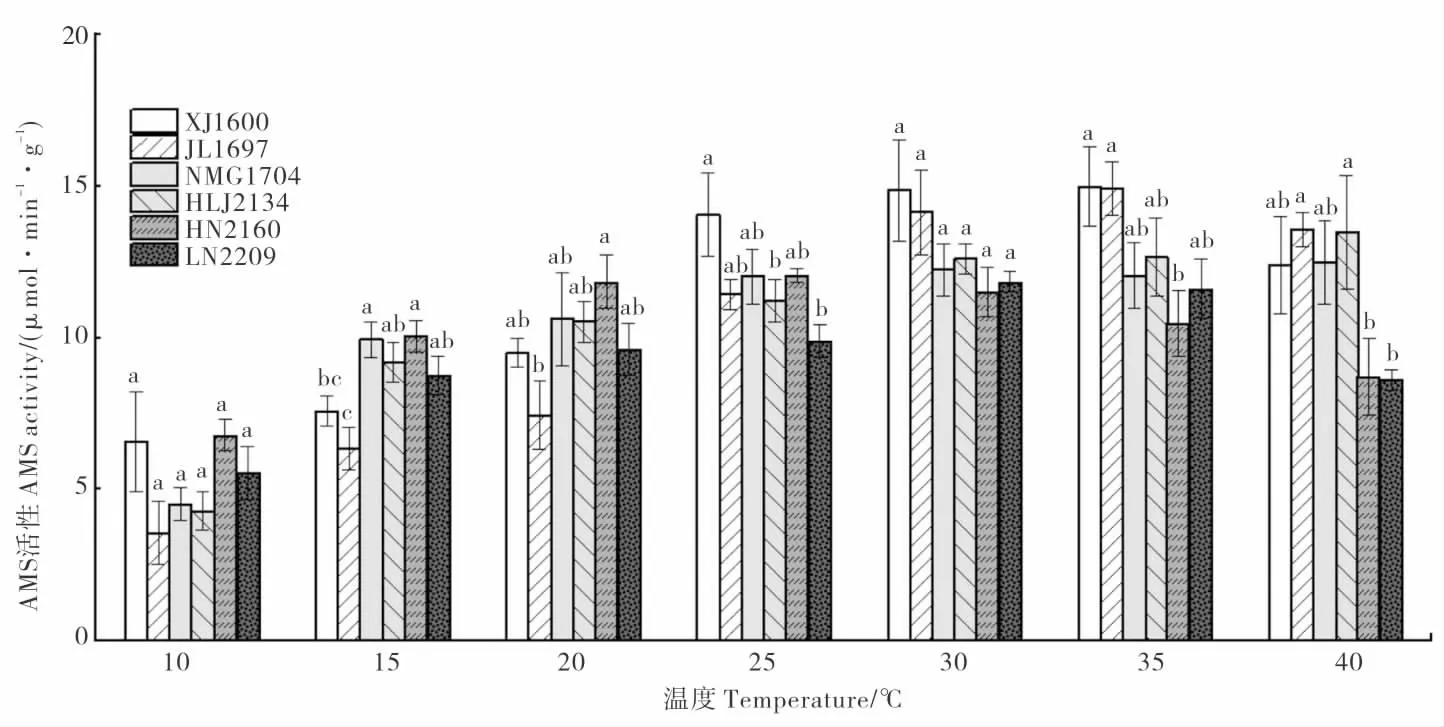
图5 不同温度处理龙葵淀粉酶(AMS)活性的比较Fig.5 Comparison of the amylase activity in Solanum nigrum seeds treated by different temperatures
3 讨论
3.1 温度对龙葵种子抗氧化酶活性的影响
温度的高低会影响种子内部酶的活性,进而影响种子萌发进程。当种子遭受环境胁迫时,萌发代谢受阻可导致活性氧大量积累,引起细胞膜脂过氧化,内部的活性氧清除系统包括酶促保护系统和非酶促保护系统会发挥作用,其中SOD、CAT、POD 等酶在自由基清除和过氧化物分解等方面起重要作用[16-19]。各龙葵种群抗氧化酶在某一温度达到峰值,说明此温度条件下其种子的酶促保护系统能发挥最大作用。前人研究表明,在高温胁迫下,植物耐热性越强,其抗氧化酶活性越高[20-23]。在高温(40 ℃)胁迫下,XJ1600 种群SOD 活性最高,JL1697 的SOD 活性最低;POD活性也以XJ1600 种群的最高,而JL1697、NMG1704、HN2160 和LN2209 的较低。由此可见,XJ1600 比其他种群耐热性更强。MDA 是膜脂过氧化产物,常被作为植物耐热性的重要生理指标。6 个龙葵种群种子MDA 含量随温度变化趋势表明,温度胁迫可显著增加龙葵种子中MDA 含量。与其他种群相比,HN2160 中MDA 含量在30~40 ℃波动幅度较大,说明该种群对高温较敏感。
3.2 温度对龙葵种子淀粉酶活性的影响
在种子萌发过程中,淀粉酶主要催化种子中淀粉的水解,其活性与种子萌发水平呈显著正相关[24]。本研究表明,温度显著影响龙葵种子淀粉酶活性。根据6 个龙葵种群种子的淀粉酶活性随温度变化趋势可知,XJ1600 萌发温度需求较高,而HN2160 萌发温度需求最低。Ma 等[10]发现,不同省(区)龙葵种子萌发温度差异与纬度有关,纬度高的地区萌发温度较高,这可能是龙葵对环境适应的结果。龙葵在高温(40 ℃)胁迫下,淀粉酶活性未出现明显下降,其原因可能是不同植物淀粉酶对高温的响应不同,如穇子淀粉酶的最高活性温度为45~50 ℃[25],大豆为40 ℃[26],白玉豆为30 ℃[27]。此外,还可能与高温的持续时间有关,在高温胁迫初期,淀粉水解产物(如可溶性糖)提高了植物细胞的渗透势,从而减轻高温胁迫造成的影响[28];随着胁迫持续进行,贮藏物质过快消耗,胚因得不到充足的营养而导致发育停止[27]。
4 结论
不同省(区)的6 个龙葵种群中,新疆种群(XJ1600)种子萌发温度需求高、耐热性强,而河南种群(HN2160)种子的萌发温度要求低,对热胁迫敏感。不同温度条件下龙葵种子内的生理指标变化,可以在一定程度上反映种子的萌发状况,进而明确不同种群种子的适宜萌发条件。这些研究结果为龙葵的萌发预测和监测提供一定依据,对棉田恶性杂草的精准防控具有重要意义。
