我国高寒旱地区源分离尿液碱性稳定化研究*
2023-07-05段文俊孙利利李继云徐康宁
段文俊,陆 茵,孙利利,卢 军,李继云,徐康宁
(1.北京林业大学环境科学与工程学院 北京市水体污染源控制技术重点实验室,北京 100083;2.北京国环清华环境工程设计研究院有限公司,北京 100084;3.清华大学环境学院,北京 100084)
1 引言
随着乡村振兴战略和绿色宜居村镇建设的实施,我国乡村地区的“厕所革命”持续推进,取得了重大进展,但是卫生厕所的覆盖区域仍然亟待提高,尤其是我国高寒旱地区,其农村卫生厕所的覆盖率较低。因为缺水和水管防冻问题,水冲厕在高寒旱地区农村改厕中的适用性降低,通常认为旱厕更具有适用性。源分离是强调从源头上实现尿液和粪便的分离式收集[1],一方面,尿液分离后会降低粪污含水率,有利于粪便堆肥化处理;另一方面,尿液中致病菌含量远低于粪便,适合于单独用作液体肥料,施肥的同时对于高寒旱地区土壤也有灌溉作用[2]。因此,源分离旱厕是一种非常具有应用潜力的技术选择。
在尿液存储过程中,尿素在微生物分泌的脲酶作用下极易水解,产生N和HC,同时促使pH 升高至9 左右[3],这会导致氨氮的挥发损失,损失量甚至可达75%以上,同时微生物的作用还会导致尿液臭味等问题[4]。这对于尿液用作液体肥料是十分不利的,尤其不利于在现代农业中开展资源化利用,因此,通过抑制尿素水解实现尿液稳定化是十分必要的[1,5]。已有的尿液稳定化方法主要通过投加酸性试剂[6]、碱性试剂[7]、氧化剂[8]或者温度调节[9]抑制微生物代谢和脲酶活性,从而减少尿素水解,其中碱性稳定化因其更具有实际应用前景而成为研究热点。Randall 等[10]提出了利用Ca(OH)2稳定尿液的新方法,发现当温度保持在一定范围内,并提供至少10 g/L 的Ca(OH)2,可以防止尿素水解。Dutta 等[11]则进一步引入了更廉价的林木灰与Ca(OH)2以1 ∶1 比例混合作为碱性剂,保持pH 在10 以上可以抑制尿素水解,并最终通过风干使尿液中营养元素保留在固体中。之后的研究则集中在以蒸发干化为目标的碱性化试剂、温度、风速等参数的优化[7,12-13],进而构建了一个中试系统并在芬兰开展了效果测试[14]。目前已有的研究通常以得到干化后的固体产品为目标,需要升温和通风促进蒸发干化,这存在一定的能耗,同时也会导致尿液中水分的浪费,并不适合我国高寒旱农村地区改厕的实际情况。同时,鉴于蒸发干化时间通常在20 d 以内,而且已有研究中尿液稳定化目标时间也较短,但是,以稳定化尿液作为液体肥施用时需要符合农业耕作时令,这也意味着需要实现长期甚至长达半年的稳定化效果,同时也需要评价稳定化尿液施用后对土壤盐碱化存在的潜在风险。
因此,本研究以尿液碱性稳定化后作液体肥使用为目标,全面研究尿液碱性稳定化的关键要素,着重研究长期稳定化的优化条件,并筛选当地适宜的廉价碱性试剂,分析稳定化尿液施用后土壤潜在的盐碱化风险,为我国高寒旱地区尿液稳定化应用提供技术支撑。
2 材料与方法
2.1 模拟尿液与真实尿液
为保证不同批次试验之间数据结果的可比性,选择使用模拟尿液[15]作为研究对象,每升模拟尿液组成为:0.65 g CaCl2·2H2O、0.65 g MgCl2·6H2O、4.6 g NaCl、2.3 g Na2SO4、0.65 g C6H5Na3O7·2H2O、0.02 g Na2C2O4、4.2 g KH2PO4、1.6 g KCl、1 g NH4Cl、17.16 g CO(NH2)2、1.1 g C4H7N3O。同时,研究中获取了真实尿液,真实尿液取自某高校厕所,尿液收集后于塑料桶中常温密闭储存若干天,即为陈尿。尿素水解活性定义为尿液中脲酶催化尿素水解的速率,计算如公式(1)所示,储存时间不同的尿液有不同程度的尿素水解活性。将陈尿接种于模拟尿液可以模拟实际工程中尿液间歇式收集时环境微生物对尿液的潜在水解作用。
式中:UHA为尿素水解活性,mg/(L·d);Δc 为尿液完全水解氨氮浓度增量,mg/L;t 为尿液完全水解所用时间,d。
2.2 尿液稳定化关键要素序批试验
试验中研究的尿液稳定化关键要素包括:pH、温度和尿素水解活性。在模拟尿液中均按13%体积比例接种陈尿,利用NaOH 调节稳定化体系初始pH 为9.5~11.5,分析pH 对稳定化效果的影响;稳定化系统温度分别设定为-15、5、25 ℃,研究温度对尿液稳定化的影响;在模拟尿液中分别接种储存4、6、24 个月的陈尿以测试尿素水解活性对稳定化效果的影响。以上试验同时设置没有添加碱的样品作为空白对照组,所有条件均设置3个平行试验,试验详情如表1 所示。
2.3 廉价碱性试剂优选的序批试验
虽然NaOH 是一种常见的碱性试剂,但是筛选更适宜的廉价碱性稳定化试剂对于在我国高寒旱农村地区进行技术推广更具实际价值。本部分试验研究了Ca(OH)2、CaO 和草木灰作为碱性试剂的稳定化效果(表1),所选草木灰为高寒旱地区常见的大豆秸秆充分燃烧后的秸秆灰分,廉价且广泛存在[16],稳定化试验的其他操作同2.2。
2.4 稳定化尿液施用的盐碱化风险分析试验
为分析稳定化尿液施用对土壤存在的潜在盐碱化风险,分别于土壤施用水解尿液和稳定化尿液并开展试验分析。试验土壤为自然非盐渍化土壤,pH 为6.2,水解尿液经过充分水解,氨氮占总氮的比例达95%以上,稳定化尿液Ca(OH)2投加量为5.2 g/L,无显著的尿素水解,尿液施肥前均稀释10 倍。水解尿液和稳定化尿液均匀施用于土壤,施尿量分别为0.5、1.0、1.5 L/m2,同时设置施水(1.5 L/m2)的空白对照组,试验共计7 个处理,每个处理重复3 次,共21 个小区,每小区面积1 m2,用梅花取样法采集0~20 cm 表层土壤,四分法取混合土样1 kg,风干过1 mm 筛,以1 ∶5(m/V)的比例加入水,振荡提取,制得浸提液待测。
2.5 分析方法
尿液的pH 采用pH 计(雷磁PHS-3G,中国)测量。液体样品取样后,使用0.45 μm 孔径的微滤膜过滤样品,各项指标在2 h 内进行分析,其中氨氮和总氮依托紫外可见智能多参数水质测定仪(连华科技LH-3BA,北京)进行测定,磷酸盐采用紫外分光光度计(Hach DR3900,美国)进行测定。土壤pH 采用pH 计(雷磁PHS-3G,中国)测定,土壤电导率采用电导率仪(雷磁DDSJ-308A)测定。
3 结果与讨论
3.1 碱性稳定化关键要素
3.1.1 稳定化pH
调节pH 对尿液pH 和氨氮浓度变化的影响如图1 所示。0~6 d 内,不加碱的空白对照组pH 由7.2 上升至9.2,氨氮浓度由1 374 mg/L 上升至7 998 mg/L,尿液完全水解;调节尿液pH 为9.5,之后尿液pH 无明显变化,但是0~6 d 内氨氮浓度升高至7 590 mg/L,这表明尿液仍然迅速水解;调节尿液pH 为10.0,6 d 后pH 下降为9.5,氨氮浓度迅速升高至7 398 mg/L 并最终稳定在8 000 mg/L左右,尿素完全水解;调节尿液pH 分别为10.5、11.5 时,pH 和氨氮浓度无明显变化,有效抑制了尿液中尿素水解,进而延长监测至第263 d 时,尿液仍未水解,实现了长期稳定化。

图1 尿液碱性稳定化中调节初始pH 后pH、氨氮浓度随时间的变化规律Figure 1 Changes of urine pH and ammonia nitrogen concentration with time after adjusting initial pH in urine alkaline stabilization
尿液的水解与尿素水解酶有关,产生尿酶的微生物无处不在,当尿液中有大量脲酶存在时,会使尿液中尿素快速水解[17],如式(2)所示。
脲酶适宜pH 为6.8~8.7[9],加碱提高pH 可抑制尿素酶解从而实现尿液的稳定化[10,18]。本试验调节尿液pH≥10.5 可有效抑制尿素水解实现稳定化,稳定化pH 略低于Randall 等[10]的研究结果,而Simha[19]认为尿液pH≥10 即可抑制尿素酶解,这可能是因为温度[1]、尿素水解活性[20]、尿液成分[10]、碱性剂的类型[7]等存在差异,导致实现尿液稳定化的pH 略有不同。通常可以通过投加过量碱性剂,以确保不同成分尿液达到稳定化[10],但过量加碱提高pH 不仅增加成本,且无法进一步提高保氮效果,因此,应保证碱性剂投加量在适宜范围内。
3.1.2 稳定化温度
不同温度下尿液的pH 和氨氮浓度变化见图2。-15 ℃条件下,100 d 时,空白组尿液pH 由7.6 显著升高至8.7,氨氮浓度仅略有升高,这说明低温可以有效抑制尿素水解,同时也说明pH 升高至约9.0 不能完全表征尿液的水解过程[1]。而当温度分别为5 ℃和25 ℃时,氨氮浓度迅速升高,尿素水解,温度越高,尿素水解速度越快。

图2 尿液碱性稳定化不同温度下pH 和氨氮浓度随时间的变化规律Figure 2 Changes of urine pH and ammonia nitrogen concentration with time at different temperatures in urine alkaline stabilization
在-15 ℃下碱化pH 为11.0 时,尿液pH 和氨氮浓度基本无显著变化,当延长监测至180 d 时尿液仍未水解,实现了尿液长期稳定化。5 ℃时初始pH 调节为11.0 的尿液在70 d 内基本完全水解;25 ℃时初始pH 调节为11.0 的尿液在36 d 内基本完全水解。这表明,高寒地区的低温有助于尿液的碱性稳定化,原因主要是低温度环境下微生物和酶活性会被抑制[1,21]。但是,在温度分别为5 ℃和25 ℃时,即便初始pH 调节至11.0,尿液仍然会水解,这与3.1.1 中的结果不一致,再次表明尿液碱性稳定化的临界pH 可能受到其他因素影响。
3.1.3 尿素水解活性
模拟尿液中接种储存不同时间陈尿后,尿液pH 和氨氮浓度变化如图3 所示。无碱化时,接种储存4 个月陈尿的尿液氨氮浓度升高最快、尿素水解活性最高(391 mg·L-1·d-1),接种储存6 个月陈尿的尿液水解活性次之(251 mg·L-1·d-1),而接种储存24 个月陈尿的尿液氨氮浓度没有显著变化,这表明此时的陈尿没有尿素水解活性。尿液在储存过程中微生物浓度先升高后降低,长期的腐熟肥化会有效降低尿液中的细菌总数[5],这也导致了脲酶浓度降低。尿液的水解与脲酶浓度有关,脲酶浓度越高越有利于尿素的水解[20],这是接种不同储存时间陈尿后尿素水解活性不同的原因。尿液中尿素水解活性不同时,稳定化效果也会受到影响。

图3 尿液碱性稳定化中接种不同陈尿后尿液pH 和氨氮浓度随时间的变化规律Figure 3 Changes of urine pH and ammonia nitrogen concentration with time after inoculation of different stored urine in urine alkaline stabilization
接种储存4 个月陈尿时尿素水解活性最高,调节尿液pH 为11.0 无法使尿液稳定下来,尿液在36 d 完全水解;接种储存6 个月和24 个月陈尿时尿素水解活性相对较低,调节尿液pH 为11.0 则可使尿液稳定下来。由于不同陈尿水解尿素的能力不同,实现尿液稳定化需要达到的pH 也不同,而这尚未见到公开报道。这表明,接种尿素水解活性较高的陈尿时,需要更高的碱性pH 以达到较好的稳定化效果。
3.2 廉价碱性稳定化试剂的选择与优化
3.2.1 Ca(OH)2
利用Ca(OH)2进行尿液碱性稳定化处理,其效果见图4。

图4 采用Ca(OH)2 进行尿液稳定化处理时尿液pH、氨氮浓度和磷酸盐浓度随时间的变化Figure 4 Changes of urine pH,ammonia nitrogen concentration and phosphate concentration with time in the urine stabilization treatment by Ca(OH)2
当尿液初始pH>9.5 时,尿液pH 在最初16 d内会略有下降,随后pH 趋于稳定,尿素水解产生HCO3-具有很强的酸碱缓冲能力,会导致碱性pH下降,同时,尿液中存在Ca(OH)2和HCO3-的化学反应,如化学方程式(3)所示,反应生成CaCO3沉淀,这可能也会降低Ca(OH)2的碱性稳定化效果。因此考虑使用Ca(OH)2稳定尿液时,应加大Ca(OH)2投加量以抵消pH 的下降[22]。
Ca(OH)2+ HCO3-→CaCO3↓+ H2O + OH-(3)
当Ca(OH)2投加量低于3.5 g/L 时,尿液在6 d内基本水解;当Ca(OH)2投加量为4.3 g/L 时,尿液在16 d 内基本水解;Ca(OH)2投加量为5.2 g/L时,尿液pH 稳定在11.0 左右,氨氮浓度没有显著变化,当延长监测至180 d 时尿液仍未水解,实现了尿液长期稳定化。Randall 等[10]投加2.5 g/L Ca(OH)2即可保证尿液不水解,Riechmann 等[22]的尿液处理系统实现尿液稳定化的Ca(OH)2最小消耗量为6 g/L,本试验表明Ca(OH)2投加量为5.2 g/L 时可使尿液稳定下来,产生此差异的原因可能是温度以及尿素水解活性等因素。
尿液经过36 d 的储存后,投加Ca(OH)2的尿液磷酸盐浓度显著降低。对照组尿液磷酸盐浓度仅略有降低,而Ca(OH)2浓度为1.7~4.3 g/L 时,磷酸盐浓度由790 mg/L 降低至390~540 mg/L,Ca(OH)2浓度为5.2 g/L 时,磷酸盐浓度显著降至3.8 mg/L。加入Ca(OH)2后,尿液中原有的Ca2+、Mg2+以及新加入的Ca2+与PO43-会在碱性pH 下快速反应形成化学沉淀,磷酸盐被固定在羟基磷酸钙、磷酸钙或者鸟粪石中[23]。理论上,当投加量为3.4 g/L 时即可有效沉淀所有磷酸盐,但是,考虑到尿素水解产生的HCO3-会消耗部分Ca2+,所以4.3 g/L 的投加量时磷酸盐去除率也仅约36.7%,而Ca(OH)2浓度达到5.2 g/L 时磷酸盐去除率升高至约99.5%。尿液中的磷主要以溶解性PO43-形式存在,用作肥料时是速效磷,而沉淀物中的PO43-则是非溶解性的,用作肥料时可作为缓释磷肥[10-11]。
3.2.2 CaO
利用CaO 进行尿液碱性稳定化,其处理效果见图5。
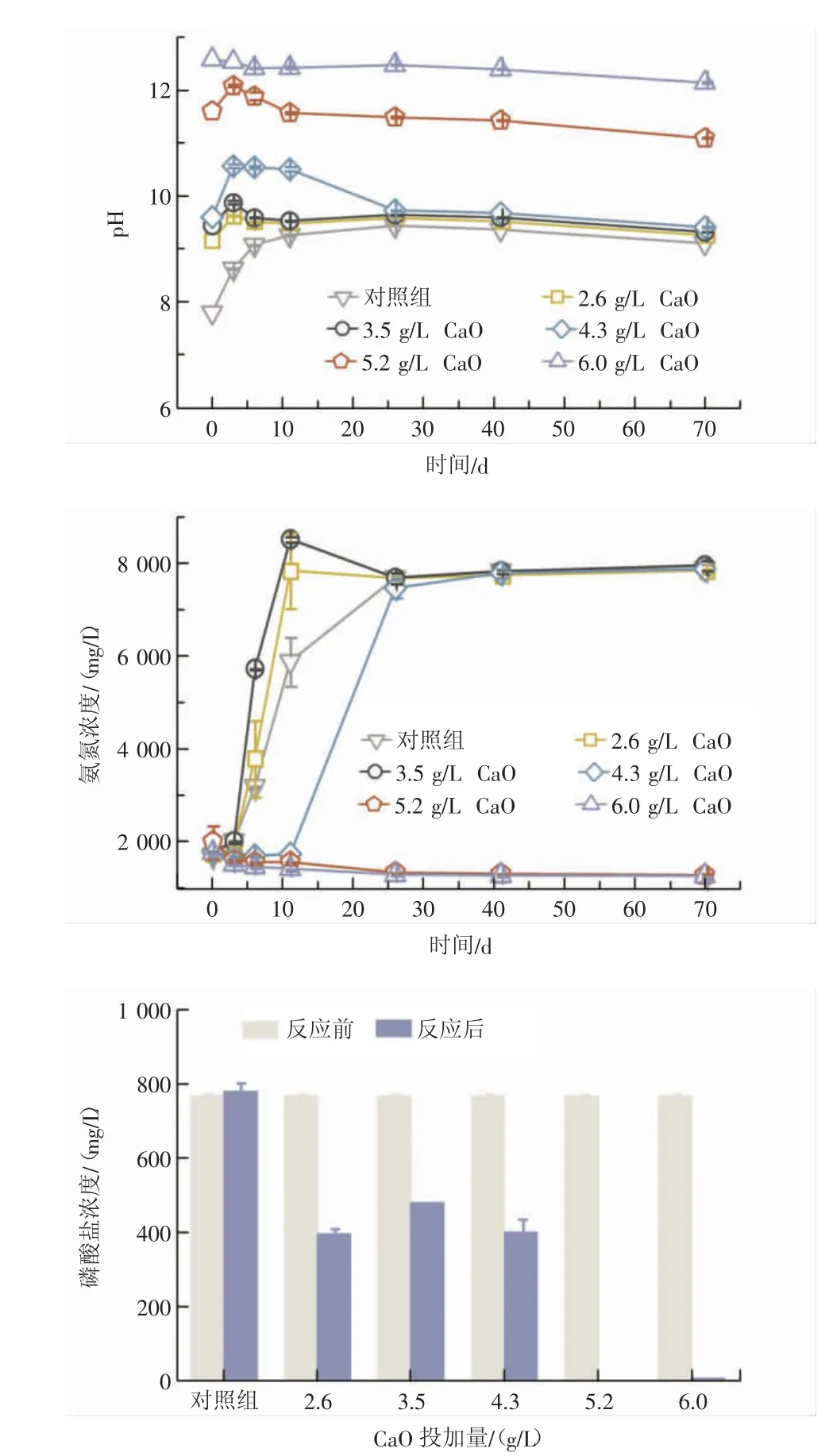
图5 采用CaO 进行尿液稳定化处理时尿液pH、氨氮浓度和磷酸盐浓度随时间的变化Figure 5 Changes of urine pH,ammonia nitrogen concentration and phosphate concentration with time in the urine stabilization treatment by CaO
对照组尿液pH 由7.8 升高至9.4,26 d 时氨氮浓度达到最大值,尿液完全水解。CaO 投加量为2.6 g/L 和3.5 g/L 的尿液体系pH 最终趋于9.5,11 d时氨氮浓度达到最大值,尿液完全水解。CaO 投加量为4.3 g/L 时,尿液体系pH 最终趋于9.7,26 d时氨氮浓度达到7 470 mg/L,尿液基本完全水解。CaO 投加量为5.2 g/L 和6.0 g/L 时,尿液pH 分别稳定在11.1 和12.1,氨氮浓度无变化,当延长监测至180 d 时尿液仍未水解,实现了尿液长期稳定化。CaO 与Ca(OH)2的尿液碱性稳定化效果基本一致,主要原因是CaO 与H2O 反应生成Ca(OH)2,体系最终仍是以Ca(OH)2作为碱性剂稳定尿液。
尿液经过41 d 的储存后,对照组尿液磷酸盐浓度基本无变化,CaO 投加量≤4.3 g/L 时,尿液未稳定下来,磷酸盐浓度由769 mg/L 降低至395~480 mg/L;CaO 投加量≥5.2 g/L 时,尿液稳定下来,溶液中磷酸盐浓度≤10 mg/L,几乎全部以沉淀形式存在,与投加Ca(OH)2结果基本一致。因此,在实际应用中,可以综合考虑当地原材料成本权衡碱性试剂的选用。
3.2.3 草木灰
向尿液中投加不同量草木灰,尿液碱性稳定化效果见图6。

图6 采用草木灰进行尿液稳定化处理时尿液pH、氨氮浓度和磷酸盐浓度随时间的变化Figure 6 Changes of urine pH,ammonia nitrogen concentration and phosphate concentration with time in the urine stabilization treatment by plant ash
草木灰添加量≤130 g/L 时,尿液在16 d 基本完全水解;草木灰添加量≥220 g/L 时,尿液0~3 d 不水解,随后pH 由10.2~10.9 降为9.6~10.1,氨氮浓度缓慢升高,在26 d 基本完全水解;经过36 d 存储,对照组尿液水解后氨氮浓度最高可达8 273 mg/L,而添加草木灰组尿液水解后氨氮浓度最高为6 456~7 425 mg/L;草木灰投加量越大、尿液水解越慢、水解后尿液氨氮浓度越低,添加草木灰组尿液磷酸盐浓度降低至100 mg/L 以下,这是因为草木灰颗粒具有吸附特性,能够减缓总磷的流失[24],可用作吸附剂去除胺、有机磷酸、盐等[25],因此,尿液中氨氮和磷酸盐浓度均较对照组低。
加入大量草木灰无法使尿液稳定下来,且尿液中加入草木灰增加了尿液体积,尿液变得黏稠,需要增强搅拌力度以使尿液混匀。虽然加入大量草木灰后尿液3 d 内不水解,但后期尿液全部启动水解,这是因为草木灰的主要成分是K2CO3[26],具有酸碱性缓冲能力,使得初始pH 下降,从而解除了高碱性的尿液稳定化效果。已有研究通过草木灰干燥尿液,获得氮含量7.8%的固体干燥产品[12],但本研究利用草木灰未达到稳定尿液的效果,这表明使用草木灰作为碱性稳定化试剂时需要考虑灰分性质,并考察长期稳定化效果。
3.3 稳定化尿液施用对土壤盐碱化的影响
在0~1.5 L/m2的施尿量下,水解尿液和稳定化尿液对土壤的影响如图7 所示。

图7 不同尿液和施尿量对土壤pH 和电导率的影响Figure 7 Effects of different urine and urine application volumes on pH and electrical conductivity of soil
土壤pH 在不同施肥处理下差异不显著(P>0.05),可能是因为土壤具有较强的酸碱缓冲能力。施水土壤的电导率降低,施用1.0、1.5 L/m2水解尿液时土壤电导率显著升高69.88%和131.11%(P<0.05),施用1.5 L/m2稳定化尿液土壤电导率显著升高98.07%(P<0.05),施尿土壤电导率随施尿量增加而升高,且施水解尿液土壤电导率增加值比施稳定化尿液时更大。稳定化尿液投加了Ca(OH)2,生成沉淀物,导致尿液电导率下降,也因此,施用稳定化尿液后,土壤电导率反而比施用水解尿液时要低。Richert 等[27]编制的《尿液农用实践导则》指出,尿液施肥过程中每次施用量一般低于1.5 L/m2,并指出这个施用量不会导致土壤盐碱化。这也说明,施用同等量的稳定化尿液也不会导致土壤盐碱化,但是考虑到施用尿液量较大时土壤电导率会升高,这意味着土壤盐化风险增加,应少量多次施肥,以有效控制盐化风险。
4 结论
1)调节尿液pH≥10.5、降低温度均可有效抑制尿液中尿素水解,尿液在263 d 内pH 和氨氮浓度均无变化,可以实现长期稳定化。尿液中尿素水解活性强时,需提高pH 以抑制尿素的酶解。
2)Ca(OH)2投加量为5.2 g/L 时,可以在180 d有效抑制尿液中尿素水解实现稳定化,与CaO 的尿液碱性稳定化效果基本一致,考虑到尿液成分和储存环境差异,碱性稳定化试剂的投加量略有不同,应保证尿液稳定化过程中体系pH≥10.5。与草木灰相比,Ca(OH)2与CaO 更适用于尿液的长期稳定化。
3)当尿液施用量低于1.5 L/m2时,相比施用水解尿液,施用稳定化尿液带来的土壤盐碱化风险更低,但为防止土壤盐碱化,应少量多次施肥,合理掌握施肥量。
