SDS改性磁性壳聚糖对泰乐菌素和Cu(Ⅱ)的吸附特性
2023-07-05崔康平聂贤宝徐正江
方 伟, 崔康平, 聂贤宝, 徐正江, 冯 鹏
(1.合肥工业大学 资源与环境工程学院,安徽 合肥 230009; 2.安徽曙光化工集团有限公司,安徽 安庆 246003)
近年来,中国已经成为世界上最大的抗生素生产和使用国,然而抗生素使用后对生态系统和人类健康的负面影响令人担忧[1]。泰乐菌素(tylosin,TYL)属于大环内酯类抗生素[2],被广泛应用在畜牧养殖业中的动物饲料添加剂中,此类抗生素只有少部分被动物吸收或者转化,大部分以母体或者代谢产物的形式排出体外,导致TYL的残留在环境中已被广泛检出[3-4]。另外,由于工业废水的不合理排放及矿物资源的不合理开发利用,环境被重金属严重污染[5],重金属中毒、食物链富集及其难以降解的特性,严重威胁着人类健康和生活环境[6]。
自然界的水体组成十分复杂,废水中的抗生素和金属离子经常共存[7]。抗生素分子中含有大量的羧基、羟基、氨基、杂环等基团或电子供体原子,均可与金属离子发生络合作用[8]。与抗生素或重金属单一污染相比,抗生素与重金属复合污染的毒性更强[9],不仅会影响污染物在环境中的化学过程,还会影响污染物的生物效应[10]。
吸附法具有效率高、工艺简单、对环境无害等优点,是一种去除抗生素和重金属的重要技术和方法[11]。壳聚糖是一种生物可降解、生物相容性好、无毒的线状多糖,其分子上的羟基、氨基和N-乙酞基使壳聚糖表现出高的溶解性能和反应活性,被广泛用于去除废水中的各种金属离子和抗生素[12-13]。然而,吸附后的壳聚糖用传统分离方法不易从废水中分离出来,还会造成二次污染。对于吸附剂分离和再生的问题,近年来的研究集中在磁选技术上。采用磁性吸附剂的分离技术是一种处理废水的替代方法,近年来受到许多研究者关注[14]。
本文选用的磁性纳米材料是磁铁矿(Fe3O4),通过共沉淀和水热处理合成磁性壳聚糖(magnetic chitosan nanoparticle,MCNP)。为了增加MCNP暴露的活性位点数量,提高吸附能力,可对其进行表面改性[15]。在各种改性方法中,离子表面活性剂可以在磁性纳米颗粒上负载形成半胶束和吸附胶团,使吸附剂具有优异的结合能力[16-17]。这些半胶束和吸附胶团能够将难溶分子的溶解度提高几个数量级[18]。半胶束是由表面活性剂吸附在吸附剂表面上的单分子层组成的,吸附剂表面是疏水的,当吸附剂表面饱和后,越来越多的表面活性剂被吸附,从而形成吸附胶团,并提供表面疏水作用。半胶束和吸附胶团的吸附是由疏水作用和静电吸引共同驱动的,这种独特的现象被称为有机化合物的增溶作用[19]。本文选用阴离子表面活性剂十二烷基硫酸钠(sodium dodecyl sulfate,SDS)来修饰阳离子聚电解质壳聚糖,通过疏水和静电相互作用导致目标分析物的增溶和保留,从而提高MCNP对TYL和铜离子(Cu(Ⅱ))的吸附能力。
1 实验材料与方法
1.1 实验材料与仪器
壳聚糖(脱乙酰度大于等于95%,黏度为50~100 mPa·s)、SDS(纯度大于99%)、50%戊二醛溶液和磷酸二氢钾(KH2PO4),购自上海易恩化学技术有限公司;TYL(纯度大于等于93%,-20 ℃保存),购自上海麦克林生化科技有限公司;五水合硫酸铜(CuSO4·5H2O),购自上海展云化工有限公司;七水合硫酸亚铁(Fe(SO4)2·7H2O),购自西陇化工股份有限公司;六水合三氯化铁(FeCl3·6H2O),购自上海沃凯生物技术有限公司;盐酸、氢氧化钠、醋酸,购自无锡市展望化工试剂有限公司;乙腈,购自南京化学试剂股份有限公司,为高效液相色谱(high performance liquid chromatography,HPLC)级试剂;其他化学试剂均为分析纯;超纯水,采用超纯水仪制备。
使用扫描电子显微镜(scanning electron microscope,SEM)、X射线衍射仪(X-ray diffractometer,XRD)、傅里叶变换红外光谱仪 (Fourier transform infrared spectrometer,FTIR)表征材料的结构、比表面积及官能团,使用Zeta电位仪分析溶液中粒子的电位值。采用德国卡尔蔡司公司的Gemini 500型SEM;使用Thermo Nicolet 6700 FTIR,在4 000~500 cm-1波数范围内测量以确定材料中包含的表面官能团;使用PANalytical B.V.的XRD,测试衍射角范围为5°~70°;使用Nano ZS90型Zeta电位分析仪。
1.2 MCNP的合成
在壳聚糖溶液中通过氢氧化钠化学共沉淀Fe2+和Fe3+,再经水热处理,制备出MCNP纳米粒子。具体步骤如下:
(1) 取2 g壳聚糖放入100 mL 2%的醋酸溶液中,采用磁力搅拌直至壳聚糖完全溶解。
(2) 按摩尔比1∶2溶解Fe(SO4)2·7H2O和FeCl3·6H2O,在40 ℃下加入30%NaOH溶液,在氩气保护下不断搅拌,产生化学沉淀。
(3) 利用机械搅拌器将混合溶液在90 ℃恒温水浴中剧烈搅拌4 h,得到的产物用去离子水和乙醇洗涤,并在70 ℃的真空中干燥24 h。
(4) 取出干燥后的粒子,用去离子水洗涤至中性,并滴加50%戊二醛溶液,在恒温振荡箱中振荡12 h以交联粒子。
(5) 交联反应结束后取出粒子,用乙醇和去离子水洗涤以去除剩余的戊二醛,最后冷冻干燥即得MCNP粒子。
1.3 MCNP的改性
首先将MCNP悬浮液的pH值调节至4.6左右,加入一定量的SDS,通过涡流搅拌器搅拌2 min,形成涂覆SDS的MCNP悬浮液;然后利用强磁铁将涂覆SDS的MCNP与水和游离SDS分子分离,倒出水相,得到表面被SDS改性的MCNP。
1.4 检测方法
Cu(Ⅱ)质量浓度用原子吸收光谱仪测定(美国Perkin Elmer制造);TYL质量浓度用高效液相色谱仪检测(日本岛津公司,LC-20AT);流动相配置为V(KH2PO4)∶V乙腈=65∶35,流速为1 mL/min,KH2PO4溶液的浓度为0.01 mol/L,pH=2;检测波长为290 nm。
TYL或Cu(Ⅱ)的饱和吸附量qe计算公式为:
(1)
其中:ρ0、ρe分别为初始和平衡时TYL或Cu(Ⅱ)质量浓度;V为TYL或Cu(Ⅱ)溶液的初始体积;m为吸附剂的质量。
1.5 吸附实验
所有的批量吸附实验在50 mL透明洁净的锥形瓶中进行,其中MCNP用量均为20 mg,溶液体积均为30 mL,整个反应过程在转速为150 r/min的恒温振荡箱里暗光条件下进行;溶液的pH值用0.1 mol/L的HCl和0.1 mol/L的NaOH进行调节;通过分析天平称取TYL和CuSO4·5H2O,配制100 mg/L的标准原液,本实验TYL和Cu(Ⅱ)的质量浓度通过稀释原液得到;为了研究接触时间对吸附TYL和Cu(Ⅱ)的影响,分别在pH=4下对40 mg/L的TYL、在pH=6下对40 mg/L的Cu(Ⅱ)进行分析;在吸附等温线实验中,TYL和Cu(Ⅱ)的初始质量浓度为20~100 mg/L,pH值分别为4和6;实验中固相和液相的分离通过强磁铁的吸引达到;所有实验设有平行样和空白样,实验数据取3次重复实验的平均值。
1.6 吸附模型
为了明确改性前后MCNP对TYL、Cu(Ⅱ)单一体系及TYL/Cu(Ⅱ)复合体系的吸附规律,采用常用的准一级动力学模型、准二级动力学模型对实验数据进行拟合,其表达式[20]分别为:
ln(qe-qt)=lnqe-k1t
(2)
(3)
其中:qt为t时刻的吸附量;k1为准一级动力学吸附反应速率常数;k2为准二级动力学吸附反应速率常数。
吸附等温线分别用Langmuir模型和Freundlich 模型进行拟合,其表达式[21]分别为:
(4)
(5)
其中:qmax为Langmuir 模型饱和吸附量;KL为Langmuir模型平衡参数;KF为Freundlich 模型平衡常数;n为Freundlich模型平衡参数,用于表征吸附作用强弱,可以表征吸附等温线的非线性程度。
2 实验结果与讨论
2.1 MCNP的表征
利用SEM研究制备的Fe3O4和MCNP的形貌特点,SEM图片如图1所示。从图1可以看出,Fe3O4的粒径为100~130 nm,形状近球形,形貌较均匀;负载壳聚糖后,可以很明显看到壳聚糖内部的白点,即Fe3O4,且其粒径进一步增大,为150~200 nm,说明壳聚糖已经将Fe3O4成功包裹起来。

图1 Fe3O4和MCNP的SEM图片
纯Fe3O4纳米颗粒、壳聚糖及MCNP的FTIR谱图如图2所示。

图2 MCNP、Fe3O4和壳聚糖的FTIR谱图
在Fe3O4的光谱中,600~560 cm-1的位置是Fe3O4中Fe—O的振动峰。对于壳聚糖,主要的峰表现如下:3 436 cm-1处是O—H和N—H伸缩振动峰和分子内氢键的振动峰;2 873 cm-1处是—CH伸缩振动峰;1 599 cm-1处是—NH2中—NH弯曲振动峰;1 425、1 324 cm-1处分别是—OH、—CH振动峰;1 157、 1 080 cm-1处主要是糖苷键、多糖骨架中C—O和C—O—C的伸缩振动峰[22-23]。通过对比MCNP和壳聚糖的峰可以发现:在1 652 cm-1处产生1个新峰,此峰很可能是壳聚糖的氨基和戊二醛的醛基反应过程中形成的希夫碱C=N 键[24];590 cm-1处存在1个新峰,它是Fe—O 键振动产生的,证明壳聚糖被成功地负载在Fe3O4表面。
通过XRD来研究Fe3O4、壳聚糖、MCNP的晶体结构,结果如图3所示。Fe3O4的6个特征峰(2θ分别为30.1°、35.6°、43.1°、53.7°、57.1°、62.6°)在Fe3O4和MCNP粒子中均出现[25],该结果表明:MCNP粒子含有Fe3O4晶体;在MCNP粒子的制备过程中,磁核(Fe3O4)很稳定并且没有引起Fe3O4晶型的改变,也证明Fe3O4被壳聚糖包裹。壳聚糖的谱线中20.0°处的峰是壳聚糖的特征衍射峰,由于壳聚糖的结晶度很差,该峰是弥散的宽峰。从MCNP的谱线可以得出,包裹Fe3O4后,其壳聚糖的特征衍射峰明显减弱,有可能是由于壳聚糖在醋酸溶液中溶解,分子间与分子内的氧键断裂所致。壳聚糖包裹Fe3O4后,使壳聚糖结构的有序性受到破坏,也可能是壳聚糖特征衍射峰减弱的一个原因[26]。

图3 壳聚糖、Fe3O4、MCNP的XRD谱图
2.2 吸附动力学分析
改性前后MCNP对TYL、Cu(Ⅱ)单一体系及TYL/Cu(Ⅱ)复合体系的吸附动力学曲线如图4所示。由图4可知:改性前,MCNP对TYL的吸附先快速增加,然后逐渐放缓,最终在6 h左右达到最大吸附量,为26.32 mg/g;改性后,MCNP达到最大吸附量的时间提前1 h,吸附量大约提高1倍,为51.23 mg/g,证明MCNP改性成功,吸附效果提升;改性前和改性后MCNP对Cu(Ⅱ)的吸附也是先快速增加,然后逐渐放缓,最终在6 h左右达到最大吸附量。

图4 TYL、Cu(Ⅱ)单一及TYL/Cu(Ⅱ)复合体系动力学曲线
为了明确改性前后MCNP对TYL、Cu(Ⅱ)单一体系及TYL/Cu(Ⅱ)复合体系的吸附规律,采用常用的准一级动力学模型、准二级动力学模型对实验数据进行拟合,模型的线性拟合结果如图5所示。2种动力学模型的参数及相关系数取值见表1所列。

表1 2种吸附动力学模型参数及相关系数取值

图5 2种吸附动力学模型拟合结果
与准一级动力学模型相比,准二级动力学模型的相关系数都大于0.99,且计算得到的qe值(理论吸附量)与实验数据更吻合。实验结果表明,改性前后的MCNP对TYL、Cu(Ⅱ)单一体系及TYL/Cu(Ⅱ)复合体系的吸附动力学更符合准二级动力学模型,并且吸附过程的速率控制步骤为化学吸附过程[27]。
2.3 吸附等温线分析
为了深入了解TYL和Cu(Ⅱ)在改性前后MCNP上的吸附机理,采用2种常用的等温模型(Langmuir模型和Freundlich模型)对吸附平衡数据进行拟合,拟合参数见表2所列。吸附等温线可以揭示吸附质在溶液和吸附剂中的平衡状态,从而可以进一步了解吸附机制的发生过程。Langmuir模型可用于阐明均相吸附系统中吸附是在均相吸附位点上发生的单层反应,而Freundlich模型的方程为经验方程,表明吸附是多层非均相吸附[28]。

表2 吸附等温线2种模型的拟合参数取值
从表2可以看出,2种模型对改性前后MCNP吸附TYL与Cu(Ⅱ)均具有较好的拟合效果,Freundlich模型更适合模拟改性前后MCNP对TYL单一体系和复合体系的吸附过程,而Langmuir模型更适合模拟改性前后MCNP对Cu(Ⅱ)单一体系和复合体系的吸附过程。对比Langmuir模型中的最大理论吸附量qmax可以得出,相比于TYL和Cu(Ⅱ)的单一吸附,MCNP对于复合体系中Cu(Ⅱ)的吸附有所提高,而对复合体系中TYL的吸附却降低了。这是由于在复合体系中存在MCNP—TYL—Cu(Ⅱ)的架桥作用,导致MCNP对Cu(Ⅱ)的吸附提高[29];然而MCNP—Cu(Ⅱ)—TYL的分子架桥数量很少,Cu(Ⅱ)与TYL竞争材料的吸附位点,导致复合体系下TYL的吸附有所降低。
2.4 pH值的影响
溶液pH值会改变吸附质的形态和吸附剂表面官能团,因此研究pH值对吸附过程的影响是十分必要的。
本文以40 mg/L的TYL和Cu(Ⅱ)为吸附质,研究在pH值为3~10下改性后MCNP对TYL和Cu(Ⅱ)的平衡吸附情况,pH值对TYL、Cu(Ⅱ) 吸附的影响如图6所示。pH值为2时,TYL不能被检测到,Cu(Ⅱ)不能被吸附;文献[30]研究表明,当pH值很低时,TYL水解为去霉菌素和霉菌糖。因此,pH=2的结果被舍弃。

图6 pH值对TYL和Cu(Ⅱ)吸附的影响
由图6可知,随着pH值增加,TYL的去除呈先下降后上升的趋势,在pH=3时TYL的吸附量最大,达到52.306 mg/g。由于pH=3和pH=4情况下TYL的吸附量很接近,考虑到经济因素,采用pH=4为本研究的最佳pH值。
MCNP在水溶液中的Zeta电位值通过实验得到,结果如图7所示。从图7可以看出,MCNP零电位点的pH值大约为3.06,随着pH值增加,电负性增加,在pH=10时达到最大值。TYL是弱碱性分子,pKb值为7.1,当pH<7.1时TYL+成为优势种,在溶液中TYL+占大多数,因此静电相互作用是吸附TYL的主要机理[31]。当pH值高于pKb时,TYL呈中性。然而,在pH值为7.1以上时,MCNP表面仍有相当数量的TYL被吸附,这表明发生的不是静电作用,而是氢键和π-π电子供体受体相互作用,文献[32]研究发现,对中性TYL的吸附,疏水作用可能起主导作用。在pH>7.0时,TYL的吸附量随pH值增加而略有增大。

图7 MCNP在水溶液中的Zeta电位值
对于Cu(Ⅱ),随着pH值增加,Cu(Ⅱ)吸附量变大。Cu(Ⅱ)在酸性条件下呈弱正电荷,而在碱性条件下呈负电荷。悬浮液中Cu(Ⅱ)的主要形态为Cu2+、Cu2(OH)22+、CuOH+、Cu3(OH)42+、Cu(OH)2(s)、Cu(OH)3-、Cu(OH)42-,且这些物质之间存在竞争吸附现象。在较低的pH值条件下,MCNP粒子表面大部分官能团被质子化,如—NH2基团会质子化变成—NH3+,使得MCNP粒子表面带正电荷,与Cu(Ⅱ)之间存在很强的静电排斥力,溶液中大量的H+与Cu(Ⅱ)之间会相互竞争MCNP粒子上的吸附位点,进一步导致吸附量降低;在pH>7.0时,仍然能检测到一定量的Cu(Ⅱ),这是由于金属氢氧化物的形成,如Cu(OH)2(s),当通过测定上清液中Cu(Ⅱ)的平衡质量浓度来计算吸附量时,由于形成金属氢氧化物使得上清液中Cu(Ⅱ)的质量浓度较低,从而增加了Cu(Ⅱ)的表观吸附量。
2.5 背景电解质浓度的影响

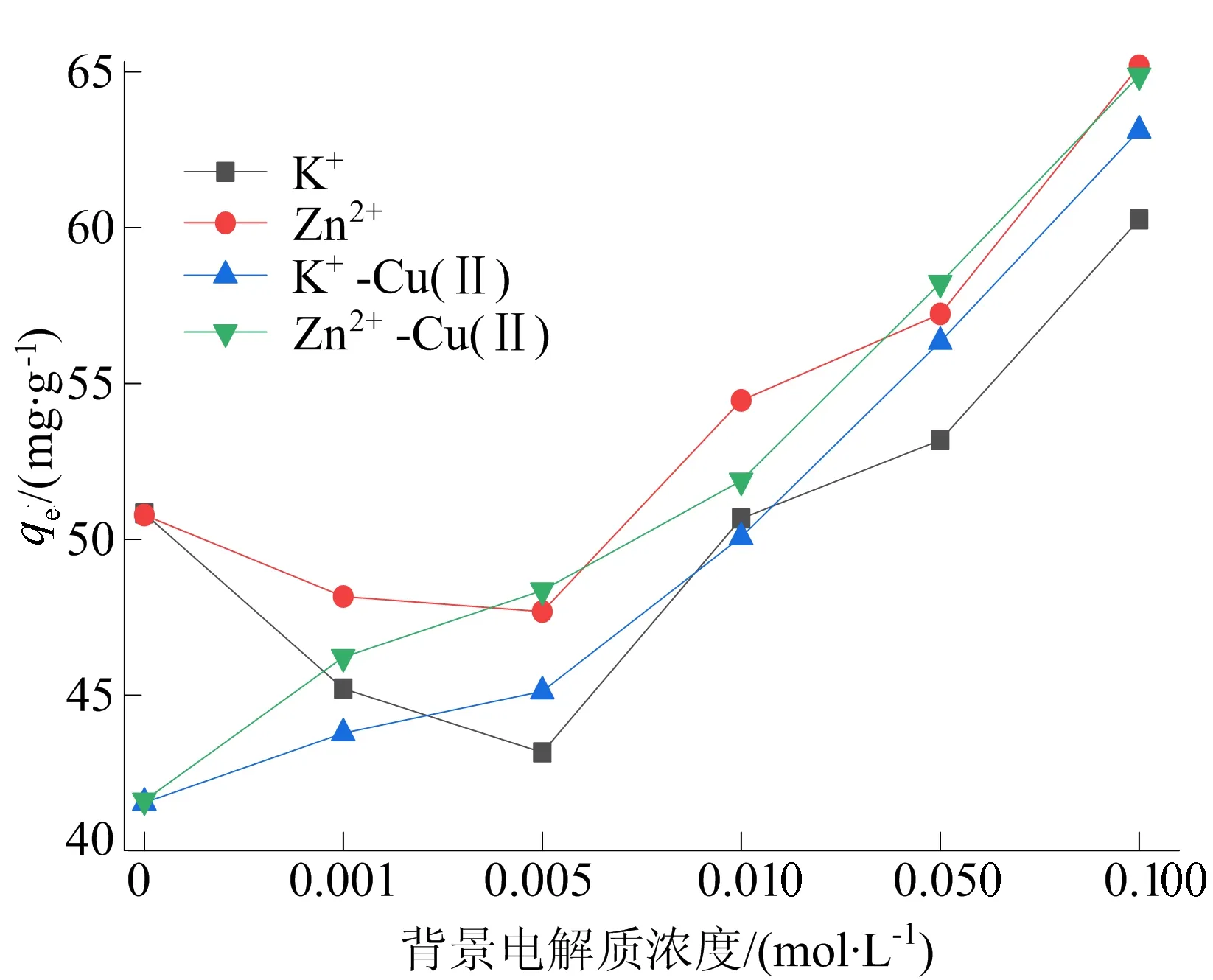
图8 背景电解质浓度对TYL单一、复合体系吸附的影响
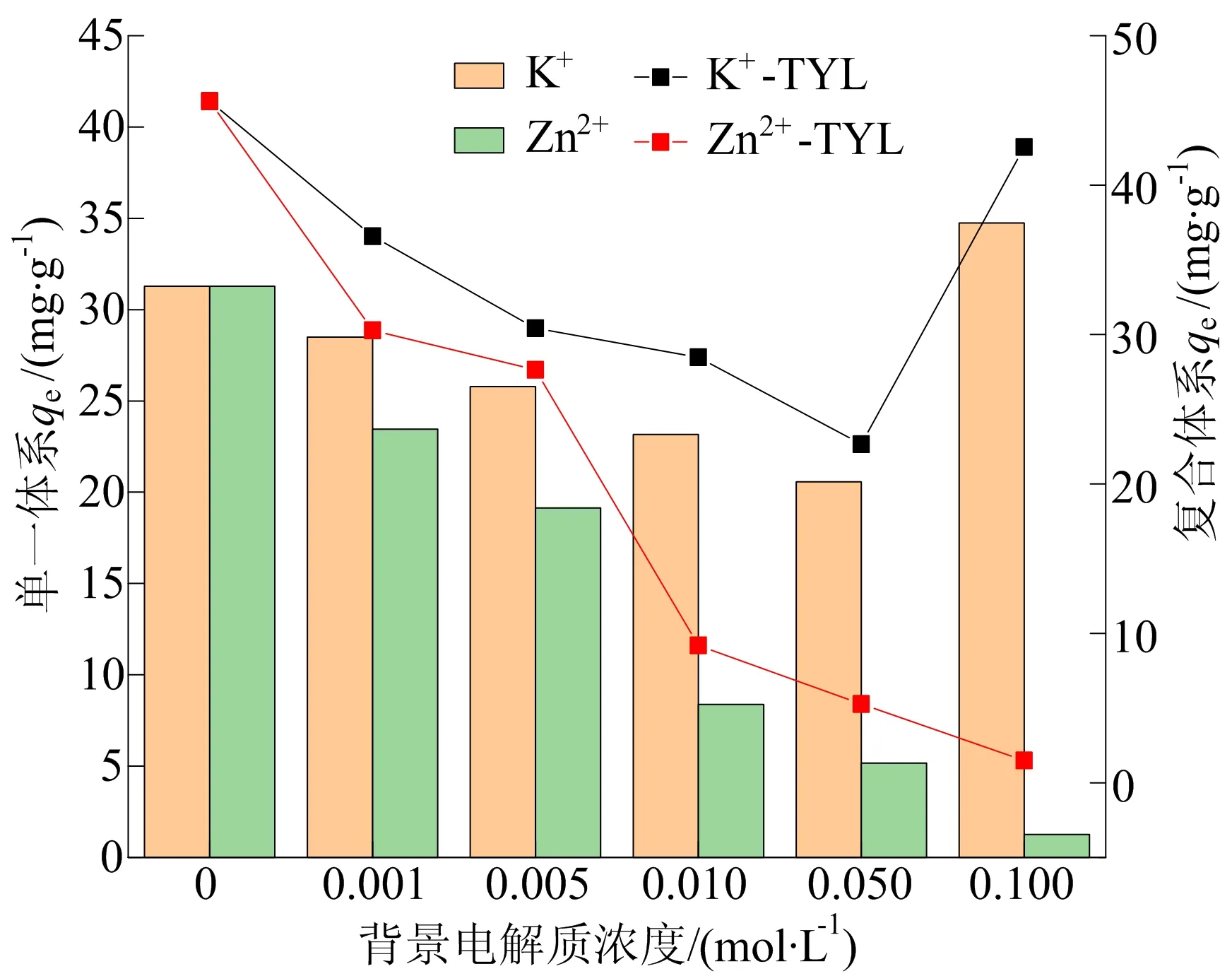
图9 背景电解质浓度对Cu(Ⅱ)单一体、复合体系吸附的影响
从图8可以看出,随着K+和Zn2+浓度从0 mol/L上升到0.100 mol/L,TYL的吸附量呈先降低后上升的趋势,并且Zn2+的促进作用大于K+。在文献[34]的研究中,Zn2+在MCNP上占据2个吸附位点,而K+只占据1个吸附位点,Zn2+、K+会与TYL竞争吸附位点,从而导致TYL吸附量降低,并且Zn2+的抑制作用大于K+,而本文的结果与之相悖。由此可见,竞争吸附不是影响吸附的主要因素。
本研究由于盐析作用,TYL在盐溶液中的溶解度降低,使得更多的TYL被吸附在MCNP上。当背景电解质浓度从0 mol/L上升到0.005 mol/L时,盐析作用还不够明显,K+、Zn2+与TYL的竞争作用大于盐析效应,TYL的吸附量降低;背景电解质浓度从0.005 mol/L上升到0.100 mol/L过程中,盐析作用越来越明显,TYL的吸附量也迅速上升[34]。Cu(Ⅱ)存在时,Cu(Ⅱ)会与TYL竞争吸附位点,使得TYL吸附量降低;而随着K+和Zn2+浓度增加,盐析效应越来越明显,最终Cu(Ⅱ)的抑制作用可忽略不计。
从图9可以看出,随着Zn2+浓度从0 mol/L上升到0.100 mol/L,Cu(Ⅱ)的吸附量明显降低;而随着K+浓度从0 mol/L上升到0.100 mol/L,Cu(Ⅱ)的吸附量先缓慢下降后快速上升。其主要原因是:① 二价Zn2+与吸附剂表面之间的静电引力强于一价K+;② Zn2+和Cu (Ⅱ)的尺寸大小很相近,且二价Zn2+吸附在MCNP上会占据2个吸附位点,而一价K+只会占据1个吸附位点,Zn2+比K+竞争更多的吸附位点;③ 随着K+浓度增加到0.100 mol/L,高离子浓度下Cu(Ⅱ)与Cu(Ⅱ)之间静电斥力降低,导致MCNP对Cu(Ⅱ)的吸附会增加[35]。在TYL存在的情况下,吸附在MCNP上的TYL会给Cu(Ⅱ)提供架桥作用,增加对Cu(Ⅱ)的吸附。随着Zn2+浓度升高,Zn2+不仅会与Cu(Ⅱ)竞争吸附剂上的吸附位点,还会竞争MCNP—TYL—Cu(Ⅱ)架桥上TYL的络合位点,导致Cu(Ⅱ)的吸附量不断降低。
2.6 复合体系吸附机理分析
通过本文实验数据,结合相关研究成果[29,36],得出TYL和Cu(Ⅱ)在复合体系下的吸附机理,如图10所示。

图10 复合体系下TYL和Cu(Ⅱ)的吸附机理
MCNP吸附TYL和Cu(Ⅱ)主要是包裹在Fe3O4上壳聚糖的作用,主要体现在以下3个方面:① 对于TYL,其分子上有一些氢键,可以作为羧基和羟基的氢受体或供体,而壳聚糖上存在—OH和—NH2,能与TYL产生氢键作用[36];② 在pH<7.0时,带负电荷的MCNP粒子会与带正电荷的TYL+和Cu(Ⅱ)产生很强的静电作用;③ 复合体系下TYL和Cu(Ⅱ)都可以提供架桥作用,但大量存在的是MCNP—TYL—Cu(Ⅱ)的架桥方式,MCNP—Cu(Ⅱ)—TYL的架桥数量很少[29]。
SDS包覆后的MCNP吸附效果明显提升,是由于在MCNP原有的吸附能力上,SDS在MCNP表面形成半胶束和吸附胶团,会与目标污染物产生强烈的相互作用,包括疏水作用和静电作用,从而提升吸附剂的吸附效果[16-17]。
3 结 论
(1) MCNP对TYL和Cu(Ⅱ)都具有一定的吸附能力,SDS包覆MCNP形成的混合半胶束可提升吸附效果;复合体系中由于竞争作用,Cu(Ⅱ)会抑制TYL的吸附;而TYL会促进Cu(Ⅱ)的吸附,是由于TYL在Cu(Ⅱ)与MCNP之间形成桥接作用。
(2) 采用准二级动力学模型可以较好地模拟TYL和Cu(Ⅱ)的吸附过程,表明化学吸附是吸附剂吸附TYL和Cu(Ⅱ)的主要速率限制步骤;Freundlich模型更适合模拟TYL的吸附过程,说明该吸附过程为非均相作用;Langmuir模型更适合模拟Cu(Ⅱ)的吸附过程,说明该吸附过程为均相作用。
(3) TYL的吸附量随着离子浓度的增加而增加,pH<7.1时带负电荷的MCNP通过静电作用吸附溶液中的TYL+,pH>7.1时MCNP通过氢键和π-π电子供体受体相互作用吸附溶液中的TYL。
