Pirfenidone通过癌相关成纤维细胞抑制胆道肿瘤侵袭
2023-07-05魏亦成王紫怡殷佩浩
魏亦成,王紫怡,李 炜,殷佩浩,
胆囊癌(gallbladder cancer,GBC)和胆管癌(cholangiocarcinoma,CCA)目前发病率在高收入国家呈上升趋势,由于胆道肿瘤的侵袭性较强导致肿瘤恶性程度高和预后较差[1]。肿瘤的侵袭能力与肿瘤微环境(tumor microenvironment, TME)具有密切关系,其中癌相关成纤维细胞(cancer associated fibroblast,CAF)在肿瘤微环境中起到了重要作用。在CAF的过去研究中指出存在多种功能不同的CAF,例如炎性CAF和肌成纤维细胞CAF(myofibroblast-like CAF,myCAF)[2]。其中myCAF与胶原蛋白的产生相关[3]并且能够增加细胞外基质的刚度[4],是TME形成和重塑的重要因素。
吡非尼酮(Pirfenidone,PFD)是一种新型抗纤维化剂,被批准用于特发性肺纤维化和其他纤维化相关疾病[5]。PFD可以通过抑制TGF-β的释放从而抑制SMAD通路和胶原蛋白产生,具有抗纤维化和抗炎特性,表明PFD能够抑制肌成纤维细胞功能[6]。如果PFD能够改变肿瘤微环境中的myCAF功能,则对于抑制肿瘤侵袭具有重要意义。该研究就此提出假设PFD能否通过改变CAF的功能来影响相关肿瘤微环境从而抑制胆道肿瘤侵袭,并且探索PFD作用于CAF的相关机制。
1 材料与方法
1.1 材料
1.1.1主要试剂 DMEM细胞培养基、双抗、胰酶(含EDTA)(美国Gibco公司);胎牛血清(FBS)(德国BI公司);TGF-β ELISA试剂盒(北京索莱宝科技有限公司);兔源FAP抗体 (英国Abcam公司, ab53066)、兔源p-smad3抗体 (美国CST公司, 9520S)、兔源smad2/3 (美国CST公司, 8685S)、兔源COL1A1(英国Abcam公司,ab138492)、兔源COL3A1(美国NOVUS公司, NB600-594),兔源COL4A1 (美国CST公司, 50273)、兔源p-smad2抗体 (美国CST公司, 18338)、鼠源VIM (美国CST公司, 5741S) 、鼠源α-SMA (英国Abcam公司, ab124964)、鼠源β-actin (英国Abcam公司, ab6276);PFD(平湖市正远医药科技有限公司)。
1.1.2主要仪器 超低温冰箱(青岛海尔集团公司),全波长酶标仪(美国Thermo Fisher Scientific公司),凝胶电泳仪、电泳槽、ChemiDoc MP成像仪(美国BIO-RAD公司),离心机(德国Hettich公司)。
1.1.3细胞 该课题选取胆囊CAF,胆管CAF,胆囊正常成纤维细胞(normal fibroblast,NF),胆管NF作为实验对象,胆囊NF来自安徽来尔文科技有限公司,公司提供细胞相关验证报告。GBC-SD人胆囊癌细胞,来自美国模式培养物集存库ATCC细胞库。组织来源的CAF,从胆囊癌和胆管癌患者的癌组织中分离得到。胆管NF,从正常胆管组织分离得到。细胞培养条件是37 ℃、5% CO2。所有参与这项研究的患者均表示同意。该研究及相关课题经上海普陀区中心医院伦理委员会批准(伦理批准号: PTEC-A-2021-29-1)。
1.1.4实验动物 雄性BALB/c裸鼠10只(6~8周龄30~40 g/只)和购自上海市计划生育科学研究所动物实验经营部,生产许可证号: SCXK(苏) 2018-0006。动物实验均在上海普陀区中心医院 SPF 级动物实验室进行,饲养条件为(22±2) ℃、湿度60%,明暗周期为 12 h /12 h,自由进食和饮水。将小鼠单侧皮下接种GBC-SD人胆囊癌细胞形成皮下瘤小鼠模型。2周后肿瘤成型后进行随机分组,以 BALB/c裸鼠5只为 PFD给药组,以其余BALB/c裸鼠5只为正常对照。PFD给药组每天灌胃1次,每次PFD 250 mg/kg,对照组给予生理盐水,共2周。2周后收集两组BALB/c裸鼠血清进行后续研究。该研究已获得上海普陀区中心医院伦理委员会批准(批件号:DWEC-A-202206013)。
1.2 方法
1.2.1原代CAF细胞提取 在培养皿中加入适量的生理盐水后将所取患者组织标本块置于其中,将多余脂肪、边缘残留组织清理掉,加入适当10%双抗D-Hanks溶液清洗组织至澄清,用眼科剪将其剪碎至糊状。将组织碎末转移到离心管中,加入适量D-Hanks溶液完全淹没组织,离心后弃去上清液。关灯避光,加入胶原酶,封口膜封住管口,置于37 ℃恒温摇床中 150 r/min振荡1 h。加入完全培养基吹打离散组织后离心5 min来清洗胶原酶,重复此步骤3次,待胶原酶全部去除后加入培养基转移至小培养皿中放入培养箱中孵育。
1.2.2细胞分组 根据实验目的将CAF分成4组:胆囊CAF组; 胆管CAF组,分别培养24 h;胆囊CAF+PFD组,胆囊CAF加入PFD后作用24 h;胆管CAF+PFD组,胆管CAF加入PFD后作用24 h,其中PFD浓度0.3 mg/ml,作用时间为24 h。
1.2.3条件培养基 当CAF增长到80%的浓度时,培养基被无血清的培养基取代。处理48 h后,收集细胞悬液作为条件培养基。高速离心后收集条件培养基,然后通过0.22 μm微孔膜过滤,在-20 ℃保存。
1.2.4Western blot检测细胞蛋白表达 取对数成长期的细胞铺板,48 h后去培养基,用PBS清洗3次后,用含有蛋白酶抑制剂和磷酸酶抑制剂的CST细胞裂解液进行蛋白裂解,置于冰上裂解15 min后,运用离心机离心提取蛋白。弃去沉淀后,取上清液,使用BCA蛋白检测试剂盒进行蛋白定量。用10%的SDS-PAGE分离等量的细胞裂解物,并将分离后的蛋白转移到PVDF膜上。用5% BSA封闭1 h后,按照蛋白分子量的大小分离不同条带,将条带与一抗孵育,一抗有FAP(1 ∶1 000)、α-SMA(1 ∶2 000)、VIM(1 ∶1 000)、β-actin(1 ∶5 000)、COL1A1(1 ∶1 000)、COL3A1(1 ∶1 000)、COL4A1(1 ∶1 000)、p-smad2(1 ∶1 000)、p-smad3(1 ∶1 000)、smad2/3(1 ∶1 000)。在4 ℃条件下孵育一抗12 h,用TBST漂洗3次后,与二抗在常温下孵育1 h。再用TBST漂洗3次,使用化学发光显色法进行显色,用Image J软件进行蛋白表达分析,每组试验分别独立重复3次,进行统计。
1.2.5ELISA检测TGF-β水平 收集CAF的条件培养基和小鼠血清作为样品。使用酶联免疫吸附测定试剂盒测定TGF-β水平。将100 μl样品加入抗体包被的96孔板的每个孔中,然后在室温下孵育2 h。将100 μl的工作检测溶液加到每个孔中,在加入100 μl底物溶液之前,将板在室温下再孵育1 h。加入50 μl终止液后终止工作。在分光光度计中设置波长为450 nm,读取相应吸光度。每个样品设立3个复孔,分别独立重复3次实验,进行统计。
1.2.6胶原收缩实验 将CAF悬浮液在无血清培养基和I型胶原溶液中混合,制备胶原凝胶。最终细胞密度为1.5×105个/ml,胶原浓度为1 mg/ml。将0.5 ml混合物加入到24孔板的每个孔中,在37 ℃下聚合30 min。将基质从培养皿底部轻轻分离,基质中的成纤维细胞在完全培养基中培养48 h,其中不含或含有PFD。每隔24 h白光下拍摄。通过Image J软件对凝胶的表面积进行量化。收缩百分比使用公式100%×凝胶表面积/孔表面积,绘制为初始基质面积。每组收缩试验分别独立重复3次,进行统计。
1.2.7鬼笔环肽染色 将细胞固定后,用0.1%Triton X-100渗透,并用5% BSA在PBS中封闭30 min。然后用Alexa-Fluor 488 Phalloidin(A12379,Thermo Fisher Scientific)染色细胞,以观察丝状F-肌动蛋白。每种细胞分别铺3个共聚焦皿,独立进行染色观察。
1.2.8明胶酶谱实验 将来自CAF条件培养基在非还原性样品缓冲液中以1 ∶1稀释,并在含有0.1%明胶的10% SDS聚丙烯酰胺凝胶(ThermoFisher Scientific,Waltham,MA USA)上在125 V下分离150 min。通过在室温下与复性缓冲液(2.5%Triton X-100在水中稀释)孵育30 min来去除SDS。凝胶在显影缓冲液中洗涤30 min,然后在37 ℃的新鲜显影缓冲液中培养48 h。凝胶用考马斯蓝染色。每组实验独立重复3次,观察现象。
1.2.9Transwell实验 在 Transwell小室的底膜使用基质胶铺底后,置入 Transwell专用24孔板中。将处理后的细胞分别与300 μl无血清培养基混合后加入小室内;之后向小室下的孔中加入700 μl含10% FBS培养基。共培养48 h后,弃去培养基,使用甲醇将膜表面的细胞固定。使用结晶紫染色后,将小室晾干,在显微镜下拍照,在光学显微镜下计数细胞。每个样品铺3个小室,每组实验独立重复3次,进行统计。
1.2.10CCK-8实验 细胞铺板于96孔板中,并在24 h内加入PFD作用。24 h后,使用CCK-8检测方法评估细胞活力,设置3个孔,分别独立重复3次实验,进行统计。
1.2.11mRNA表达水平检测 qRT-PCR检测TGF-β的mRNA表达水平。设计引物如下核苷酸序列F:TATTGAGCACCTTGGGCACTGTTG; R: CCTTAACCTCTCTGGGCTTGTTTCC方向(5′-3′);根据EZ-press RNA Purification Kit提取总RNA,用逆转录试剂盒提取cDNA,使用染料法qPCR检测试剂盒进行qRT-PCR检测。

2 结果
2.1 原代CAF提取及功能观察分别从患者胆囊癌组织和胆管癌组织中提取原代CAF细胞,将其名称定义为胆囊CAF和胆管CAF。分别提取2种CAF的蛋白后,通过Western blot检测标志蛋白表达。如图1A所示,Western blot实验显示细胞中的CAF标志蛋白FAP,Vimentin,α-SMA均表达,从而验证CAF的身份。通过鬼笔环肽实验分别对胆囊CAF和胆管CAF染色,图1B显示其成纤维细胞骨架胶原蛋白丰富且呈束状分布,这提示2种CAF的功能可能与胶原蛋白相关从而影响肿瘤微环境。
2.2 CAF中的TGF-β分泌和胶原生成由于TGF-β/SMAD信号通路与成纤维细胞的胶原收缩和生成功能有重要联系[6],所以通过ELISA和Western blot实验进行进一步研究,实验分组为胆囊NF组,胆管NF组,胆囊CAF组,胆管CAF组。ELISA实验表明胆囊CAF和胆管CAF的TGF-β分泌分别强于正常成纤维细胞细胞(3 116.67±567.65),差异有统计学意义(F=82.09,P<0.05)。同时通过Western blot检测胆囊CAF和胆管CAF中胶原蛋白显示,COL1A1,COL3A1,COL4A1相较于正常NF明显表达增高,两者差异有统计学意义(FCOL1A1=54.39,FCOL3A1=112.00,FCOL4A1=186.90,P<0.05)。同时研究也表明胆囊CAF和胆管CAF中TGF-β/SMAD信号通路的标志蛋白p-smad2,p-smad3,smad2/3表达相较与正常NF增高,差异有统计学意义(Fp-smad2=90.04,Fp-smad3=162.20,P<0.05)。这提示胆囊CAF和胆管CAF相比NF具有更强的TGF-β分泌,并且激活TGF-β/SMAD通路来促进胶原生成。见图2。
2.3 PFD抑制CAF对TGF-β分泌和胶原生成的影响为了研究PFD对于CAF中TGF-β分泌和胶原生成的影响,研究分组分为胆囊CAF组,胆管CAF组,胆囊CAF+PFD组,胆管CAF+PFD组。根据图3A,CCK-8实验患者胆囊CAF和胆管CAF在0.6、1.2、2.4、3.6、7.2、14.4 mg/ml PFD处理后与对照组0 mg/ml PFD处理后细胞存活率比较,差异有统计学意义(P<0.05)。故研究选择对两种细胞存活率无影响的PFD药物浓度为0.3 mg/ml。结果如图3B所示, qRT-PCR实验表明PFD组相比对照组TGF-β的mRNA表达水平明显降低, 差异有统计学意义(F=549.3,P<0.05)。图3C显示ELISA实验表明PFD能明显抑制CAF中TGF分泌(2 895.42±855.96), 差异有统计学意义(F=121.00,P<0.05)。同时图3D显示Western blot分析表明PFD能抑制胆囊CAF和胆管CAF的胶原蛋白表达,差异有统计学意义(FCOL1A1=29.94,FCOL3A1=405.90,FCOL4A1=479.10,P<0.05)。在图3E、F动物实验中相同条件下的GBC-SD患者胆囊癌细胞皮下瘤裸鼠模型中,PFD组相比对照组的血清TGF-β浓度明显降低(364.52±220.60),差异有统计学意义(P<0.05)。
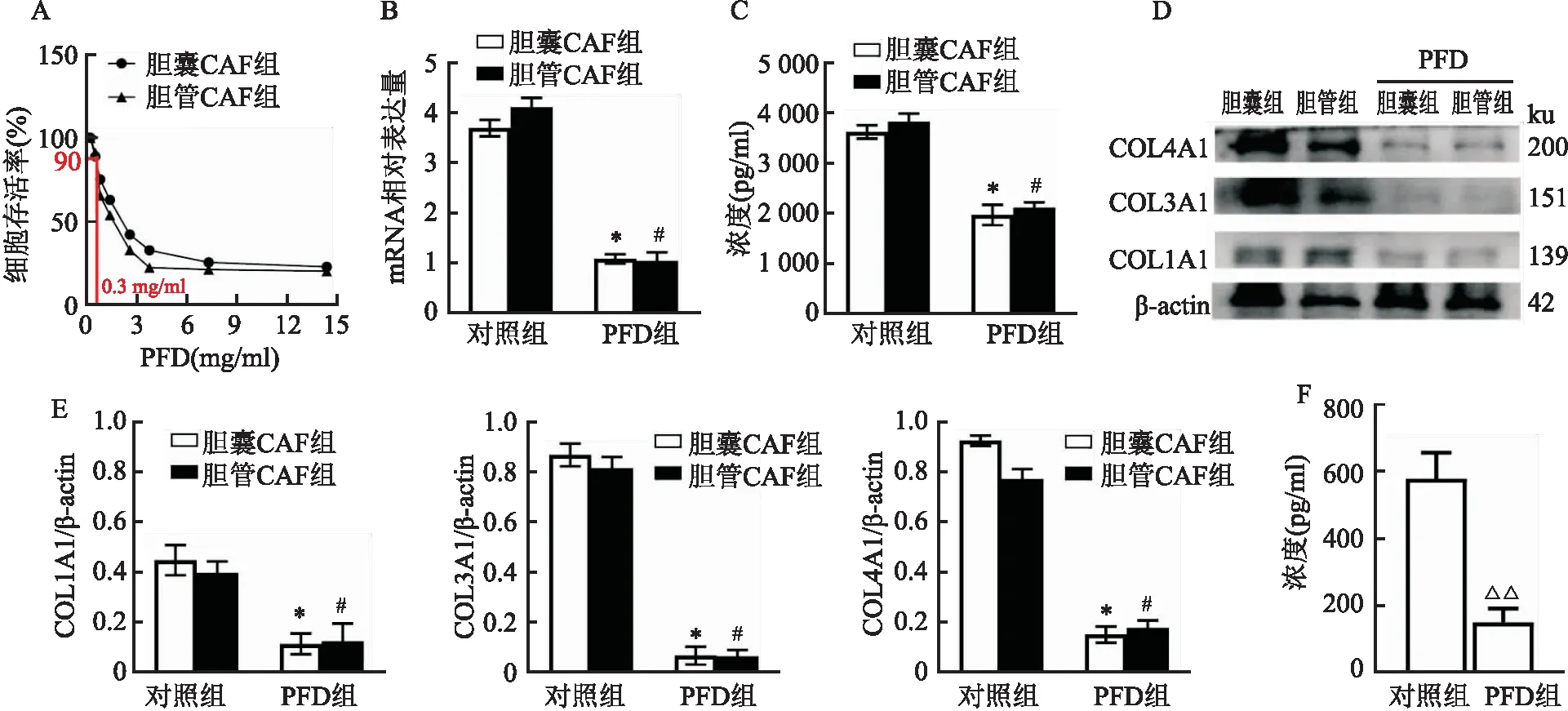
图3 PFD抑制CAF对TGF-β分泌和胶原生成的影响
2.4 PFD对CAF功能的作用为了研究PFD对CAF胶原收缩和重塑的影响进行了相关实验,图4A、B为胶原收缩实验,结果显示,胆囊CAF细胞加入PFD后与对照组24 、48 h收缩具有明显差异,胆管CAF细胞加入PFD后与对照组24 h收缩差异不明显,但是48 h收缩具有明显差异,结果显示PFD能够明显减弱胶原凝胶的收缩功能,两者差异有统计学意义(P<0.05)。胶原收缩与癌相关成纤维细胞的基质重塑能力密切相关。图4C的明胶酶谱实验表明PFD对CAF分泌的MMP2和MMP9具有抑制作用。MMP2和MMP9是胶原重塑和肿瘤微环境形成的重要因素,这说明了PFD能通过CAF对肿瘤微环境的改变起到作用。
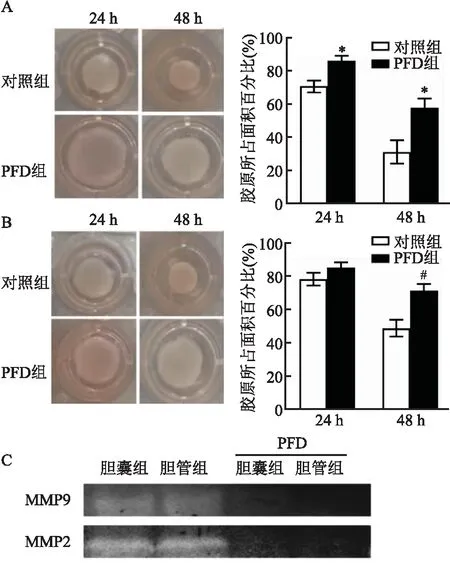
图4 PFD对CAF功能的作用
2.5 PFD通过SMAD信号通路影响CAF功能及肿瘤微环境研究[6]表明,PFD能够抑制TGF-β产生和相关的胶原蛋白产生。图5显示PFD可以抑制CAF中TGF-β下游的SMAD信号通路,p-smad2,p-smad3磷酸化蛋白明显受到抑制,差异有统计学意义(Fp-smad2=193.4,Fp-smad3=575.2,P<0.05)。说明PFD可能是通过SMAD信号通路来抑制胶原蛋白的产生和重塑功能。为了研究CAF对肿瘤微环境的影响,进行了Transwell实验,收集胆囊CAF组,胆管CAF组,胆囊CAF+PFD组,胆管CAF+PFD组的条件培养基,在相同条件下验证患者胆囊癌GBC-SD细胞的侵袭能力的变化,结果显示PFD能够改变肿瘤微环境从而抑制肿瘤细胞侵袭(534.82±56.45),差异有统计学意义(F=123.6,P<0.05)。

图5 PFD通过SMAD信号通路影响CAF功能及肿瘤微环境
3 讨论
肿瘤微环境与肿瘤的发生发展和化疗耐药性密切相关,关系到肿瘤的侵袭功能并且影响肿瘤预后。多数胆囊癌和胆管癌患者术后复发率较高和化疗效果较差,这与肿瘤微环境是密切相关的。伴随对肿瘤微环境的研究增多,研究表明CAF是组成肿瘤微环境重要部分,由于CAF具有异质性,不同CAF的功能具有明显区别。其中注意到胆道肿瘤中的CAF具有myCAF类似功能,可以通过胶原蛋白的生成和重塑对肿瘤微环境的改变起到重要作用。
在胆囊相关研究中表明胆囊癌的周围组织的肌动蛋白染色百分比与正常相比更高,而肌动蛋白是myCAF重要标志。肌动蛋白影响细胞质中应力纤维和束状组织,并且与胶原凝集相关[7]。在CAF的研究中表明TGF-β能够激活CAF的相关功能从而促进肿瘤细胞的侵袭[8]。该研究通过提取原代CAF,进行了鬼笔环肽实验并且验证了TGF-β相关通路蛋白,从而证实了TGF-β信号通路在胆道CAF中的高表达,说明原代CAF具有myCAF的类似功能。在胆管癌肿瘤微环境中胶原的改变和重塑最肿瘤侵袭起到了重要作用[9]。该研究也通过胶原蛋白的Western blot实验进行了验证。
PFD是一类具有广泛的抗纤维化和抗炎特性的药物。PFD能过通过调节前胶原转录和限制成纤维细胞活化和分化为肌成纤维细胞来减缓纤维化[6]。Pirfenidone对不同类型的癌症具有抗肿瘤潜力,在非小细胞肺癌中能提高化疗的敏感性提高肿瘤治疗效果[10]。肿瘤微环境研究[11]表明Pirfenidone具有通过靶向CAF促进乳腺癌细胞上皮间质转化(EMT)和干细胞特征的作用。TGF-β在纤维化中起到了重要作用,通过Western blot实验表明PFD能明显抑制CAF的TGF-β分泌。TGF-β通路主要由TGF-β受体介导的Smad和非Smad信号通路组成。其中,活化的TGF-β与TGF-β受体2结合并激活TGF-β受体1,导致Smad2和Smad3的磷酸化,磷酸化后形成Smad复合物,然后转运到细胞核以调节胶原蛋白和纤连蛋白,影响组织纤维化。
由于CAF在肿瘤基质中对恶性肿瘤的发生和发展起到了促进作用。如果能改变胶原生成和胶原重塑的进程,对肿瘤的发生和发展起到抑制作用。其中有对CAF选择性缺失I型胶原的小鼠的研究表明,I型胶原在肿瘤微环境中的主导力是I型胶原-刚度途径,在I型胶原所产生的机械限制与其刚度介导的作用发生变化时,Ⅰ型胶原可能对肿瘤的侵袭起到促进作用[12]。通过Western blot实验表明PFD能够抑制胶原蛋白的生成,进一步运用胶原收缩和明胶酶谱实验证实PFD能够明显改变CAF的胶原收缩和重塑功能,这提示PFD通过胶原收缩和重塑改变了胶原的机械限制和刚度作用,随后通过Transwell实验表明PFD能够改变CAF这一功能从而抑制肿瘤细胞的侵袭。为了寻求PFD的作用机制,验证了TGF-β下游通路,最后通过Western blot实验证实PFD主要是通过抑制TGF-β影响下游的SMAD信号通路起到作用。
综上所述,该研究通过胆囊CAF和胆管CAF的原代细胞提取,提示在肿瘤微环境下TGF-β/SMAD信号通路影响CAF的胶原合成,其中PFD可以通过抑制TGF-β的产生来阻断SMAD信号通路的激活和改变肿瘤微环境从而抑制肿瘤侵袭。
