SPP1、PD-L1的表达与M2巨噬细胞在肝细胞癌中的关系及对预后的影响研究
2023-07-05吴婧婧
吴婧婧,黄 琦,彭 瑶,杨 洋
肝癌作为全球范围内最常见的癌症之一,发病率在全球范围内呈上升趋势[1]。肝细胞癌(hepatocellular carcinoma,HCC)是肝癌最常见的病理类型,约占90%。尽管传统化疗、肝动脉化疗栓塞、免疫检查点抑制剂、酪氨酸激酶抑制剂等疗法,一定程度上延长了患者的生存期,但总体预后仍较差。因此,迫切需要寻找有效的治疗方法。
肿瘤相关巨噬细胞(tumor associated macrophages, TAM)是肿瘤微环境中浸润的一类重要免疫细胞,以M2型为主,而CD163为目前公认的M2巨噬细胞标志物[2]。分泌性磷蛋白1 (secreted phosphoprotein 1, SPP1) 广泛存在于人体的组织与器官内,其表达在多种肿瘤中均显著上调[3-5],巨噬细胞阳性表达SPP1的结肠癌患者的无进展生存期 (progression free survival, PFS)更短[6]。但目前在HCC中针对SPP1的研究较少,且发挥作用机制尚不完全清楚。程序性死亡因子配体-1(programmed death receptor ligand-1, PD-L1)是程序性死亡因子-1(PD-1)的配体,B7超家族i型跨膜糖蛋白。PD-L1 在人体的多种免疫及肿瘤细胞表面表达[7-9],促进活化 T 细胞凋亡,抑制活化 T 细胞增殖。但HCC的免疫微环境中SPP1和PD-L1在调节巨噬细胞参与肿瘤免疫过程中发挥何种相互作用尚不明确。该研究将探索HCC中SPP1、PD-L1与M2巨噬细胞的表达及与患者预后的相关性,从而为靶向M2巨噬细胞治疗HCC提供一定的实验基础和理论依据。
1 材料与方法
1.1 病例资料该研究整群收集2017—2019年在安徽医科大学第二附属医院初次诊断并接受手术的81例HCC患者和10例癌旁组织(对照组)的石蜡标本,取分界线以外相应一侧2 cm的组织为癌旁组织。全组病例需符合的条件有:① 手术前未接受过放疗或化疗;② 年龄、性别、BCLC分期等资料完整;③ 标本组织经安徽医科大学第二附属医院病理科专家再次确诊为HCC。HCC病人肝组织石蜡切片中男70例,女11例,年龄30~78 (58.2±11.6)岁。其中,年龄≥60岁以上的患者38例(46.9%);BCLC分期A期57例(70.3%),B期14例(17.3%),C期10例(12.3%),无D期患者;肝脏单发肿瘤68例 (84.0%),多发肿瘤13例 (16.0%);肿瘤直径>5 cm 46例(56.8%),肿瘤直径≤5 cm 35例 (43.2%);有HBV感染患者71例(87.7%),无HBV感染患者10例(12.3%)。
1.2 试剂与仪器CD163(美国Santa Cruz公司);SPP1(江苏亲科生物研究中心有限公司);PD-L1(英国Abcam公司);石蜡切片机(上海徕卡仪器有限公司,RM2016); 脱水机(武汉俊杰电子有限公司,JJ-12J), 数字切片扫描仪Pannoramic MIDI(匈牙利3DHISTECH公司);光学显微镜(重庆重光实业有限公司,COIC,XSP-C204)。
1.3 方法
1.3.1免疫组化检测肝组织石蜡切片SPP1、PD-L1和CD163的表达 HCC组织经甲醛固定、梯度乙醇脱水后,将组织和石蜡置于包埋框内,冷却后即成蜡块。进行防脱处理后,Leica石蜡切片机切成厚4~6 μm薄片,将蜡片裱贴于载玻片上,烤干待用。免疫组化法染色按MaxVision二步法进行,具体操作参照说明书。以磷酸盐缓冲液(PSB)代替一抗作阴性对照,已知阳性切片为阳性对照。在光学显微镜(COIC公司,XSP-C204)下结合常规HE切片观察免疫组化切片的染色反应。数字切片扫描仪下进行拍照。
观察 SPP1、PD-L1和CD163在细胞中的染色情况,在细胞膜或者细胞质中出现棕黄色着色为阳性细胞,根据细胞的染色强度以及阳性细胞率进行评分。① 按染色强度记分: 无色0分, 淡黄色1分, 棕黄色2分, 棕褐色3分; ② 按阳性细胞率计分:阳性细胞率≤4%(0分),5%~24%(1分),25%~49%(2分),50%~74%(3分),阳性细胞率≥75%(4分),两者结果相乘即为总评分,总评分≤1分为阴性,2~4分为弱阳性,5~8分为中等阳性,9~12分为强阳性。在该研究中将阴性和弱阳性定义为低表达,中等阳性和强阳性定义为高表达。
1.3.2随访 随访方式为电话随访,截止时间为2022年4月30日。该研究中有 79例患者取得完整随访资料。总生存时间为手术时间到死亡或随访截止时间。到随访截止时间未死亡的患者定义为结尾数据。
1.4 统计学处理应用SPSS 26.0软件进行统计分析。采用四格表的χ2检验、Fisher确切概率法分析两种蛋白在肝癌组织及癌旁组织中的表达与患者临床特征关系。两种蛋白与生存期分析采用Kaplan-Meier 法对总生存期 (overall survival, OS) 绘制生存曲线,并进行log-rank检验影响,生存时间的危险因素采用单因素和多因素Cox回归模型。采用χ2检验分析两种蛋白之间及与M2巨噬细胞表达的相关性。当P<0.05表示差异有统计学意义。
2 结果
2.1 SPP1、PD-L1和CD163在肝癌中的表达81例HCC患者组织中,高表达SPP1、PD-L1和CD163的患者例数分别为39 (48.1%),32 (39.5%)和38 (48.1%),高于癌旁组织 (P<0.05 )。见图1。
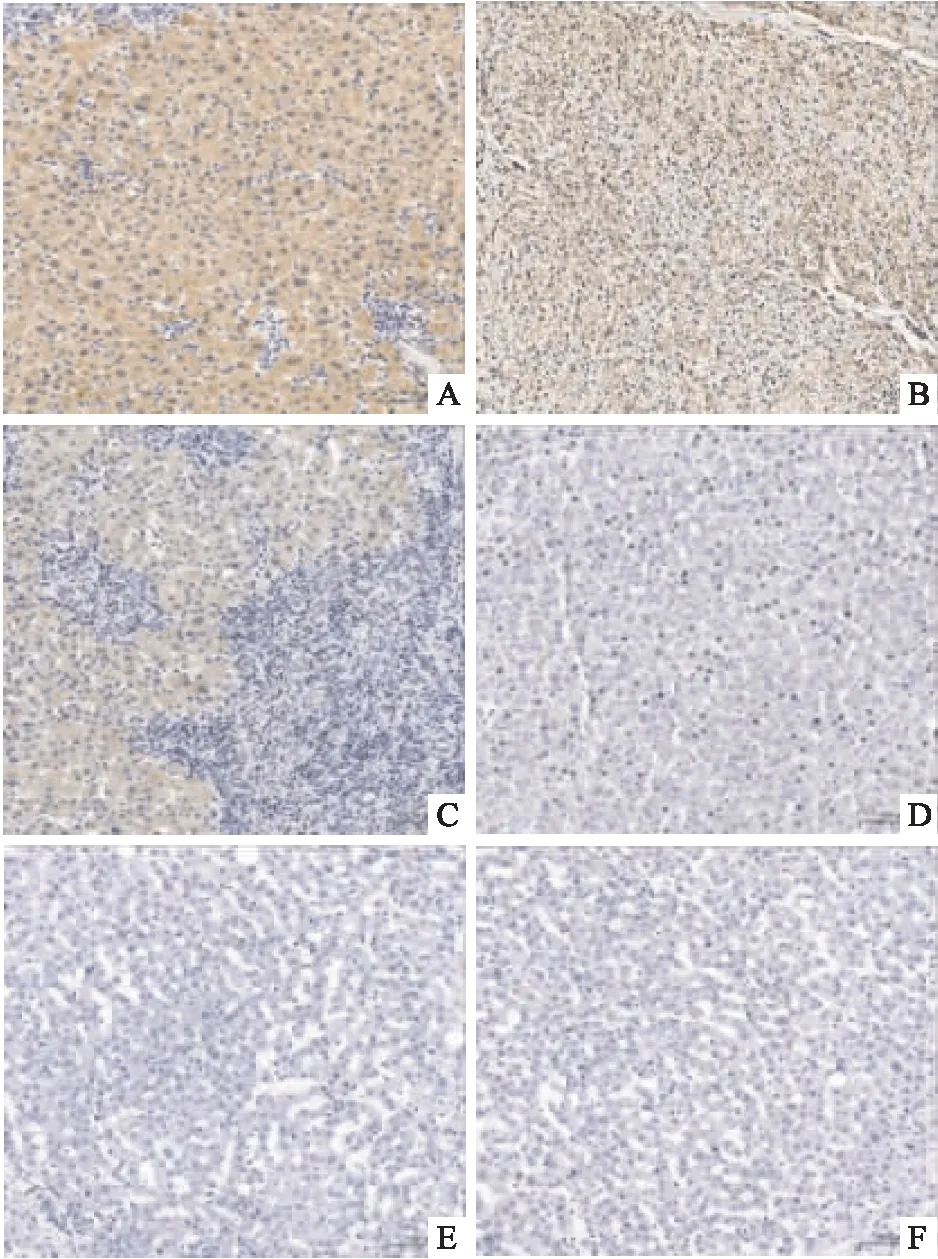
图1 SPP1、 PD-L1和CD163在HCC、癌旁组织中的表达 ×100
2.2 SPP1、PD-L1和CD163的表达与HCC患者临床特征的关系SPP1、PD-L1和CD163的高表达与HCC患者BCLC分期均相关(P<0.05),与年龄、性别均无关(P>0.05)。同时,SPP1的表达还在肿瘤直径大、肝内多发肿瘤的HCC中患者中增高;PD-L1的表达在肝内多发肿瘤、有HBV感染的HCC患者中增高(P<0.05)。见表1。

表1 HCC组织中SPP1、PD-L1和CD163的表达与其临床病理特征的关系(n)
2.3 SPP1和PD-L1在HCC组织中表达的相关性及与HCC患者生存的相关性(包括单因素、多因素生存分析)
2.3.1SPP1和PD-L1在HCC组织中表达的相关性 39例SPP1高表达的HCC患者中有21例PD-L1高表达,SPP1和PD-L1在HCC组织中呈正相关 (c=0.272,P=0.011)
2.3.2生存因素分析 对81例HCC病例进行单因素COX回归模型分析,结果显示BCLC分期、SPP1高表达和PD-L1高表达均与HCC患者预后相关(P<0.05),将上述因素纳入多因素COX回归模型分析,结果显示BCLC分期、SPP1高表达和PD-L1高表达均是影响预后的独立因素(P<0.05)。见表2、3。

表2 81例HCC患者预后的单因素COX回归模型

表3 81例HCC患者预后的多因素COX回归模型
2.3.3SPP1、PD-L1和CD163的表达与HCC患者生存情况的关系 81例患者中79例患者随访,其中73例患者在随访期内死亡(94.9%),死因均与肿瘤相关。全组患者3年生存率为24%,SPP1, PD-L1和CD163的高表达均与预后相关(P<0.01,P<0.01,P=0.01)。见图2。
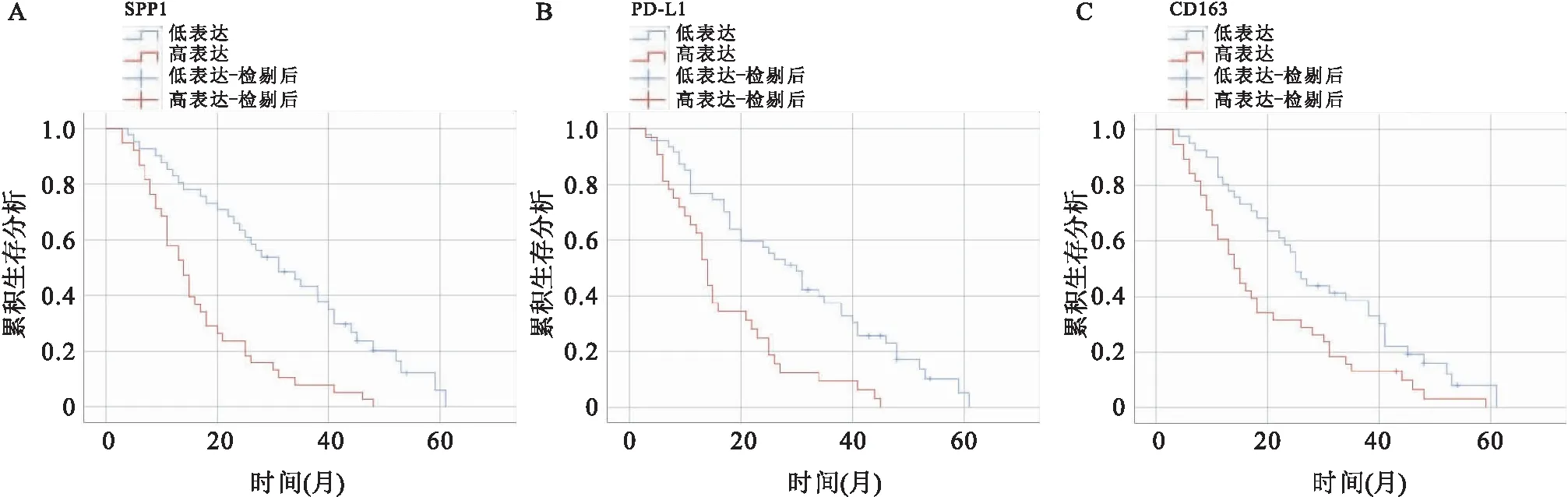
图2 SPP1、PD-L1和CD163的表达与HCC患者生存时间的关系
2.4 SPP1和PD-L1与肝癌组织M2巨噬细胞的相关性39例HCC组织SPP1高表达患者中有30例CD163高表达,SPP1和CD163在HCC组织中呈显著正相关 (r=0.485,P<0.001);32例HCC组织PD-L1高表达患者中有20例CD163高表达,PD-L1和CD163在HCC组织中呈显著正相关 (r=0.226,P=0.038)。
3 讨论
HCC是消化系统常见肿瘤,其病因至今尚不完全明确,缺乏有效治疗手段,总体预后不佳,因此迫切需要新的治疗方法。肿瘤微环境主要指肿瘤细胞与非肿瘤细胞(免疫细胞、成纤维细胞、血管和淋巴管内皮细胞)及细胞外成分(细胞因子及趋化因子,细胞外基质等)相互作用形成的复杂结构。巨噬细胞、T淋巴细胞、自然杀伤细胞(NK细胞)、中性粒细胞、树突状细胞和骨髓源性抑制细胞(MDSCs)等主要免疫细胞组成了肿瘤免疫微环境[10]。巨噬细胞是单核细胞系的分化细胞,不同微环境中,表现为不同亚型,主要分为M1和M2型。一般认为TAM更接近于M2表型,可被IL-10、IL-13、IL-4激活,具有促进肿瘤生长和转移作用[11-12]。
课题组前期研究[13]表明,晚期HCC患者的M2巨噬细胞表达增多,该研究表明M2巨噬细胞在HCC患者肿瘤组织中的高表达明显高于癌旁组织,同时在肿瘤直径大、BCLC分期晚的患者中表达升高。其机制可能为晚期HCC患者中β2-AR表达升高,下游cAMP/PKA/CREB和cAMP/IL-6/STAT3信号通路被激活,使M2巨噬细胞分泌促肿瘤细胞因子如IL-6等增多,促进了肝癌进展。但是否有其他机制作用于M2巨噬细胞,影响肝癌进展仍需深入研究,本文进一步研究了SPP1、PD-L1与M2巨噬细胞及与预后的相关性。
SPP1是一种重要的细胞外基质成分,由多种细胞分泌,包括肿瘤细胞、免疫细胞、成纤维细胞、破骨细胞、平滑肌、淋巴细胞和上皮细胞。在多种肿瘤的肿瘤组织和血清中SPP1的表达上调与患者不良预后相关[14-16]。有研究[17]表明,在肺腺癌中,SPP1可调节巨噬细胞向M2型极化,但具体机制尚不清楚,在HCC中研究较少。该研究表明,SPP1在HCC患者肿瘤组织中的表达高于癌旁组织,在BCLC分期晚、肿瘤直径大、肝内多发肿瘤病灶的患者中升高,且为肝癌患者的独立预后因素,高表达SPP1的患者生存期短于低表达患者。同时,SPP1的表达与M2巨噬细胞的数量呈正相关,提示针对SPP1靶点的治疗可能是改善HCC患者预后的潜在治疗方案。
PD-L1在肿瘤免疫逃逸中起关键作用,靶向PD-L1已成为多种癌症的一线治疗方法[18]。研究[19]表明,抑制SPP1下游Cdk5基因的表达可减弱肿瘤细胞PD-L1的表达,并促进抗肿瘤免疫。本研究中,PD-L1的表达与HCC患者的年龄和性别无明显相关,在肝内多发肿瘤、有HBV感染的HCC患者中增高,且为HCC患者预后独立因素,PD-L1高表达HCC患者生存期较低表达患者缩短。PD-L1的表达与SPP1的表达、M2巨噬细胞的数量呈正相关。上述研究结果为今后在HCC治疗中,联合使用SPP1抑制剂和PD-L1抑制剂提供了一定的理论依据。
综上所述,该研究表明了HCC患者中SPP1、PD-L1和CD163的异常高表达,并且与患者的预后不良密切相关,临床监测SPP1、PD-L1和CD163的表达有助于预测HCC患者的预后。同时SPP1、PD-L1和CD163的表达有一定的相关性,提示SPP1和PD-L1可能通过对巨噬细胞的调节作用影响HCC发生发展。通过抑制SPP1和PD-L1的表达干预HCC肿瘤微环境中巨噬细胞的极化过程,可能为今后HCC的靶向治疗及免疫治疗提供有利的理论依据。
