电针法对兔膝关节炎模型治疗效果及机制研究
2023-07-05郑一鸣李伦兰陈和木
郑一鸣,李伦兰,陈和木
膝关节骨关节炎(knee osteoarthitis,KOA)是一种慢性劳损导致的关节退行性疾病,累及软骨、软骨下骨等结构[1],超过35%的中老年人受其影响[2]。由于软骨无神经与血管组织,被破坏结构和受损的关节软骨修复缓慢。KOA常采用药物和手术治疗[3]。目前,非类固醇抗炎药是治疗KOA的常用药物,但长期用药会产生严重副作用[4]。因此,对于病情较轻或存在手术禁忌证的患者,确定有效安全的干预措施非常重要。电针是一种基于针灸的中西医结合治疗方法,其原理是通过针灸和电的双重刺激来达到治疗疾病的目的[5]。虽然电针已被广泛应用于治疗KOA,但作用机制尚未明确。
该实验研究电针法对兔KOA模型血清、关节液中炎症因子的影响和关节软骨组织形态学改变,观察电针法治疗KOA效果及其作用机制,评价电针法在治疗KOA过程中的应用价值,拓展中医在防治KOA中的积极意义,为KOA的治疗提供新思路。
1 材料与方法
1.1 实验动物及分组18只骨骼完整、6月龄成年雄性新西兰兔(2.25~2.75 kg),由安徽医科大学实验动物中心提供并进行饲养[许可证号:SYXK(皖)2017-006]。动物实验方案经安徽医科大学动物伦理委员会批准(伦理编号:LLSC20221122)。经过1周适应性饲养后,18只新西兰兔运用随机数字表法被分配到空白对照组(A组)、模型对照组(B组)和电针法组(C组),每组各6只。
1.2 主要材料电子针灸治疗仪(型号:CMNS6-1型)购自苏州佳健器械总厂;全波长酶标仪购自无锡华卫德朗公司;高速组织研磨仪购自武汉赛维尔公司;生物组织自动包埋机、石蜡包埋机(冷台)购自湖北贝诺医疗科技有限公司;显微镜购自日本NIKON公司;苏木精-伊红(HE)染色试剂盒购自美国Solarbio公司;兔白细胞介素(interleukin,IL)-1β,IL-6,ELISA试剂盒购自武汉科鹿生物公司,批号:ELK1228、ELK2419;NO试剂盒购自上海碧云天生物公司;一抗:p-P38购自美国Cell Signaling Technology公司,货号4511T;二抗:超敏兔鼠通用二抗购自北京ZSGB-BIO公司,货号:PV-9000。
1.3 方法
1.3.1造模及干预措施 A组未经处理,正常饲养;B组和C组采用改良韦德曼左后肢伸直位固定制动法[6]制备模型。助手控制兔使其呈仰卧位,操作者把兔左后肢拉至充分伸展(膝关节伸展180°,踝关节60°背屈)。从腹股沟到跖趾关节内层缠绕绵纸,外层用树脂绷带包裹1周以巩固固定,待树脂绷带变硬后,最外层以胶带包裹防止兔啃咬。每天早晚巡视,若兔出现足趾充血、肿胀,应立即去除绷带,待肿胀消退后重新造模。若出现树脂绷带滑脱,应立即修复。6周后拆除外部石膏固定装置,驱使兔行走奔跑,B、C组兔膝关节红肿,步态呈跛行、拖行状,膝关节活动范围受限,表明造模成功。所有兔正常饲养1周后继续实验,A、B组自由活动、常规饲养,每周与C组同一时间抓取5次,不做干预,连续4周;C组参照《实验针灸学》[7]叙述,选择内外膝眼、梁丘穴、血海穴,以0.3 mm×25.0 mm毫针进行针刺,直刺或斜刺均可。刺入深度约5 mm,将针与电针治疗仪进行连接,强度以局部皮肤肌肉的轻微震颤为度,频率为2、100 Hz疏密交替,电流强度 1~2 mA,治疗每次20 min,每周治疗5 d,休息2 d,连续4周。
1.3.2行为学观察 干预完成后,采用改良Lequesne MG膝关节级别评估量表作为评分标准,观察各组兔的疼痛、步态、关节活动和肿胀程度。选取2位对该实验分组不知情的实验助理担任评分员,在同一时间对同一只兔进行评分,结果取均值。
1.3.3标本采集 取材方法如下:耳缘静脉取血3~5 ml,静置2 h后取上清液,以3 000 r/min快速离心10 min,-80 ℃贮存待测血清中炎症因子表达水平。空气栓塞法处死兔,暴露左膝浅层滑囊,在髌上囊开口,注射器抽取1 ml无菌盐水灌注于髌上囊中,操作人员充分活动其膝关节,重复回抽直到收集3 ml关节液,快速离心取上清液,置于-80 ℃液氮中。切开关节囊,使膝关节腔充分暴露,切开十字韧带,清除半月板,分离关节。使用咬骨钳取左侧股骨内侧髁,冲洗后固定于4%多聚甲醛中48 h,经修剪、乙醇梯度脱水、常规石蜡包埋、切片后进行HE染色,镜下观察拍照记录。根据Mankin分级标准对软骨退化程度进行分级。
1.3.4ELISA法检测血清、关节液中IL-6、IL-1β含量 按照试剂说明书进行操作,将试样置于酶标板孔的底端,轻轻摇晃搅拌均匀,将盖板或薄膜覆于酶标板上方,37 ℃下孵育80 min后清洗。添加 TMB显色剂溶液,37 ℃下避光培养20 min。最后加入终止液进行检测。
1.3.5Griess法检测血清及关节液NO水平 按照试剂说明书操作,取出Griess reagentⅠ和Ⅱ,静置恢复室温。用待测样品所用溶液稀释标准品,按50 μl/孔,96孔板中加入标准品及样品。按50 μl/孔,各孔中加入室温Griess reagent Ⅰ,按50 μl/孔,在各孔中加入室温Griess reagent Ⅱ,540 nm测定吸光度值。
1.3.6HE染色观察膝关节软骨组织病理形态 切片后行HE染色,将染色后切片放置于镜下放大100倍观察。使用Mankin评分法对膝关节软骨退化程度进行评分,得分越高,说明软骨退化程度越明显。
1.3.7免疫荧光染色法观察兔膝关节软骨组织p-P38 MAPK表达 取制备的石蜡切片经脱蜡、孵育、水洗、浸泡,抗原修复后孵p-P38一抗过夜,孵二抗50 min,复染细胞核后甘油明胶封片,显微镜镜检。每组切片随机选取3个100倍视野拍照,使用Image J软件进行图像采集分析。蓝色荧光为DAPI表达,红色荧光为p-P38阳性表达,Merge为双重荧光染色。

2 结果
2.1 行为学观察与空白对照组比较,模型对照组兔Lequesne评分升高 (P<0.05);与模型对照组比较,电针法组兔Lequesne评分降低 (P<0.05)。见图1。
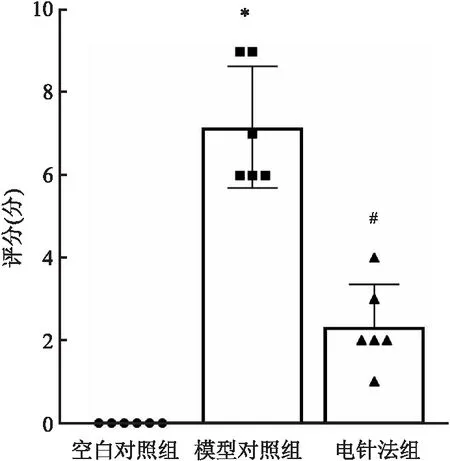
图1 兔KOA模型行为学观察
2.2 各组兔血清、膝关节液中IL-1β、IL-6、NO表达水平与空白对照组比较,模型对照组兔血清、膝关节液中IL-1β、IL-6、NO水平升高 (P<0.05);与模型对照组比较,电针法组兔血清、膝关节液中IL-1β、IL-6、NO水平降低 (P<0.05)。见图2、3。
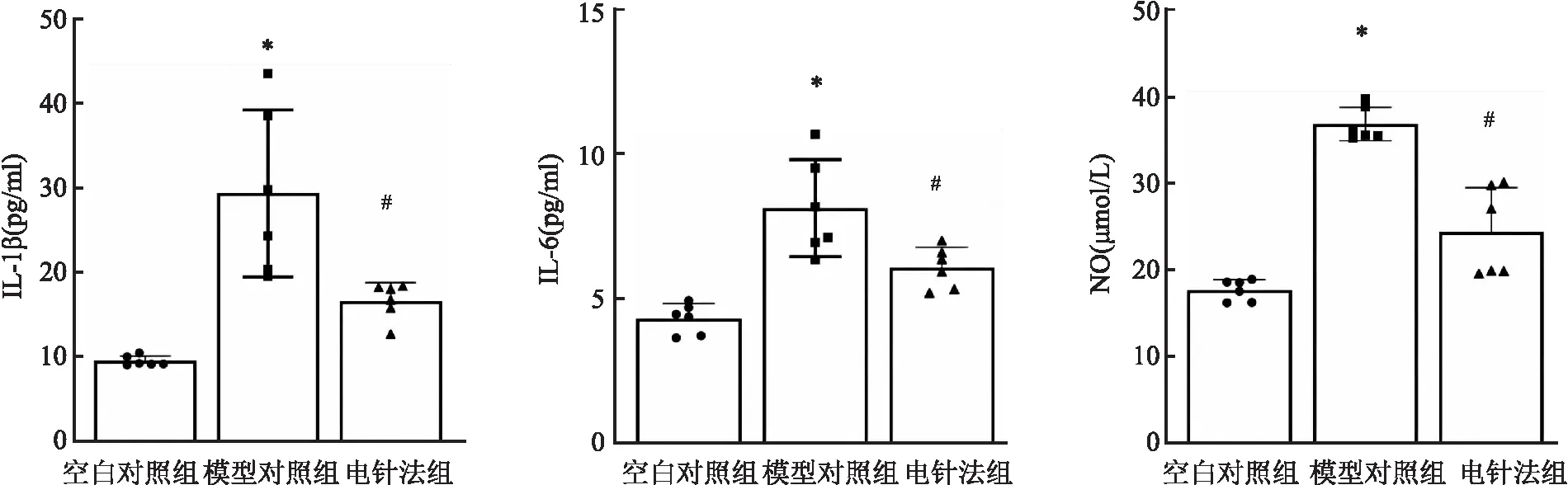
图2 各组兔血清中IL-1β、IL-6、NO表达水平
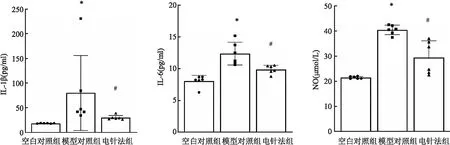
图3 各组兔关节液中IL-1β、IL-6、NO表达水平
2.3 各组兔膝关节软骨组织镜下病理形态观察HE染色结果显示,空白对照组软骨细胞核完好,呈梭状有序排列,可见清晰潮线;模型对照组切面损伤较大,细胞簇状无序排列,潮线不清;电针法组软骨细胞外形基本正常,胞核和胞膜完好,可辨潮线。见图4。
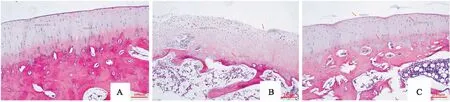
图4 各组兔膝关节软骨组织镜下病理形态 HE×100
2.4 软骨组织Mankin评分与空白对照组比较,模型对照组Mankin评分升高(P<0.05);与模型对照组相比,电针法组Mankin评分降低(P<0.05)。见图5。
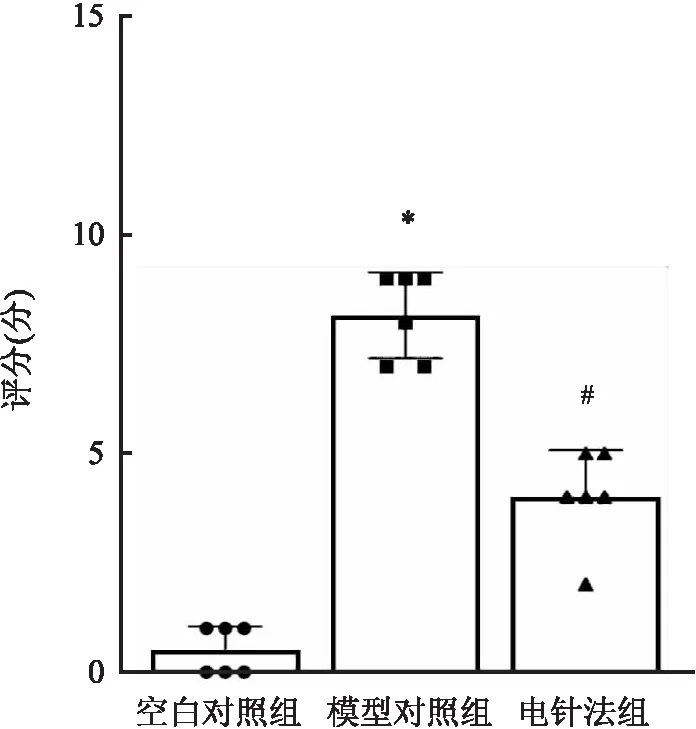
图5 各组兔膝关节软骨组织Mankin评分比较
2.5 各组兔膝关节软骨组织免疫荧光p-P38表达与空白对照组比较,模型组膝关节软骨组织p-P38免疫荧光染色阳性细胞数量增加(P<0.05);与模型对照组相比,电针法组膝关节软骨组织p-P38免疫荧光染色阳性细胞数量减少(P<0.05)。见图6、7。

图6 各组兔膝关节软骨组织免疫荧光染色 ×100

图7 各组免疫荧光染色p-P38阳性细胞比例比较
3 讨论
KOA是影响人类健康的常见关节疾病之一,通常认为是生物学和机械损伤共同作用下,软骨细胞、软骨外基质等合成降解失衡产生的结果。研究[8]表明,炎性因子及软骨代谢相关细胞因子是导致KOA发病的重要因素。
针灸疗法,包括手针、电针等,被认为是预防和延缓KOA进展的有效干预措施。研究[9]表明,手针对于KOA患者具有一定治疗效果。电针在手针的基础上,将针灸与电脉冲相结合,其机制可能是内分泌系统释放激素,自主神经系统释放神经递质,调节细胞因子分泌和机体免疫反应,缓解患者的临床症状。研究[10]表明,电针法对KOA有良性作用,但具体机制尚不明确。
该研究采用Lequesne评分评价电针法干预治疗后的各组兔膝关节功能。评分结果显示,与模型对照组相比,电针法组兔Lequesne评分显著降低(P<0.05),表明电针法能改善KOA膝关节功能,对KOA有一定治疗作用。
细胞因子由多种细胞分泌、调控、介导免疫及炎症反应。研究[11]表明,IL-1β、IL-6、NO在KOA患者滑液中表达增加。IL-1β可促进金属蛋白酶MMP家族和Ⅱ类胶原蛋白合成,诱导性NO合成酶激活,产生大量下游产物[12],强烈刺激iNOS mRNA转录,合成大量NO[13]。高浓度NO一方面抑制软骨细胞,降低其再生能力;另一方面增强血管通透性,导致关节液渗出。IL-6只在KOA患者滑膜中可被检出,加剧关节炎症反应[14],调节MMPs,促进破骨细胞激活,加速基质和成纤维细胞的降解,进一步损害膝关节软骨。MAPK信号转导通路是由多种细胞因子活化的丝氨酸-苏氨酸激酶,受IL-1β等炎性因子刺激时,MAPK通路以逐步磷酸化的方式被激活,加快诱导关节软骨细胞外基质的降解,诱发KOA。研究[15]表明,MAPK信号转导通路是KOA重要信号转导通路,参与软骨细胞增殖、凋亡和炎症反应等多种生理过程。该研究通过动物实验显示,KOA兔经过4周电针法治疗后,血清、关节液中IL-1β、IL-6、NO表达水平较模型对照组降低(P<0.05),膝关节软骨组织中p-P38表达较模型对照组下降(P<0.05)。镜下病理形态观察电针法组呈大致正常状态,与Mankin评分结果一致,表明电针法治疗KOA机制是一种多靶点、多机制的综合调控系统:软骨表面损伤导致血管裂纹增多,同时,炎症因子刺激软骨,引起软骨钙化。干扰软骨和软骨之间相互作用,形成KOA的“恶性循环”。电针法通过下调血清和关节液中炎性因子表达水平,阻遏细胞内炎性物质释放,阻止了“恶性循环”的发生。
