APETx2对感染后肠易激综合征小鼠内脏敏感性的作用及机制
2023-07-05肖红云田平平袁丽萍
肖红云,李 欢,闫 波,潘 颖,田平平,袁丽萍,3
感染后肠易激综合征(post-infection irritable bowel syndrome,PI-IBS)是一种常见的功能性胃肠道疾病,其特征是在急性胃肠炎发作后出现慢性间歇性腹痛、结肠运动障碍和肠道习惯改变[1]。据报道,约3.7%~36.0%的IBS患者有急性胃肠炎或寄生虫感染病史。IBS 的病理生理机制尚未完全阐明,大量研究[2]表明,肠道黏膜的低度炎症、肠道黏膜屏障的功能障碍和内脏高敏感在介导PI-IBS的发病机制中起着重要作用。目前IBS的治疗方法主要是暂时缓解症状,药物治疗对腹痛和腹胀等症状疗效不确切。
酸敏感离子通道 (acid sensing ion channels,ASICs) 主要是由细胞外酸化激活的质子门控阳离子通道,可以检测因组织损伤、炎症、缺血等发生的组织酸中毒,从而激活周围的痛觉神经并将疼痛信号传输到中枢[3]。ASICs在整个疼痛通路中广泛表达,特别是酸敏感离子通道 3(acid sensing ion channel 3,ASIC3)在周围神经系统中广泛分布。研究表明抑制ASIC3在胃肠道的表达,可以降低IBS的结肠扩张压力和内脏超敏反应。该研究旨在探讨一种强效的 ASIC3 选择性阻断剂APETx2对 PI-IBS 小鼠内脏超敏反应的调节作用。
1 材料与方法
1.1 实验动物SPF级成年NIH雄性小鼠18只,4~6 周龄,体质量20~25 g, 购自北京维通利华实验动物技术有限公司,合格证号为SCXK(京)2016-0011。小鼠饲养于安徽医科大学实验动物中心,分笼饲养、自由饮食,12 h 光照、黑暗交替节律。所有小鼠实验前在同一环境中适应性喂养7 d。
1.2 主要试剂APETx2(上海信裕生物科技有限公司);印度墨汁(上海源叶生物科技公司);兔抗小鼠瞬时受体电位香草素1(transient receptor potential vanilloid 1,TRPV1 )(BS60454, 美国Bioworld公司);兔抗小鼠降钙素基因相关肽(calcitonin gene-related peptide,CGRP)(DF7386,美国Affinity公司);兔抗小鼠ASIC3(bs-12132R,北京博奥森生物技术有限公司);TRIzol试剂(15596018,美国 Thermo 公司);逆转录试剂盒(日本TaKaRa 公司); HRP-羊抗兔IgG (ZB-2301,北京中杉金桥生物技术有限公司);RIPA细胞裂解液(P0013B,上海碧云天生物技术有限公司);PVDF 膜(IPVH00010,上海密理博贸易有限公司)。
1.3 PI-IBS 模型制备及给药NIH小鼠采用含400~500条旋毛虫幼虫的0.2 ml生理盐水灌胃,构建PI-IBS模型;根据腹壁回撤反射(abdominal withdrawal reflex,AWR)结果评估内脏敏感性,选择造模成功小鼠进行实验。将这些小鼠随机分为PI-IBS组、APETx2组,同时设立对照组,每组6只。对照组给予等体积生理盐水灌胃。饲养8周后,APETx2组给予120 μg/kg APETx2,每天腹腔注射1次,连续7 d;对照组和PI-IBS组则给予等体积生理盐水,每天腹腔注射1次,连续7 d。幼虫从先前感染的旋毛虫的雄性昆明小鼠中获得。
1.4 各组小鼠一般情况观察各组小鼠毛色、活动情况、对外界反应情况、粪便性状。
1.5 各组小鼠肠道动力检测给药结束后,小鼠均用0.2 ml的印度墨汁灌胃。各组小鼠单笼饲养。记录每只小鼠首次排黑便的时间并收集粪便颗粒数每2 h一次,持续6 h。该实验用于评估小鼠胃肠道功能情况。
1.6 AWR测试评估小鼠内脏敏感性实验前将小鼠禁食24 h自由饮水后,轻轻麻醉小鼠,将8 F导尿管插入肛门 6~8 cm并固定在尾部。之后将小鼠放在透明盒上,保证小鼠只能一个方向运动且不能翻转。在小鼠从麻醉中完全恢复后,向气囊内注入水。水容量依次为 0.25、0.35、0.50、0.65 ml。球囊扩张每次持续30 s并评估腹部退缩反射后休息20 s,重复 3 次,进行下一梯度时间隔5 min。观察小鼠对不同程度扩张压力的行为反应。操作者和观察者采取双盲的方法进行 AWR 评分,取3次数据的平均值作为结果。AWR评分标准:0 分,对刺激无反应;1 分,仅出轻微的头部运动;2 分,腹部肌肉轻度收缩但腹部未抬起;3 分,腹部肌肉强烈收缩且腹部抬起;4 分,腹部肌肉收缩更强烈,背部拱起,腹部、骨盆和会阴部抬离地面。
1.7 免疫组织化学法检测小鼠结肠组织中CGRP蛋白表达将小鼠结肠组织,于PBS溶液中冲洗,石蜡包埋,4%多聚甲醛固定后切成5 μm厚切片。脱蜡、水化和抗原高压修复后。将切片与一抗CGRP(1 ∶300)在37 ℃下孵育1 h。滴加二抗孵育30 min后,滴加DAB显色剂,复染、脱水后封片,在光学显微镜下观察。使用Image-Pro Plus图像分析系统采集并分析每张切片的平均吸光度值(mean optical density,MOD)。MOD值越大意味阳性表达越高。每张切片随机读取200倍视野进行观察。
1.8 qRT-PCR法检测小鼠结肠组织中脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)、CGRP mRNA表达水平使用TRIzol试剂从结肠组织中提取总RNA。按照逆转录试剂盒说明书,将RNA逆转录成cDNA。使用 SYBR Green PCR Kit进行PCR扩增,加入上、下游引物。所有引物均由上海生工生物工程构建。具体步骤: 95 ℃,60 s,1个循环进行预变性;95 ℃,20 s,60 ℃,60 s,40个循环为PCR反应条件。采用 2- △△Ct公式分析目的基因的相对表达量,其中△Ct值=目的基因 Ct 值-β-actin Ct 值。以β-actin作为内参,所有基因引物序列信息见表1。

表1 基因的引物序列
1.9 Western blot法检测小鼠脑组织中ASIC3、CGRP和TRPV1蛋白表达用RIPA裂解液提取总蛋白,5~10 μl蛋白样品电泳,转移并封闭,然后用一抗ASIC3(1 ∶1 000)、CGRP(1 ∶1 000)和TRPV1(1 ∶1 000)在4 ℃下孵育过夜。然后与辣根过氧化物酶标记的山羊抗兔IgG抗体(1 ∶20 000)在室温下孵育1 h。之后使用ECL发光试剂盒检测蛋白。用Image J软件读取目标条带的灰度值,以GAPDH为内参,对目的蛋白进行半定量分析。

2 结果
2.1 各组小鼠一般情况比较对照组小鼠皮毛整齐有光泽,粪便呈颗粒状硬度适中,活动量正常。PI-IBS组小鼠活动减少,皮毛光泽变暗,形体未见明显消瘦,有不同程度的稀便,粪便不成型。与PI-IBS组比较,APETx2组小鼠活动增加,较前温顺,皮毛恢复光泽,粪便多成型,硬度适中。
2.2 各组小鼠首次排黑便时间及6 h粪便颗粒数的比较对照组、PI-IBS组和APETx2组的小鼠首次排黑便的时间分别为(387.10±47.81)、(110.00±17.35)、(337.80±76.02)min。与对照组相比,PI-IBS组的小鼠首次排黑便的时间显著降低(P<0.01);与PI-IBS组相比,APETx2组的小鼠首次排黑便的时间显著延长(P<0.01)。与对照组相比,PI-IBS组小鼠在2、4、6 h的粪便颗粒数明显增加(P<0.01)。与PI-IBS组相比,APETx2组的小鼠2、4、6 h的粪便颗粒数明显减少(P<0.01)。结果表明,APETx2治疗改善了PI-IBS小鼠的胃肠道运动能力。见表2。

表2 各组小鼠首次排黑便时间及6 h粪便颗粒数
2.3 各组小鼠AWR评分比较与对照组比较,当结直肠扩张的水容量依次为0.25~0.65 ml时,PI-IBS组AWR评分均显著升高(P<0.01)。与PI-IBS组比较,APETx2组在结直肠扩张的水容量依次为0.25~0.65 ml时,APETx2组与PI-IBS相比AWR评分均显著降低(P<0.05)。见表3。

表3 各组小鼠AWR评分
2.4 各组小鼠结肠组织中CGRP蛋白表达比较免疫组织化学染色显示:CGRP在结肠中主要表达于黏膜层及黏膜下层的细胞质中,阳性细胞呈棕黄色。与对照组比较,PI-IBS组结肠中的CGRP阳性表达水平明显升高(P<0.01)。与PI-IBS组比较,APETx2组中CGRP的阳性表达水平明显降低(P<0.01)。见图1和表4。
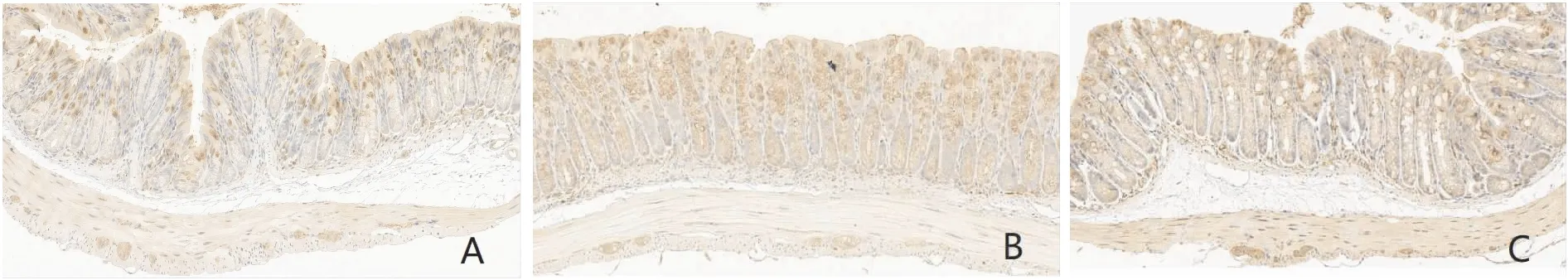
图1 免疫组化测定各组小鼠结肠组织中CGRP表达 ×200

表4 各组小鼠结肠组织中CGRP平均吸光度值
2.5 各组小鼠结肠组织BDNF、CGRP mRNA表达比较与对照组比较,PI-IBS组小鼠结肠组织中BDNF、CGRP mRNA表达明显增加(P<0.01)。与PI-IBS组比较,APETx2组小鼠结肠组织中的BDNF、CGRP mRNA表达水平明显降低(P<0.01)。见图2。
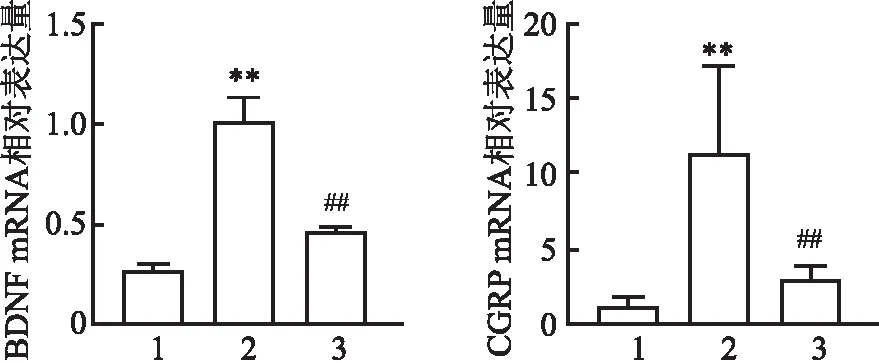
图2 各组小鼠结肠组织BDNF、CGRP mRNA表达水平
2.6 各组小鼠脑组织中ASIC3、CGRP和TRPV1蛋白表达比较与对照组比较,PI-IBS组脑组织中ASIC3、CGRP和TRPV1蛋白的表达显著增多(P<0.01)。与PI-IBS组比较,APETx2组脑组织ASIC3、CGRP和TRPV1蛋白的表达显著减少(P<0.01)。见图3。

图3 各组小鼠脑组织中ASIC3、CGRP和TRPV1蛋白表达
3 讨论
IBS的是一种多因素导致的疾病,其中内脏超敏反应是导致IBS症状的主要原因。IBS慢性内脏超敏反应的机制尚不清楚,但是ASIC3作为酸性和原发性炎症疼痛的传感器,参与内脏超敏反应的信号转导。因此,假设抑制ASIC3通道可以缓解IBS的内脏超敏反应。实验结果显示APETx2,一种特异性的ASIC3通道阻断剂,可以明显改善PI-IBS小鼠因感染旋毛虫而引起的内脏超敏反应以及胃肠道传输功能。
内脏敏感性增高涉及复杂的超敏反应过程,主要包括外周和中枢神经系统的异常相互作用以及脑肠肽异常分泌等[4]。其中,TRPV1、CGRP、BDNF作为相关神经肽参与IBS的发展过程并对肠神经系统具有调节作用。ASIC3在周围神经系统和伤害感受器中广泛表达,用于检测与组织酸中毒相关的疼痛。胃肠道的慢性炎症、癌症和缺血往往伴随着组织酸化,这激活了周围感觉神经细胞上的ASIC3蛋白,从而介导胃肠道疾病的慢性腹痛[5]。同时,ASIC3也参与结肠对机械刺激的过敏反应,这些功能影响及其炎症和非炎症病理的上调使ASIC3 成为管理与功能性胃肠道疾病相关的内脏过敏和疼痛的潜在目标[6]。该研究显示,与PI-IBS组比较,APETx2显著降低PI-IBS小鼠脑组织ASIC3含量。同时,小鼠胃肠道传输功能测定结果表明,给药后,小鼠首次排黑便时间与6 h内粪便颗粒数均显著降低(P<0.01)并且小鼠直肠扩张的疼痛阈值明显增加。结果提示,APETx2可以通过下调脑组织ASIC3含量从而调节PI-IBS内脏敏感性、改善IBS的结肠运输功能。
TRPV1属于瞬时受体电位(TRP)通道家族,是一种钙渗透性的离子通道,在胃肠道中广泛表达[7]。TRPV1可以感知病理性疼痛,从而产生痛觉过敏,整合疼痛信号[8]。TRPV1通过辣椒素的激活促进Ca2+内流,作用于初级传入纤维CGRP和其他脑肠肽,从而调节内脏感觉和胃肠道运动[9]。CGRP是一种胃肠肽,广泛存在于胃肠道壁内的神经丛中,具有调节胃肠道运动和肠道疼痛传入中枢作用,并作用于辣椒素敏感的感觉神经末梢[10-11]。CGRP调节肠道感觉和运动功能,增强肠道运动,并与肠道感觉异常和内脏超敏反应有关[12]。该研究APETx2组TRPV1和CGRP的表达水平显著低于PI-IBS组。结果提示,APETx2可以通过下调TRPV1和CGRP的表达从而改善PI-IBS症状。
BDNF是一种广泛表达在神经系统和外周组织中的神经营养因子,参与调节由不同刺激引起的疼痛超敏反应并在介导肠道感觉和运动方面起着重要作用[13-14]。在IBS患者中,BDNF的过度表达导致肠道黏膜神经结构的改变(增加黏膜神经纤维总数和超微结构损伤),从而导致肠道运动障碍。此外,BDNF升高的程度与腹痛的程度和频率显著相关,其异常升高可导致多种疼痛相关感觉,例如慢性疼痛、炎症性疼痛和内脏疼痛。近年来,研究表明BDNF与许多慢性疼痛疾病有关,并且在胃肠道中也大量表达。BDNF不仅与一种或多种神经递质联合作用,还能增加P物质和CGRP等因子的释放。结果显示,PI-IBS组脑组织中BDNF和CGRP的表达水平以及结肠组织中CGRP的表达水平都显著升高。APETx2治疗明显降低了脑组织中BDNF和CGRP的表达水平以及结肠组织中CGRP的表达。研究表明,APETx2可以通过降低BDNF表达水平进而通过下调CGRP表达来降低IBS的内脏超敏反应并改善结肠转运功能。
综上所述,ASIC3可能在旋毛虫诱导的IBS的发展中起作用,在体内阻断ASIC3的激活可以改善IBS的内脏敏感性和肠道传输功能。APETx2对PI-IBS小鼠内脏敏感性的调节作用包括脑肠肽的多个环节、水平和表达作用,对单一脑肠肽水平的变化或某一途径的单一研究不能完全揭示APETx2调节IBS症状的复杂机制。ASIC3有可能成为IBS治疗的一个潜在靶标。
