杜仲组织培养外植体的选择和消毒
2023-07-03陈自华
陈自华
(定远县林业局,安徽滁州 239000)
杜仲(Eucommia ulmoides)为杜仲科杜仲属药用落叶乔木,中国所特有的第三世纪孑遗植物、国家二类重点保护植物,不仅是重要的经济树种,也是中国名贵滋补药材,使用量极大,具有很高的栽培价值[1-5]。杜仲的药用部位一般是指杜仲树干燥后的树皮。据《本草纲目》记载,杜仲干燥后的树皮味甘,性温,有调理冲任、固经安胎的功效,且在《神农本草经》中也被列为上品。目前,我国药用木本植物资源的开发利用还具有一定的局限性,随着人们养生意识的增强及植物组织培养新领域的发展,植物组培将成为苗木培育和开发药用植物资源重要的、新的途径。
杜仲为雌雄异株、异花授粉的植物,在进行繁殖时,如果采用有性方式,获得的子代没办法完全保留母株的优良基因,且受到时间和季节的限制。因此,为增加杜仲种苗的扩繁速度和育苗效率,同时保留母本植株的优良基因性状,满足市场需求,采用植物组培的方式来进行育苗。笔者选用华中8 号优良母株作为外植体,采取其不同外植体部位,利用不同的消毒方式进行处理,并进行试验研究,以期找出杜仲外植体选择和消毒的适宜方式方法,为其组培快繁技术提供依据。
1 材料与方法
1.1 试验材料
1.1.1 植物材料。试验地位于安徽省滁州市皇甫山三界林场内,该林场自21 世纪20 年代开始引种杜仲并进行优选,目前主要有华中8 号、华中5 号、彩叶杜仲3 个品种。试验组选在4 月上旬至下旬无风晴朗的上午,挑选华中8号健康、长势良好的优良母株作为外植体,分别采集其带顶芽、幼嫩茎段、中部茎段和基部茎段的上部枝条,并立即带回实验室备用。
1.1.2 主要的药品和仪器。组培育苗实验室位于滁州市定远县西卅店镇东方金桥公司组培室内,实验室仪器设备齐全先进,条件良好,非常适宜进行植物的组织培养。实验室具有培养基配制常用的化学药品、外植体处理消毒剂、灭菌锅、自动灌装机、笔式酸度计等,及接种用的超净工作台和电子分析天平、电子精密天平、鼓风干燥箱等其他试验所需的仪器设备。
1.2 试验方法
将采集回来的带顶芽、幼嫩茎段、中部茎段和基部茎段的上部枝条取出,去除多余叶片和杂枝,放置在自来水下用流水和洗洁精液体清洗掉表面杂物,取出后放置阴凉处晾干,再用自来水冲洗2.0~2.5 h。预处理结束后,拿到实验室中,在无菌条件下用剪刀分别按照试验需求长度剪成顶芽、幼嫩茎段、中部茎段和基部茎段,先用75%酒精浸泡30~40 s,后用无菌水反复清洗5~6 次,再用配制好的不同消毒剂分别浸泡处理,浸泡过程中不断轻轻摇晃,用无菌水反复清洗6~8 次,结束后取出放入无菌的容器中备用。在无菌接种操作台上切去外植体材料与液体接触的约2 cm 伤口部分,再分别根据所需大小切接于配制好的无菌培养基上[6-7]。
基本培养基采用经过试验室改良的MS 培养基,即改良的MS+6-BA(0.1~0.5 mg/L)+NAA(0.3~0.5 mg/L),培养基需要在接种前1 周就配制好并放在无菌室中静置观察1周左右,确保没有污染或者其他情况方可使用。转接好的培养物放置在恒温培养室中进行观察,培养室温度保持在(25±2)℃,空气湿度保持在70%~75%,光照时间设置前7 d 每天10 h,之后每天14 h,光照强度2 000~2 500 lx。统计3~20 d不同处理的污染率、存活率、枯死率等,并进行分析。
2 结果与分析
2.1 不同消毒剂处理对杜仲外植体消毒效果的影响
根据试验,采用不同的消毒方法,杜仲外植体在消毒处理后的效果也不同,为了获得更多无菌苗的数量,找到相对有效的消毒方法,试验采用几种不同的消毒剂对其外植体进行处理。以杜仲的幼嫩茎段作为外植体材料,采用木本外植体常用的0.1% HgCl2、10%次氯酸钠、6%次氯酸钠、8%~10% 84 消毒液4 种不同的方式消毒10 min,其他处理步骤保持一致。将处理好的外植体材料转接到改良的MS+6-BA(0.1~0.5 mg/L)+NAA(0.3~0.5 mg/L)培养基上,每盒接种2 个点,1 个月后统计获得的无菌苗个数,进行数据分析。
由表1 可见,几种处理方式中,采用0.1% HgCl2消毒的无菌苗获得数最多,污染率最低,按照污染率从低到高排序,依次为0.1% HgCl2(15%)<10%次氯酸钠(30%)<6%次氯酸钠(55%)<8%~10% 84 消毒液(80%),因此,选用0.1% HgCl2进行消毒较为适宜。

表1 不同消毒方式对杜仲外植体的消毒效果
2.2 消毒时间对杜仲外植体的影响
经过上述试验结果可知,0.1% HgCl2消毒剂处理杜仲外植体时,污染率较低,比较适宜。但表面消毒剂为重金属化学剂,对于植物组织也可能会有毒害作用,如消毒时间过短无法起到好的消毒效果,时间过长则导致植物组织死亡,因此时间不同会产生不一样的消毒效果,在进行外植体消毒时应当根据具体植物种类而选择消毒剂合适的处理时间,尽量减少外植体的死亡[8]。因此,研究不同的消毒时间对杜仲外植体无菌苗获得的影响,以期获得更佳的消毒方式。将杜仲幼嫩茎段放在0.1% HgCl2消毒剂中浸泡的时间分别设置为4、6、8、10、12 min 5 个时间段。
由图1 可知,在0.1% HgCl2消毒剂进行外植体消毒时,在刚开始的6~8 min 污染量随着灭菌时间的增长而降低,超过8 min 后污染率虽仍在下降,但是枯死率却在不断上升,从而导致存活率降低,可能是外植体浸泡时间过长受到重金属汞离子的毒害而产生死亡。综上,采用0.1%HgCl2进行外植体消毒时,在考虑降低污染率的同时也要控制好消毒时间。根据试验结果,在消毒8 min 时杜仲外植体的存活率最高,为92%,此时污染率和枯死率都较低,因此,杜仲无菌体系建立外植体以0.1% HgCl2进行消毒处理时,时间以8 min 最佳。此结果对于杜仲组培技术外植体的处理方式起到了很好的指导作用,有利于外植体处理获取无菌苗。

图1 0.1% HgCl2 消毒剂不同消毒时间对杜仲外植体的影响
2.3 不同外植体取材部位对杜仲存活率的影响
找到最适宜的消毒方式后再进行最佳外植体取材部位的研究,将预处理后的杜仲不同植物组织部位(顶芽、幼嫩茎段、中部茎段、基部茎段)放入0.1% HgCl2消毒剂中浸泡消毒8 min,后用无菌水反复清洗5~6 次,再把各部位剪切成所需大小分别接入经过实验室改良的基本培养基中,每盒2 个点,共100 个,于培养室中按照上文所述方法进行培养,并统计其污染、枯死以及存活的数量。
从表2 可以看出,统计结果中外植体的顶芽没有统计到枯死数量,且采用上述方式处理的污染率最低,因此相对存活率最高,达到96%。存活率由高到低的顺序为顶芽>幼嫩茎段>中部茎段>基部茎段,基部茎段的存活率最低,只有28%。说明在4 月取外植体时间比较适宜,且杜仲的顶芽带菌数量较少,比较适宜作为外植体材料。

表2 杜仲外植体不同取材部位的消毒效果
2.4 不同外植体取材部位对杜仲不定芽诱导的影响
根据上述试验,统计了不同部位存活后不定芽的诱导情况,结果见表3。在进行杜仲组培时,不定芽诱导能力的强弱与其存活率呈正比,其中部分点虽然未被污染,但后期也未曾诱导出不定芽,说明不同部位不定芽诱导能力也不同。诱导不定芽能力最强的是顶芽,基部茎段诱导不定芽能力最低;杜仲诱导愈伤组织能力较强。
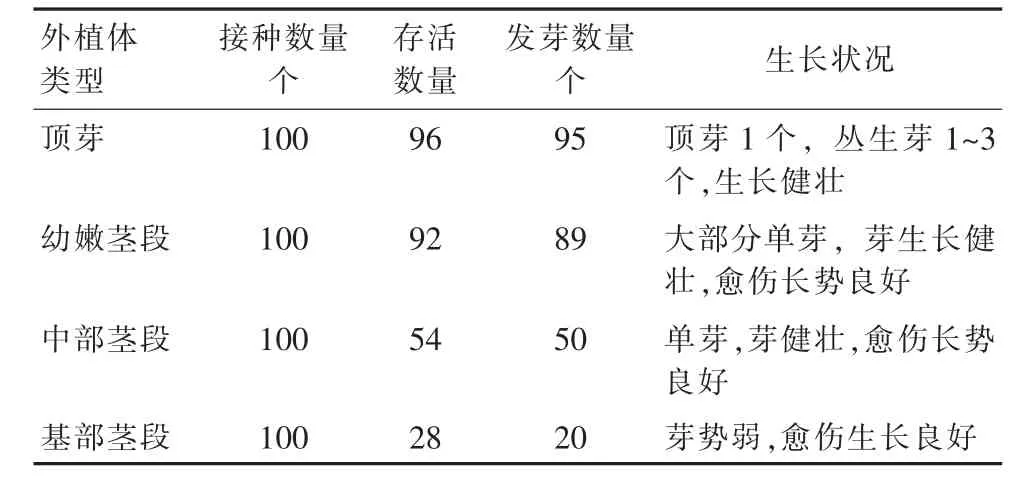
表3 杜仲不同外植体部位的不定芽诱导效果
3 结论与讨论
在进行植物组织培养研究时最关键的是植物无菌苗的获得,外植体的材料大多来自自然环境中,其在生长过程中不可避免会带有各种各样的细菌和真菌[9],且植物在生长的不同成熟阶段,其本身携带的菌类数量和种类也会有差异,为了让植物材料能够减少被细菌或者真菌感染,获得足够多的无菌苗,需要对外植体材料进行特殊处理。所以在开展组织培养时,外植体材料的选择和消毒的方式是决定组培成功率的一个重要且必不可少的环节[1]。一般情况下新发出来的嫩芽因为接触外界环境的时间较短,所以受到菌群感染的几率也会更低;根据多年的组培经验,HgCl2溶液进行消毒处理效果相对其他方式会更加有效,但因为是重金属溶液,所以浓度要进行严格控制。该试验所用试剂药品废弃液都按照实验室废弃物处理要求进行了处理。
外植体带菌程度直接关系到组培质量的优劣,如何才能高效得到无菌材料是木本植物进行组织培养的难点所在[10]。所以,在进行植物组织培养时,所选择的外植体材料在进行接种前都必须灭菌,尽可能不带菌,这也是确定接种成功率的关键。研究证明,在杜仲组培时选用植物幼嫩部位作为外植体材料,无菌环境下采用0.1% HgCl2消毒剂处理8 min 效果最佳,所得到的无菌苗量也最多。70%~75%酒精有双重效果,既能够浸润,又有较高的杀菌作用,却无法完全杀灭菌类,必须搭配其他杀菌剂使用。由于HgCl2中的Hg2+可以和带负电性的蛋白质交叉融合,因而使细菌中蛋白质产生变性,从而导致酶失活,因而具有良好的消毒效果。该试验表明,采用0.1% HgCl2消毒剂处理杜种外植体时的最佳时间是8 min。在用0.1%HgCl2消毒剂处理外植体时,杀菌时间不同,杀菌效果不同。同种消毒剂应用后,由于杀菌时间的延长,虽然污染量逐渐减少,但植物组织枯死率却在增加。天然状态下杜仲的顶芽、幼嫩茎段、中间茎段和基部茎段都能成为外植体,其中又以顶芽为最佳,幼嫩茎段次之。顶芽带菌率低,细胞活性高,容易再分化;而其他部分外植体则较老,细胞的再分化能力低。所以,在杜仲组织繁殖外植体筛选试验中,幼嫩部位为最佳的外植体。
