远隔效应在非小细胞肺癌免疫治疗时代的研究进展
2023-07-03丁心静卢致辉王芬彭素娟
丁心静,卢致辉,王芬,彭素娟
330006 南昌,南昌大学第一附属医院 肿瘤科
远隔效应(abscopal effect,AE)是指在某些肿瘤中,局部放射治疗后会导致远隔照射部位的肿瘤消退。1975 年最早报道于皮肤网状细胞肉瘤放射治疗时,发现远隔部位转移瘤的消退[1],此后在免疫原性较强的淋巴瘤[2]、黑色素瘤[3]、肾细胞癌[4]等多种恶性肿瘤中不断有文献报道AE现象。然而,对于免疫原性较弱的非小细胞肺癌(non-small cell lung cancer, NSCLC),文献报道的AE发生率明显更低,而且多数为个案报道,因此将其实际应用于NSCLC 临床治疗还存在一定困难[5-6]。近年来研究发现,放射治疗可以调节机体免疫微环境,启动静止的宿主免疫系统,使其更好地杀死肿瘤,从而增加免疫疗法的反应[7]。随着以程序性死亡受体(programmed cell death protein1,PD-1)及配体(programmed death ligand 1,PD-L1)抑制剂为代表的免疫检测点抑制剂(immune checkpoint inhibitors, ICIs)治疗在NSCLC 中的广泛应用,越来越多的研究显示放射治疗联合免疫治疗在AE 方面具有显著的协同作用[8-10]。本文就此作一综述。
1 AE 的发生机制
既往研究表明,临床上大多数辐射诱发的肿瘤发生于高免疫原性肿瘤,如肾细胞癌、黑色素瘤和淋巴瘤[2-4]。Lai 等[11]通过建立高免疫原性(MC-38 和E.G7-OVA)和低免疫原性(LL/2 和B16-F10)肿瘤模型,分别采用单次15 Gy 或单次5 Gy 连续3 天的放射治疗,观察AE 的发生情况。结果发现:在高免疫原性肿瘤模型中可诱导AE,而在低免疫原性肿瘤模型中并未诱导AE,强烈提示肿瘤免疫原性与AE的发生密切相关。
关于AE 的发生机制,目前认为与以下几种因素有关:① 促进内源性配体(DAMPs)的释放:在RT 作用下,多种DAMPs 如腺苷、ATP、DNA、线粒体DNA、透明质酸等的释放增加,促使DAMPs 与其受体相结合,启动细胞因子级联反应,从而增强机体的肿瘤免疫原性[12];② 激活干扰素基因的刺激因子(STING)信号通路:动物实验显示,8Gy X射线照射能激活GL261 小鼠胶质瘤模型中的STING 信号通路,促进免疫相关因子的表达,通过诱导原位及远隔部位肿瘤组织中树突状细胞、CD8+T淋巴细胞浸润增加,最终达到增强其抗肿瘤免疫的作用[13-14];③ 释放肿瘤相关抗原(tumour-associated antigens,TAAs):在放射治疗刺激下,肿瘤细胞被破坏后可释放多种TAAs,从而激活抗肿瘤T 淋巴细胞并通过循环系统分布到全身,从而诱导有效的抗肿瘤免疫[15];④ 诱导促炎介质的释放:放射治疗可促进免疫细胞中促炎基因的表达,释放促炎介质(如TNF-α、IFN 和IL),诱导炎症反应并形成促炎微环境,从而增强机体的肿瘤免疫原性[16]。
2 接受单纯放射治疗的NSCLC 的AE
Kareff 等[17]首次报告了NSCLC 治疗中出现的AE,1 名69 岁女性右肺下叶腺癌伴左肺转移的患者,在接受了右肺下叶放射治疗后3 月复查影像学,提示左肺肿瘤明显缩小。此后,Kuroda 等[18]报告了1 例76 岁女性肺腺癌伴纵隔、右肺门和肺内多发转移患者,对其中的纵隔与右肺门淋巴结转移病灶进行放射治疗,3 月后复查胸部CT 提示肺内多发转移病灶完全消失。Hamilton 等[19]亦报告了1 例47 岁男性NSCLC 脑转移患者,接受颅脑左侧额叶孤立性病灶放射治疗后7 个月,复查影像学发现左肺上叶近胸膜处和纵隔的肿块几乎完全消退。Vilinovszki等[20]报告了1 名 81 岁女性复发性肺鳞癌伴纵隔淋巴结、左颈部淋巴结及骨转移患者,拒绝接受全身治疗,仅对纵隔淋巴结进行姑息性立体定向放射治疗(stereotactic body radiation therapy,SBRT)。3 月后复查18FDG-PET/CT 检查,发现患者纵隔放射治疗部位、左颈部淋巴结和骨转移病灶均明显缓解,在放疗后 25 个月患者所有病灶仍处于缓解期。目前,关于放射治疗所致NSCLC 患者的AE,绝大多数为个案报道,提示单纯的放射治疗难以在NSCLC 患者中触发足够有效的抗肿瘤免疫反应以实现AE,需要探讨放射治疗与其他治疗方法的联合模式,以进一步提高AE 的发生[21]。
3 免疫治疗增强NSCLC 放射治疗中的AE
临床证据表明:相比于单纯放射治疗,应用免疫治疗可增强放射治疗所致AE 的发生和效果[22]。其中,最受关注的是阻断PD-1/PD-L1 通路与细胞毒性T 淋巴细胞相关蛋白4(cytotoxic T-lymphocyte-associated protein 4,CTLA-4)等通路。因此,放射治疗与免疫治疗相结合逐渐成为近年的研究“热点”。
3.1 临床前研究
目前有多项临床前研究正在尝试建立新的动物模型,以探讨放射治疗与抗CTLA-4、抗PD-1 抑制剂的联合应用,以增强对放射治疗诱导下免疫相关的AE 的了解,并期望找到将放射治疗与免疫治疗如ICIs 优化整合的方法。
Hu 等[23]通过对小鼠接种334SQR 和334SQP 转移性肺癌细胞,建立了抗PD-1 耐药(334SQR)和抗PD-1 敏感(334SQP)肿瘤模型,先后给予局部放射治疗、氧化铪纳米颗粒(NBTXR3)、抗PD-1 单抗治疗,以观察克服抗PD-1 耐药性对肿瘤模型的影响。结果发现,在334SQR 耐药模型中,放射治疗+抗PD-1单抗治疗组较放射治疗组体现了明显的AE,但是在334SQP 敏感模型中并未观察到此现象;增加NBXR3应用后,334SQR 和334SQP 肿瘤模型均较对照组观察到了显著的AE。这表明放射治疗与NBTXR3 和抗 PD-1 单抗治疗相结合,可克服抗 PD-1 耐药性,并在抗 PD-1 耐药性肺癌小鼠中实现AE。此外,Chen 等[24]还建立了抗PD-1 耐药(334SQR)NSCLC腺癌小鼠模型,并对其行口服SHP099(酪氨酸磷酸酶SHP-2 抑制剂)、放射治疗和腹腔内抗PD-1 治疗,随后观察到原发肿瘤的控制和AE 的发生。这表明SHP-2 抑制剂与抗PD-1 治疗的联合应用可增强免疫介导的放疗反应,也为这种三联疗法在肺癌患者中的应用提供了依据。
同样,也有许多研究尝试使用不同剂量、不同类型的放射治疗结合免疫治疗以评估AE。临床研究证实:超分割放疗(hypofractionated radiotherapy,HFRT)具有较强的免疫原性[25-26]、低剂量放疗(lowdose radiotherapy,LDRT)有助于T 细胞聚集[27-28]。Yin 等[29]对于双侧NSCLC 肿瘤小鼠模型通过皮下注射癌细胞建立第3 个肿瘤,而该肿瘤不接受放射治疗治疗。将14 只小鼠随机分为两组,分别对小鼠的两个原发肿瘤实施HFRT+PD-1 单抗双重治疗、HFRT+LDRT+PD-1 单抗三联治疗。结果发现,接受双重治疗(2/7)和三联疗法(3/7)治疗的小鼠均出现了第3 个肿瘤的生长延迟,提示对小鼠原发NSCLC肿瘤给予放射治疗联合PD-1 单抗治疗可显著增强小鼠的AE。
3.2 临床报道
Huang 等[30]首次报告了对间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)阳性NSCLC患者联合应用SBRT 和肺炎球菌多糖结合疫苗(pneumococcal polysaccharide conjugate vaccine,PCV)后出现AE 的案例。1 名60 岁男性NSCLC 患者伴右侧颈淋巴结和第3~5 腰椎转移,在对腰椎转移灶进行SBRT(30 Gy/5f)与局部注射PCV 后,腰椎周围转移灶明显好转且右肺原发病灶达到完全缓解,随后给予ALK 抑制剂(阿来替尼)维持治疗,无进展生存期(progression-free survival,PFS)达26 个月余。Hotta 等[31]报告了1 例在同一患者接受抗肿瘤治疗过程中先后观察到两次AE 的罕见病例。该患者系42 岁女性,确诊肺腺癌脑转移后给予全脑放疗后,观察到左上肺原发病灶明显缩小(即第1 次AE)。肺部病灶接受化疗后再次进展,且出现胸椎转移灶的进一步恶化。遂给予PD-L1 单抗(阿替利珠单抗)联合胸椎转移病灶放射治疗,再次观察到左上肺原发病灶的缩小(即第2 次AE)。但是,患者最终因脑转移灶恶化而死亡。Lin 等[32]报告了1 例肺腺癌在接受免疫治疗联合脑部放疗后引起颅外AE 的案例。该患者系71 岁男性,确诊肺腺癌后接受紫杉醇+奈达铂(TP)方案化疗6 周期后出现原发病灶的进展,后改行阿替利珠单抗免疫治疗,但是复查影像学发现新增右侧顶叶转移灶。患者遂接受脑部转移病灶的放射治疗(48Gy/8f)联合阿替利珠单抗免疫治疗,放疗完成后复查脑部MRI 和胸部CT 提示右侧顶叶转移病灶消失、肺内多发转移病灶明显缓解。Fiorica 等[33]报道了1 例晚期NSCLC 患者在二线纳武利尤单抗治疗效果不佳,随后对胸壁病变给予姑息性放疗,结果发现转移性肾上腺部位肿瘤达到了完全缓解,该结果表明免疫治疗联合放射治疗不仅可诱发AE,还可逆转药物耐药,表现为二者具有明显的协同效应。上述报道提示,放射治疗联合免疫疫苗或PD-L1 单抗治疗,可提高晚期NSCLC 肺内与肺外、颅内与颅外病灶之间的AE 发生。
3.3 临床研究
PEMBRO-RT 试验通过将帕博利珠单抗与SBRT联合治疗转移性NSCLC 患者,分析对肿瘤微环境 (tumor microenvironment,TME)的影响。结果发现:帕博利珠单抗组与帕博利珠/SBRT 联合组治疗6 周后,患者淋巴细胞总数分别增加1.87 倍(1.06~3.29)与2.29 倍(1.46~3.60)。帕博利珠/SBRT 联合组在治疗6 周后 CD103+细胞毒性T 细胞增加 4.87 倍(2.45~9.68),而帕博利珠单抗组仅增加 2.56 倍(1.03~6.36)。进一步发现帕博利珠/SBRT 联合组中出现AE 的患者,TME 中细胞毒性T细胞浸润显著强于帕博利珠单抗组[34]。Trommer等[35]对24 名接受抗PD-1 单抗(帕博利珠单抗/纳武利尤单抗)和局部放射治疗治疗的患者进行观察,发现有29%的患者出现AE。Chen 等[36]比较抗CTLA-4或抗PD-1 单抗联合SBRT 治疗转移性NSCLC 的疗效和预后,其中SBRT+CTLA-4 单抗组17 例、SBRT+PD-1 组16 例,通过分析发现:两组的AE 发生率相似(24%vs37%),但SBRT+PD-1 组的客观缓解率(objective response rate,ORR)与PFS 更有优势。上述结果提示:免疫治疗可通过重塑NSCLC 肿瘤免疫微环境,从而增强放射治疗诱导的AE。
Theelen 等[37]纳入转移性NSCLC 的两项随机对照试验,比较帕博利珠单抗联合放射治疗治疗组与帕博利珠单抗治疗组的疗效差异。共纳入148 名患者,结果发现联合治疗组的AE 发生率与远隔病灶控制率均显著高于帕博利珠单抗治疗组(41.7%vs19.7%,P= 0.0039;65.3%vs45.3%,P= 0.0071),联合治疗组的中位PFS (median progression-free survival,mPFS)与中位总生存期(median overall survival,mOS)均明显优于帕博利珠单抗治疗组(9.0 个月vs4.4 个月,P=0.045;19.2 个月vs8.7 个月,P=0.0004)。Wang 等[38]回顾性分析2018~2020 年152 例接受PD-1 单抗治疗和(或)放射治疗的寡转移性(< 3 个转移灶)NSCLC 患者,其中PD-1 单抗组93 例、放射治疗+PD-1 单抗组59 例。分析发现:放射治疗+PD-1 单抗组的ORR 显著高于PD-1 单抗组(50.8%vs31.2%,P=0.015);在放射治疗+PD-1 单抗组的照射野之外的可评估患者(n=46)中,照射野之外的ORR 为41.3%,较PD-1 单抗组的31.2%有增高趋势(P=0.238);联合治疗组的mPFS 显著优于PD-1 单抗组(13.8 个月vs8.9 个月,P=0.035)。一项荟萃分析比较ICIs 联合放射治疗组与ICIs 或放射治疗单一治疗晚期或转移性 NSCLC 患者,结果发现:对比放射治疗单一治疗组,ICIs 联合放射治疗组显示了更高的AE 发生率,而且展现了更优的1 年PFS 率[RR=0.73(95%CI:0.61~0.87;P=0.0005)] 与3 年PFS 率[RR=0.82(95%CI:0.67~0.99;P=0.04)]。同样,ICIs 联合放射治疗组较放射治疗单一治疗组具有更高的1 年与3年OS 率[RR=0.75 (95%CI: 0.64 ~ 0.88;P=0.0003);
RR=0.85 (95%CI: 0.78 ~ 0.93;P=0.0006)][5]。Yin等[29]对9 例接受SBRT+LDRT+PD-1 单抗三联疗法的IV 期NSCLC 病例进行回顾性分析,发现3 例达部分缓解,2 例获稳定疗效,6 例出现AE,提示三联疗法显示了良好的疗效;并据此启动了一项前瞻性临床试验(NCT03812549),以进一步探讨这种三联疗法的安全性和疗效。
近年来,有学者开始探讨临床上放射治疗与免疫治疗的联合模式问题。Bassanelli 等[39]对95 例接受放射治疗和纳武利尤单抗治疗的晚期NSCLC病例进行回顾性分析,总体AE 发生率为27.3%,进一步分析发现:先纳武利尤治疗后60 天再行放射治疗,较先RT 后60 天行纳武利尤治疗具有更高的mOS(22.4 个月vs8.6 个月,P=0.005),提示先放射治疗再免疫治疗可诱导NSCLC 出现更高的AE 发生率。Wang 等[40]回顾性分析了152 例寡转移性(< 4 个转移部位)NSCLC 病例。其中,93 例接受PD-1 单抗治疗,59 例接受PD-1 单抗联合放射治疗。联合组的ORR 与mPFS 显著优于PD-1 单抗组(50.8%vs31.2%,P=0.015; 8.9 个月vs13.8个月,P=0.035)。值得关注的是,联合组的AE 发生率达41.3%(95%CI:26.5%~56.1%),提示局部放射治疗联合PD-1 单抗通过提高AE,从而显著增加了寡转移性 NSCLC 患者的全身反应并改善了远期生存。上述研究表明:联合放射治疗与免疫治疗可显著提高晚期NSCLC 的AE 发生率,并进一步转化为生存期的延长。然而,对于接受免疫治疗的晚期NSCLC 患者,放射治疗的最佳剂量、类型、靶区、时机尚未达成共识。未来仍需要更多的临床试验,探讨在NSCLC 患者中发挥免疫联合放射治疗对AE诱发的增强效应。
3.4 正在进行的临床试验
针对NSCLC 患者的放疗分割模式、剂量、次数、时间及免疫治疗靶点、先后顺序仍在探索中,需要更多的基础研究和临床试验以确定最佳联合模式。一项干预性研究(NCT04786093)II 期临床试验正在评估SBRT 和抗PD-1 单克隆抗体——度伐利尤单抗的联合应用对晚期NSCLC 患者生活质量和抗肿瘤效果的影响,其次要终点包括AE 的发生率。此外,目前尚有多个临床试验(NCT05520853、NCT04238169 等)正在观察SBRT、抗PD-1 治疗和其他治疗(胸部热疗、贝伐珠单抗等)结合的三联疗法在既往一线化疗失败后进展的IV 期NSCLC 患者中的疗效,在此过程中也评估了非照射病灶的客观缓解率,以期最大限度地开发AE 的潜力、为治疗方式的选择提供参考(表1)。目前上述研究仍在进行中,虽尚未得出结果,但仍值得期待。
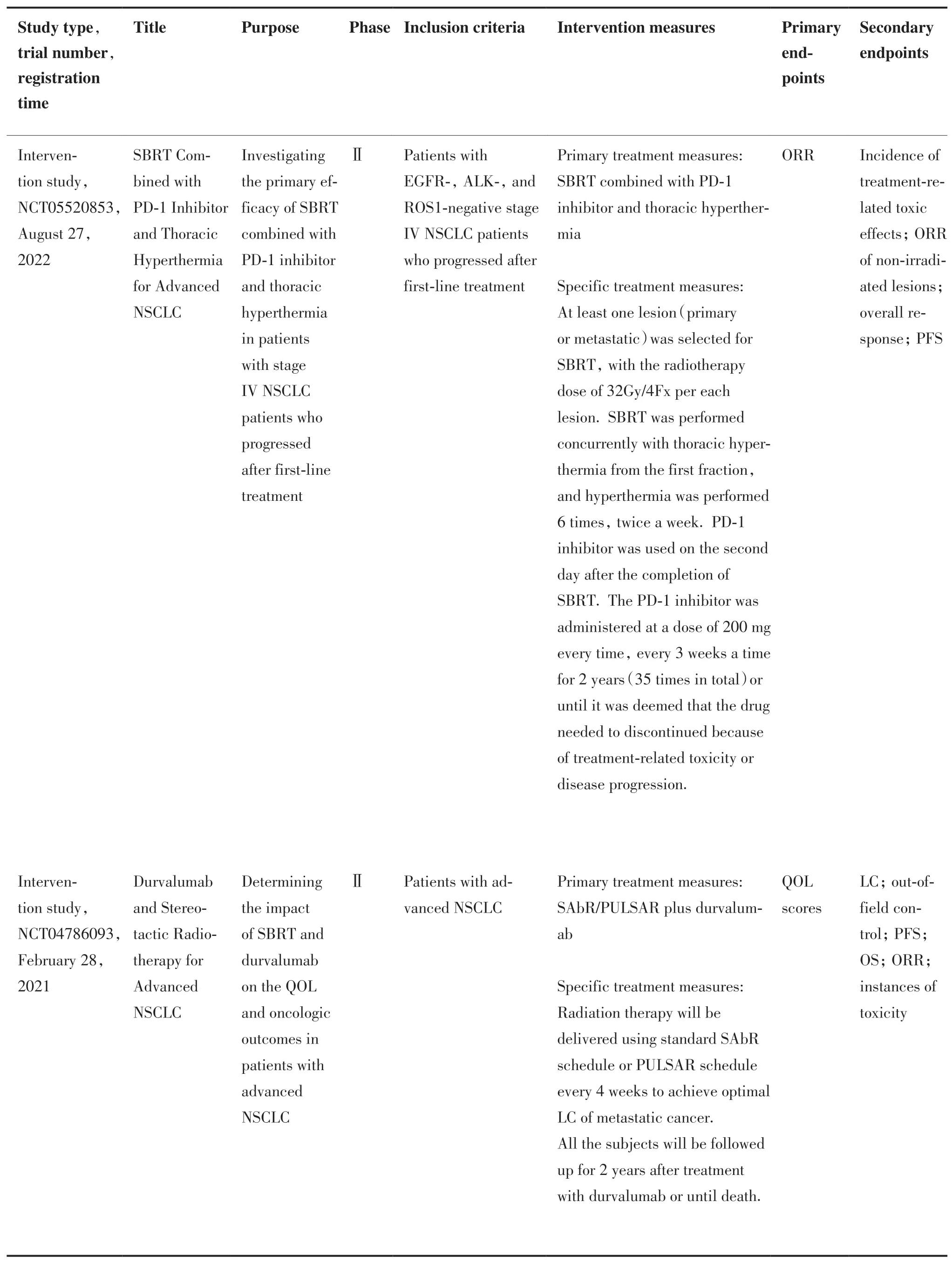
表1 正在进行的放射治疗联合免疫治疗在转移性NSCLC 患者中的临床研究Table 1. Ongoing Clinical Trials on Radiotherapy plus Immunotherapy for Metastatic NSCLC Patients
4 小 结
关于AE 的确切机制,至今尚未完全阐明。基础研究表明,放射治疗可通过增强机体的肿瘤免疫原性以激活全身性免疫反应,从而诱发AE 的发生。目前,关于单纯放射治疗引起NSCLC AE 仅见于部分个案报道,在免疫原性较差的NSCLC 中,难以在临床上通过AE 达到增加疗效、改善预后的目的。近年来多数研究表明,免疫治疗的应用可以增加放射治疗引起的AE 的发生率,并转化为生存期的延长。然而,关于放射治疗与免疫治疗的最佳组合模式,尚未达成共识。目前,正在进行的免疫治疗联合放射治疗和(或)贝伐珠单抗等临床试验,旨在探讨NSCLC 患者如何从放射治疗与免疫治疗的联合中获益更大,还需要进一步完善临床前及临床的数据。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
