生草栽培对赣南脐橙土壤团聚体及根系生长的影响
2023-06-30管冠郭富鹏郭等等张思
管冠 郭富鹏 郭等等 张思

摘要:为明确赣南脐橙土壤团聚体及其有机碳含量对生草栽培的响应机制,为赣南脐橙产业的可持续发展提供有力的科学依据。以赣南脐橙土壤为研究对象,设计盆栽试验围绕土壤团聚体、土壤有机碳及根系等方面开展研究,按生草方式,共设置清耕(CK)、无分隔(T1)、尼龙袋分隔(T2)、塑料盆分隔(T3)4个处理,对土壤团聚体分布、有机碳含量以及根系进行测定分析。结果表明:生草栽培下脐橙土壤大团聚体含量最高、微团聚体含量次之,生草栽培有利于提高团聚体稳定性,且T1处理表现最佳。与CK处理相比,T1、T2、T3处理各粒径团聚体有机碳含量大都较高,分别增加30.58%~42.59%、11.82%~26.35%、2.34%~15.07%。且与T3处理相比,T1、T2处理各粒径团聚体有机碳含量较高,而T1处理土壤团聚体有机碳含量又显著高于T2处理,表明根系接触对于团聚体有机碳含量的影响要大于根系分泌物对于团聚体有机碳含量的影响。随着试验时间的增加,各处理根系活力和根系形态参数均呈上升趋势,且根系接触与根系分泌物共同影响下的T1处理的根系活力及根系形态较好。综上所述,生草栽培处理有利于提高土壤团聚体稳定性及有机碳含量,改善土壤质量;有利于脐橙根系的生长。
关键词:生草栽培;脐橙;土壤团聚体;有机碳;根系
中图分类号:S666.406文献标志码:A
文章编号:1002-1302(2023)05-0216-11
土壤团聚体是土壤的重要组成部分,既影响土壤的持水性和通透性[1],又影响土壤的水分和养分供应,并具有水稳性和多孔性等特征,可以使土壤结构处于稳定状态,所以团聚体的数量及质量不仅可作为土壤肥力的标志之一,也可以反映土壤结构的稳定状况[2-4]。土壤有机碳(SOC)是土壤生态系统中土壤肥力的物质基础和重要指标[5],作为土壤团聚体的主要胶结物质,与团聚体含量及其稳定性有着密切关系[6-7],且土壤碳主要来自于土壤中的大团聚体[8]。研究表明,土壤有机质含量的增加会促进土壤团聚体稳定性的增加,而土壤稳定性的增加又能增加土壤有机碳的含量,增强有机碳的保护和碳汇作用,二者相互依存[9-10]。
根部是植株生命活动过程中的重要器官,它承载着土壤养分及土壤水分的吸收和运输,影响着地上部碳水化合物的合成和转化[11-12],且是植物最先感受到土壤质量状况变化的部位[13],而根系活力也是判定植物根系健康与否的关键指标之一。马国辉的早熟梨生草及菌根效应研究试验表明,生草后根系形态参数显著增加,早熟梨苗的根系活力也显著提高[14]。果园生草可以调控地表温度变化,使土壤温度维持在比较平衡的状态,从而促进果树根系生长发育,李会科等试验显示,在苹果园间作白三叶后,苹果的细根生物量、根长和根表面积分布比例均不同程度的得到增加,从而使苹果根系向土壤较深层中生长,进而促进苹果树根系的生长发育[15]。
果园生草栽培作为一种在果树行间或全园种植多年生草本植物为覆盖物的果园土壤管理方法和制度[16],当前已有许多学者对果园生草覆盖的管理方式进行了大量的研究。结果均表明,生草覆盖能够改善土壤微生态环境,一定程度上可以增加土壤团聚体含量及有机碳含量,在保持果园土壤肥力,修复果园土壤生态方面具有明显作用[17]。陈曦等研究表明,生草覆盖下,枣园土壤有机碳及团聚体碳含量与清耕相比均显著提升,且土壤大團聚体中颗粒有机碳(POC)、矿物结合有机碳(MOC)含量亦显著增加[18]。付学琴等在南丰蜜桔园的研究中发现,种植牧草后,蜜桔园表层土壤>0.25 mm机械稳定性、水稳性团聚体含量显著增加[19]。黄圣杰等研究指出,覆盖处理可以改善土壤团聚体稳定性和水稳性团聚体有机碳、全氮含量,改善土壤质量[20]。王英俊研究结果亦说明生草处理有利于水稳性团聚体的形成,有助于土壤结构稳定性的提升[21]。随着果园生草栽培技术的广泛应用,其对果园土壤,特别是土壤团聚体及有机碳的影响,左右着果园生草栽培技术的实际应用效果。本研究以传统清耕为对照,研究自然生草覆盖、尼龙袋分隔生草覆盖、塑料盆分隔生草覆盖下土壤团聚体分布、土壤有机碳含量及根系的变化特征,以期为改良果园土壤质量以及果园生草栽培技术提供有力的科学依据。
1 材料与方法
1.1 试验材料
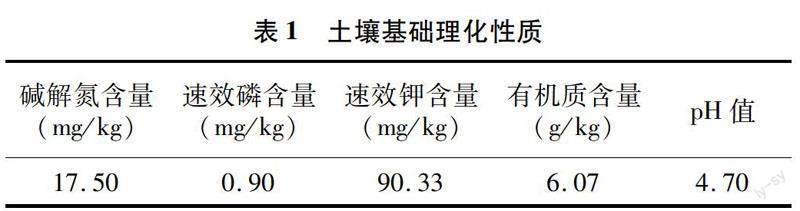
选取长势一致的无病毒纽荷尔脐橙一年生幼苗(赣州市俊萍果业苗木生产繁育基地)设计盆栽试验。盆栽土壤取自赣州本地红壤,并与有机肥按体积比3 ∶1充分混合,每盆含有机肥质量约 3 kg。混合前土壤基础理化性质见表1。草种选择禾本科百喜草(Paspalum notatum Flugge),试验地点在赣州市赣南师范大学温室(114.8°E,25.8°N)。
1.2 盆栽试验设计
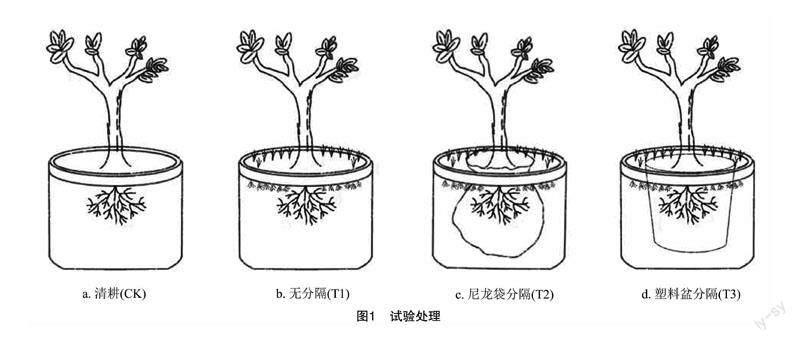
为明确生草栽培下,是草根本身或其根系分泌物两者之一还是两者共同对脐橙根系及其土壤产生影响。盆栽试验采用完全随机区组试验设计,由于所有取样均为破坏性取样,共设置4个处理,每处理共设置24个重复。设计12株/小区,每小区包含4种处理,每处理包含3个重复。
清耕(CK):将一年生的纽荷尔脐橙幼苗种植于直径为50 cm,高为45 cm的营养钵内,装土量为20 kg。
无分隔(T1):将一年生的纽荷尔脐橙幼苗种植于直径为50 cm,高为45 cm的营养钵内,装土量为20 kg;在距离树干 15 cm 外种植百喜草,播种量为10 g。此种植方式下,草根及脐橙根系可任意生长,两者根系本身及根系分泌物可产生相互影响。
尼龙袋分隔(T2):将一年生的纽荷尔脐橙幼苗种植于直径为40 cm,高为35 cm的300目尼龙袋中(装土量为10 kg),然后将其整体栽种在直径为 50 cm,高为45 cm的营养钵内(总装土量亦为 20 kg)。在尼龙袋和营养钵之间种植百喜草,种草量为10 g。此分隔方式下,阻断了脐橙根系和草根本体的自由交叉生长,但两者的根系分泌物可自由通过,水肥也可自由通过,故此分隔方式下,百喜草根系本体对脐橙根系没有影响,但草根根系分泌物对脐橙根系可产生影响。
塑料盆分隔(T3):将一年生的纽荷尔脐橙幼苗种植于直径为40 cm,高为35 cm的塑料花盆中(装土量为10 kg),然后将其整体栽种在直径为50 cm,高为45 cm的营养钵内(总装土量为20 kg)。在塑料盆和营养钵之间种植百喜草,且种草量亦是10 g。此分隔方式下,脐橙根系和百喜草根系被完全隔开,两者根系本身及根系分泌物均不可产生相互影响。
1.3 取样方法
生草试验于2021年1月布置完毕后,每隔2个月取样1次,从2021年3月持续取样到2022年1月。待测土壤样品取自0~15 cm土层,土壤取样质量为200 g/样次,土壤样品总共分为2份:其中1份先用不锈钢铲块状挖取,运回实验室后,分成粒径约1~2 cm大小的土块,剔除杂质后,自然晾干,用于土壤团聚体的分级;第2份土样剔除杂物并自然风干后,研磨,并分别过100目及20目的筛子,装入自封袋后,放入4 ℃冰箱保存,用于土壤团聚体和土壤有机碳含量的测定。将脐橙根系从营养盆里小心取出,清水洗净,装入自封袋后带回实验室,用于根系活力及根系形态参数的测定。
1.4 试验方法
1.4.1 土壤团聚体分级
土壤团聚体分级方法参照张耀方等湿筛法[22]:采用土壤团粒结构分析仪进行土壤粒径的分级。将筛子按从小到大的顺序,依次放入架子里,分别为2.000、0.250、0.053 mm。称取待分级土样50 g置于筛上,蒸馏水浸泡10 min,振荡 5 min,静置片刻后,将留在筛子上的土粒用蒸馏水冲洗进铝盒里,60 ℃烘箱中烘干,称重。把得到的>2.000、0.250~2.000、0.053~0.250、<0.053 mm 粒径的团聚体分别称为宏团聚体、大团聚体、微团聚体和粉粒组分。
1.4.2 土壤团聚体不同粒径有机碳含量测定
待土壤团聚体的分级完成后,将收集到的各个粒径土壤团聚体进行干燥处理,称重,并依次记录下来。然后混匀同一粒级的土壤团聚体,四分法分出1份,研磨后过100目筛,用于土壤有机碳含量的测定。
1.4.3 根系活力测定
植株根系活力采用氯化三苯基四氮唑(TTC)法测定,称取0.5 g根系样品,剪成2 cm左右大小并放于10 mL三角瓶中,加入 10 mL 0.4%TTC溶液和pH值 7.0磷酸缓冲液的等量混合液,把根系样品充分浸没在混合液中,放于37 ℃培养箱中暗处理1~3 h,取出后,加入2 mL的1 mol/L H2SO4以停止反应(与此同时作一对照试验,先加2 mL浓度为 1 mol/L 的H2SO4,10 min后再加入其他试剂,操作同上),把根取出并吸干水分,然后与乙酸乙酯及少量石英砂一起在研钵内磨碎,以提出甲臜并将红色的三苯甲臜溶液缓缓移入10 mL容量瓶中,再用少量乙酸乙酯将研钵洗涤干净,并移入容量瓶中,最后用乙酸乙酯定容。以空白试验作参比,在分光光度计485 nm波长下测出吸光度,根据标准曲线,即可求出其根系还原强度。
TTC还原量(g)=待测根系TTC浓度×待测溶液的体积;
TTC还原强度[μg/(g·h)]=TTC还原量/(根质量×时间)。
1.4.4 根系形态参数测定 根系形态参数采用Epson数字扫描(Expression 12000XL1.0,爱普生,日本)并使用WinRHIZO图像分析软件分析。将纽荷尔脐橙根系从营养钵中小心取出,蒸馏水清洗干净后,轻轻地放置在测根盘上,并将根系尽量铺展开来,然后打开根系扫描仪,扫描获取根系构型扫描图片,用植物图像分析仪测定根系长度、根表面积、根平均直径、根体积、根尖数等参数。
1.5 数据处理与分析
试验所得数据用Excel 2019进行处理和绘图,采用SPSS 21进行差异显著性检验(最小显著差异法)和相关性分析(皮尔逊相关系数法)。
2 结果与分析
2.1 生草栽培对土壤团聚体粒径的影响
由表2可知,除7月CK处理宏团聚体含量最高外,其他均表现为大团聚体含量最高,宏团聚体含量呈“N”形,表现出先上升后下降,最后又上升的趋势,0.250~2.000 mm粒径大体上呈先降低后升高又降低的趋势,0.053~0.250 mm、<0.053 mm粒径整体呈先升高后降低又升高的趋势。
生草2个月后(2021年3月),宏团聚体含量CK处理最低,且T1、T2、T3处理没有显著差异;大团聚体含量也是CK处理最低,且T1、T3处理显著高于CK;微团聚体含量CK处理最高;CK、T2处理的粉粒组分含量高于T3、T1处理。
生草4个月后(2021年5月),宏团聚体含量T2处理最高,较CK、T1、T3处理分别增加了13.72%、63.00%、37.81%;大团聚体含量T3最低,且CK、T1、T2、处理没有显著性差异;微团聚体含量CK处理最低;T2处理粉粒组分团聚体含量较CK、T1、T3处理较低,且CK、T1、T3处理没有显著性差异。
生草6个月后(2021年7月),与CK处理相比,T1、T2、T3处理宏团聚体含量较低,且T1、T2、T3处理没有显著性差异;大团聚体含量T2处理最高,较CK、T1、T3处理分别增加43.94%、24.06%、10.51%;微团聚体含量T1处理最高,与CK、T2、T3处理差异显著,分别增加52.33%、28.04%、49.77%;粉粒组分团聚体含量T3处理最高,与CK处理差异显著。
生草8个月后(2021年9月),大團聚体含量CK处理最高,微团聚体含量T3处理最高,较CK增加42.46%,T2处理粉粒组分含量较T3、T1、CK处理显著提升。
生草10个月后(2021年11月),T3处理宏团聚体含量较CK、T1、T2、处理分别增加155.23%、43.76%、44.01%,T1处理大团聚体含量较CK、T2、T3处理分别增加35.35%、59.19%、15.03%,CK处理下粉粒组分含量较T2、T3、T1高。
生草12个月后(2022年1月),T1处理大团聚体含量较T3、CK、T2处理分别增加6.77%、32.03%、33.98%,T2处理微团聚体含量较T1、T3处理分别增加16.11%、16.92%,T2处理粉粒组分含量较CK、T1、T3处理分别增加16.89%、69.65%、89.36%。综上可知,生草处理下大团聚体含量最高,微团聚体含量次之,宏团聚体和粉粒组分含量不相上下。
2.2 土壤团聚体各粒径有机碳含量
由图2-A可知,生草2个月后,>2.000 mm粒径团聚体有机碳含量最高,0.250~2.000 mm粒径次之,0.053~0.250 mm粒径最低。T1处理 >2.000 mm 粒径较T3处理团聚体有机碳含量增加20.99%,CK处理大团聚体有机碳含量最高,T3处理0.053~0.250 mm粒径团聚体有机碳含量较CK、T2、T1处理分别增加了62.38%、136.95%、139.56%。
由图2-B可知,生草4个月后,>2.000 mm、0.250~2.000 mm粒径团聚体有机碳含量较高,0.053~0.250 mm粒径团聚体有机碳含量最低,其中T1、T2处理的0.250~2.000 mm、0.053~0.250 mm、<0.053 mm 粒径团聚体有机碳含量均上升,>2.000 mm 粒径团聚体有机碳含量则下降,CK、T3处理则表现出相反的趋势。T3处理宏团聚体有机碳含量最高,较T2、T1处理分别增加16.84%、23.98%,大团聚体有机碳含量整体表现出T1>T2>CK>T3的趋势;<0.053 mm粒径团聚体有机碳含量亦表现出同样的趋势。
由图2-C可知,生草6个月后,T3处理在0.250~2.000 mm粒径团聚体有机碳含量稍上升,在>2.000 mm、0.250~2.000 mm粒径团聚体有机碳含量稍下降,除T2处理0.053~0.250 mm粒径、T1处理<0.053 mm粒径团聚体有机碳含量稍下降外,其他各处理有机碳含量均上升,但各粒径团聚体有机碳含量总体趋势没有改变。CK处理宏团聚体有机碳含量较T1、T3、T2处理高,T1处理大团聚体有机碳含量较CK、T2、T3处理分别增加了25.24%、44.07%、2.97%,CK处理微团聚体有机碳含量较T3、T1、T2处理高,T2处理<0.053 mm粒径团聚体有机碳含量较T3、CK、T1处理分别增加24.44%、38.16%、62.65%。
由图2-D可知,生草8个月后,大团聚体有机碳含量大体上高于其他3个粒径。T3处理宏团聚体有机碳含量最高,较T1、CK处理分别增加8.65%、11.36%,T3处理大团聚体有机碳含量较CK、T1、T2处理显著提高,且这3个处理之间没有显著差异,T1、T2、T3处理微团聚体有机碳含量较CK处理低,T2处理<0.053 mm 粒径团聚体有机碳含量较T1、CK、T3处理分别增加22.96%、27.83%、37.99%。
由图2-E可知,生草10个月后比生草8个月后,除<0.053 mm粒径团聚体有机碳含量稍有下降外,其他各粒径团聚体碳含量均升高,且T2处理各粒径团聚体有机碳含量最高。T2处理宏团聚体有机碳含量较T3、CK、T1处理分别增加8.75%、19.89%、23.11%,T2处理大团聚体有机碳含量较T3、CK、T1处理分别增加25.92%、28.69%、48.91%,T2处理微团聚体有机碳含量较T3处理增加8.14%,与CK、T1处理差异不显著,T2处理<0.053 mm 粒径团聚体有机碳含量较T3、T1、CK处理分别增加9.06%、17.95%、26.39%。
由图2-F可知,与生草10个月后相比,生草12个月后,除T1处理的0.250~2.000 mm、<0.053 mm 粒径团聚体有机碳含量上升外,各处理各粒径土壤团聚体有机碳含量均呈下降趋势,其中T1处理各粒径团聚体有机碳含量最高。T1处理宏团聚体有机碳含量较T3、CK、T2分别增加13.47%、30.57%、66.30%,T1处理大团聚体有机碳含量较T2、T3、CK处理分别增加18.05%、28.97%、31.99%,T1处理微团聚体有机碳含量较T3、CK、T2处理分别增加25.14%、27.22%、48.84%,T1处理<0.053 mm粒径团聚体有机碳含量较T2、T3、CK处理分别增加12.85%、26.45%、42.59%。
2.3 生草栽培对脐橙根系活力的影响
由图3可知,整体上看,随着试验时间的增加,各处理根系活力均提高。CK、T3处理呈先升高后降低,再升高又降低,随后又升高的趋势,T2、T1处理呈先降低后升高,再降低又升高的趋势,整体规律呈“W”字。其中试验8个月后,脐橙根系活力 T3>T2>T1>CK,且T3处理根系活力较T2、T1、CK处理分别增加28.93%、36.33%、46.09%,12个月后,各处理根系活力均提高,T1、T3处理根系活力高于CK、T2处理。
2.4 生草栽培对脐橙根系形态参数的影响
由表3可知,生草2个月后,T3处理根总长高于其他处理,与CK、T2处理差别不显著,较T1处理显著提升,增加了262.96%;CK处理根表面积较T1处理增加150.36%,与T3、T2处理差异不显著,与T1处理有显著差异;T3处理根平均直径最大;CK处理根体积最大,较T2、T1处理分别增加了30.92%、102.67%;T2处理根尖数最多,较T1处理增加了143.46%,与CK、T3处理差别不显著。生草4个月后,T3处理根总长显著大于CK、T2、T1处理,分别增加34.87%、122.14%、569.67%;T3处理根表面积最大,与CK、T2处理没有显著性差异,与T1處理差异显著,较T1处理增加284.74%;T3处理根平均直径显著高于CK、T2、T1处理,分别增加60.51%、68.00%、142.31%;T3处理根体积显著大于CK、T2、T1处理,分别增加76.35%、100.89%、249.56%;T3处理根尖数显著高于CK、T2、T1处理,分别增加130.15%、134.15%、453.51%。生草6个月后,表现出同样的趋势,T3处理的根总长、根表面积、根平均直径、根体积以及根尖数均显著高于其他3个处理。
生草8个月后,T1处理根总长、根表面积、根平均直径、根体积以及根尖数均高于其他3个处理。生草10个月后,与CK处理相比, T2、T1、T3处理根总长、根表面积、根平均直径、根体积以及根尖数均较低。生草12个月后,T1根总长最长,与CK没有显著差异,与T2、T3处理有显著性差异,T1处理根表面积较CK、T2、T3处理显著增加,分别增加了9.49%、59.47%、65.09%,根平均直径、根体积数均是CK处理最高,根尖数T1处理最高,较CK、T2、T3处理分别增加24.20%、69.81%、77.62%。
2.5 土壤团聚体各粒径百分比与有机碳含量的相关性分析
由图4可知,各粒径团聚体有机碳含量大都关系密切,且除<0.053 mm粒径团聚体有机碳含量与宏团聚体有机碳含量呈负相关外,其余粒径均呈正相关,其中大团聚体有机碳含量与微团聚体有机碳含量呈显著正相关、与宏团聚体碳含量呈极显著正相关,微团聚体与<0.053 mm粒径团聚体有机碳含量呈显著正相关,各粒径团聚体所占百分比大都呈负相关,其中粉粒组分所占百分比与宏团聚体、大团聚体所占百分比呈极显著负相关,宏团聚体所占百分比与各指标均呈负相关,各粒径团聚体有机碳含量与各粒径团聚体所占百分比也大都呈负相关。
2.6 生草栽培下脐橙根系活力及根系形态参数的相关性分析
由图5可知,生草栽培下,脐橙根系活力显著正相关于根总长、根表面积、根平均直径、根体积、根尖数。说明根系活力越高,根系形态参数越良好,根系生长状态也就越好。
2.7 生草栽培下脐橙根系与土壤团聚体及有机碳含量的相关性分析
由图6可知,宏团聚体所占百分比与根系形态和根系活力均呈负相关,大团聚体所占百分比与根系形态和根系活力均呈正相关,宏团聚体有机碳含量与根系形态及根系活力呈极显著负相关,微团聚体有机碳含量与根系形态和根系活力都呈正相关,且与根系形态呈极显著正相关,<0.053 mm粒径团聚体有机碳含量与根系形态和根系活力均呈极显著正相关。
3 讨论与结论
3.1 生草栽培对脐橙土壤各粒径团聚体含量的影响
土壤团聚体需要经过复杂且漫长的胶结、聚合等一系列物理、化学及生物作用才能形成[23]。大量研究证明,土壤有机质、微生物、植被覆盖以及土地管理方式等影响着土壤团聚体的稳定性,土壤团聚体的大小及数目又影响着土壤结构体的稳定性[24-25]。本研究表明,生草栽培下各处理大团聚体含量占比最大,微团聚体次之。有研究认为,各粒径水稳定性团聚体含量中,>0.250 mm粒径水稳性团聚体占比越高,土壤结构就会越稳固、土壤耐蚀性也会越好[25-26]。说明生草栽培下土壤结构的稳定性可以显著增强。屠娟丽等对桃园进行生草试验,结果表明,桃园土壤>0.25 mm粒径水稳性团聚体含量显著提高,土壤有机碳含量显著增加,土壤结构稳固性也相应显著提升[27]。本试验中,总体上T1处理表现较好,T3、T2处理次之,这可能是由于T1处理下,土壤覆盖物及植物凋落物增加,地表环境改善,对土壤颗粒进行更多的胶结作用,从而促进土壤团聚体的增加,同时,草根本体及其根系分泌物的增多,也会促使土壤中有机胶结物质增多,从而促进土壤团聚体结构的形成及稳定[19],再者,生草覆盖增强了土壤的水土保持能力,也有利于土壤团聚体的形成及稳定。
3.2 生草栽培对脐橙土壤各粒径团聚体有机碳含量的影响
大量试验结果表明,生草栽培下,果园土壤覆盖物增加,植物凋落物及根系腐殖质等逐渐累积矿化,有利于土壤有机碳含量的增加[28]。本研究表明,试验前期土壤宏团聚体有机碳含量最高,0.250~2.000 mm 次之,0.053~0.250 mm团聚体有机碳含量最低,但是随着生草试验的进行,0.250~2.000 mm 粒径团聚体有机碳含量逐渐大于 >2.000 mm 粒径有机碳含量,这与陈曦等枣园生草的试验结果一致,>0.250 mm粒径团聚体有机碳含量最高[18];生草12个月后,土壤团聚体有机碳含量大多呈下降趋势,可能是因为后期采样雨水比较多,土壤含水率增加,土壤团聚体结构遭到少许破坏的原因。付学琴等对南丰蜜橘园进行生草栽培试验,研究结果表明,生草较大幅度地提高了橘园土壤各粒径水稳定性团聚体碳含量[19],这与本试验结果相似,生草一年后,T1、T2、T3处理各粒径团聚体有机碳含量较CK相比分别提高30.58%~42.59%、11.82%~26.35%、2.34%~15.07%。其中T1、T2处理表现較T3处理好,说明生草栽培确实有利于提高土壤团聚体有机碳含量。这主要是生草模式下,由于脐橙土壤覆盖度、植物凋落物的增加以及草根根系分泌物等给土壤输入了大量外源碳等物质,使土壤有机质含量增加、土壤环境得到改善,这有助于土壤团聚体组织的形成及稳固,进而促进土壤团聚体碳含量的增加[29],但T3处理草根根系及根系分泌物不能与脐橙根区土壤接触。此外,T1处理效果明显好于T2处理,两者都有根系分泌物的作用。不同的是,T1处理比T2处理多了根系接触这一层效应。而结合T3处理来看,根系接触和根系分泌物对于团聚体有机碳含量都有积极的促进作用,这说明在生草栽培下,根系接触对于团聚体有机碳含量的影响要大于根系分泌物对于团聚体碳含量的影响。这与前人研究结果基本一致,李萍等研究表明,通过尼龙网和塑料套盆对草类和平邑甜茶的根区土壤进行分隔,区分出了草根本体及草根分泌物的作用;对于苹果根系及根区土壤的多数指标,所试的5种草均表现出根系本体的作用大于根系分泌物的作用[30]。一般认为,>0.25 mm 粒径团聚体有机碳含量越高,土壤团聚体稳固性越好,本试验结果可以看出,>2.000 mm、0.250~2.000 mm 粒径团聚体有机碳含量较高,这也意味着生草栽培能提高土壤团聚体稳定性,进而促进团聚体有机碳含量的增加。但试验前期,各处理间团聚体有机碳含量没有较为明显的变化趋势,甚至清耕处理团聚体有机碳含量大于生草处理,这是由于生草初期,土壤环境以及有机质含量变化等不稳定造成的。
3.3 生草栽培对脐橙根系活力的影响
根系活力体现了根系新陈代谢能力的高低,可表征植物生长发育状况优劣,其活力高低直接影响植物对养分的吸收利用[31-32],孙文泰等研究表明,苹果园覆草后根系活力为清耕的111.3%~136.7%[33],说明生草处理下根系生长环境适宜,根系的新陈代谢及抗逆能力增加,李萍等在苹果园生草试验表明,毛苕子、白三叶、黑麦草、姬岩垂草、叉歧繁缕等5种草均可提升苹果树根系活力[30],这与本研究结果相似,随着生草时间的增加,各处理根系活力均提高,同时可看出试验后期,根系活力与前期差异较大,可能与后期雨水天气较多,土壤水分充足有关。且本试验结果显示,生草前期T1处理根系活力较CK处理低,但试验后期T1处理根系活力高于CK处理,且与CK相比,T2、T1处理表现都较好。说明生草栽培后,脐橙根系活力逐渐高于清耕处理,生草栽培有利于提高脐橙根系活力。但也有试验表明,生草栽培可降低植物根系活力,李发林等蜜柚园生草后,蜜柚根系活力显著降低,这可能与草种与降水有关,果园生草需要因地制宜[34]。值得注意的是,T3处理根系活力也高于CK,这可能与根域所在空间大小有关。
3.4 生草栽培对脐橙根系形态参数的影响
本试验结果显示,与CK相比,各生草处理下根总长、根表面积、根体积、根平均直径、根尖数大多显著提高,这与前人研究结果相似。王小龙等研究表明,葡萄园行间种植黑麦草后,葡萄根总长和根系表面积均不同程度提升[35];芝祥红等研究表明,与清耕相比,生草处理下文冠果根总长、根表面积、根体积、根平均直径、根尖数均显著增加[36]。说明生草栽培后,草根根系及其根系分泌物、植物凋落物等作用于脐橙根区土壤,使得土壤质量增加,土壤环境改善,脐橙根系生长得到促进[37]。试验后期,各生草处理中T1处理最为明显,说明在草根本体及草根根系分泌物共同作用下的效果要好于根系分泌物的单独作用,更能促进脐橙根系生长。严芳等在苹果园和茶园间作白三叶也有类似结果,茶树与果树根总长、根表面积、根体积、根平均直径、根尖数均显著高于清耕[38],但是纵观整个试验周期,可以发现,并非每次试验结果都是如此,这主要是因为试验周期及生长环境的问题。果园生草使草根与果树根系形成错综复杂的关系,可以起到改良土壤结构、提升土壤质量的效果,进而促进果树根系的生长,草根并不会与果树根系存在竞争关系,他们是以一个互助互利的关系存在的。实际生产中应因地制宜,选择合适的草种,进行适宜的管理。
4 结论
在本试验条件下,无分隔、尼龙袋分隔处理的土壤大团聚体含量、宏团聚体含量较高,表明生草栽培有利于提高土壤团聚体稳定性。而无分隔处理土壤团聚体有机碳含量显著高于尼龙袋分隔处理,表明根系接触对于团聚体有机碳含量的影响要大于根系分泌物对于团聚体有机碳含量的影响。随着试验时间的增加,各处理根系活力均呈上升趋势,且根系接触与根系分泌物共同影响下的无分隔处理的根系活力及根系形态较好。
参考文献:
[1]张家春,刘盈盈,贺红早,等. 土壤团聚体与有机碳固定关系研究进展[J]. 福建农业学报,2016,31(3):319-325.
[2]张天宇. 长期不同刈割制度下典型草原土壤团聚体稳定性和有机碳的分布特征[D]. 呼和浩特:内蒙古大学,2021.
[3]Wang J,Guo D. Effects of grassland patches on the composition and stability of soil aggregates in the Qinghai-Tibet plateau[J]. Earth and Environmental Science,2021,793(1):012013.
[4]Zheng H B,Liu W R,Zheng J Y,et al. Effect of long-term tillage on soil aggregates and aggregate-associated carbon in black soil of Northeast China[J]. PLoS One,2018,13(6):e0199523.
[5]张玉岱. 生草对渭北苹果园土壤有机碳的影响[D]. 杨凌:西北农林科技大学,2014.
[6]Topps D,Khabir M I U,Abdelmagid H,et al. Impact of cover crop monocultures and mixtures on organic carbon contents of soil aggregates[J]. Soil Systems,2021,5(3):43.
[7]王 峻,薛 永,潘劍君,等. 耕作和秸秆还田对土壤团聚体有机碳及其作物产量的影响[J]. 水土保持学报,2018,32(5):121-127.
[8]胡廷飞,王 辉,谭 帅. 再生水灌溉模式对土壤团聚体及其有机碳分布的影响[J]. 农业环境科学学报,2020,39(1):143-151.
[9]王义祥,翁伯琦,黄毅斌,等. 生草栽培对果园土壤团聚体及其有机碳分布的影响[J]. 热带亚热带植物学报,2012,20(4):349-355.
[10]Tushar C S,Guido I,Riccardo S,et al. Linking organic matter chemistry with soil aggregate stability:insight from 13C NMR spectroscopy[J]. Soil Biology and Biochemistry,2018,117:175-184.
[11]Zhao H Y,Sun S M,Zhang L H,et al. Carbohydrate metabolism and transport in apple roots under nitrogen deficiency[J]. Plant Physiology and Biochemistry,2020,155:455-463.
[12]宋香静,李胜男,郭 嘉,等. 不同盐分水平对柽柳扦插苗根系生长及生理特性的影响[J]. 生态学报,2018,38(2):606-614.
[13]严青青,张巨松,徐海江,等. 盐碱胁迫对海岛棉幼苗生物量分配和根系形态的影响[J]. 生态学报,2019,39(20):7632-7640.
[14]马国辉. 早熟梨生草及菌根效应研究[D]. 重庆:西南大学,2006.
[15]李会科,李金玲,王雷存,等. 种间互作对苹果/白三叶复合系统根系生长及分布的影响[J]. 草地学报,2011,19(6):960-968.
[16]樊文霞,孟炎奇,陳国栋,等. 生草覆盖栽培对果园土壤理化性质的影响研究进展[J]. 安徽农学通报,2022,28(6):116-120.
[17]赵伟亮. 生草对苹果园微域环境及果实品质的影响[D]. 阿拉尔:塔里木大学,2021.
[18]陈 曦,王改玲,刘焕焕,等. 生草覆盖对枣园土壤水稳性团聚体中两种有机碳组成的影响[J]. 应用与环境生物学报,2021,27(2):424-431.
[19]付学琴,杨星鹏,陈登云,等 南丰蜜橘果园生草栽培对土壤团聚体和有机碳特征及果实品质的影响[J]. 园艺学报,2020,47(10):1905-1916.
[20]黄圣杰,陈俊朴,陈 涛,等. 不同覆盖方式对樱桃园土壤团聚体及碳氮的影响[J]. 水土保持研究,2022,29(1):44-50.
[21]王英俊. 生草对渭北苹果园土壤团聚体及其有机C、N的影响[D]. 杨凌:西北农林科技大学,2013.
[22]闫涛宇. 果园生草覆盖土壤团聚体和团聚体碳的变化特征[D]. 北京:中国科学院大学,2015.
[23]闫涛宇. 果园生草覆盖土壤团聚体和团聚体碳的变化特征[D]. 杨凌:西北农林科技大学,2019.
[24]尹瑞玲. 微生物与土壤团聚体[J]. 土壤学进展,1985(4):24-29,23.
[25]Ren C,Liu K S,Dou P P,et al. The changes in soil microorganisms and soil chemical properties affect the heterogeneity and stability of soil aggregates before and after grassland conversion[J]. Agriculture,2022,12(2):307.
[26]Jin W P,Fan H M,Liu B,et al. Effects of freeze-thaw cycles on aggregate stability of black soil[J]. The Journal of Applied Ecology,2019,30(12):4195-4201.
[27]屠娟丽,费伟英,张彩平. 生草栽培对桃园土壤结构特征及酶活性的影响[J]. 中国南方果树,2016,45(2):134-137.
[28]郭 曼,郑粉莉,和文祥,等. 黄土丘陵区不同退耕年限植被多样性变化及其与土壤养分和酶活性的关系[J]. 土壤学报,2010,47(5):979-986.
[29]Merino-Martín L,Stokes A,Gweon H S,et al. Interacting effects of land use type,soil microbes and plant traits on aggregate stability[J]. Soil Biology and Biochemistry,2021,154:108072.
[30]李 萍. 不同草类及活体草根对苹果根系及根区土壤环境的影响[D]. 泰安:山东农业大学,2018.
[31]刘小刚,张富仓,杨启良,等. 玉米叶绿素、脯氛酸、根系活力对调亏灌溉和氮肥处理的响应[J]. 华北农学报,2009,24(4):106-111.
[32]葛君,孟自力,张志标,等. 肥料配施对小麦根系、根际土壤微生物及秸秆养分积累的影响[J]. 江苏农业科学,2022,50(11):214-219.
[33]孙文泰,马 明,董 铁,等. 陇东旱塬苹果根系分布规律及生理特性对地表覆盖的响应[J]. 应用生态学报,2016,27(10):3153-3163.
[34]李发林,林晓兰,黄炎和,等. 果园种植牧草对果树树体生长及其根系活力的影响[J]. 热带农业科学,2009,29(7):20-24.
[35]王小龙,刘凤之,史祥宾,等. 行内生草对葡萄根系生长和土壤营养状况的影响[J]. 华北农学报,2018,33(增刊1):230-237.
[36]芝祥红,李朝周,王 婷. 松土及自然生草促进文冠果生长发育的生理机制[J]. 东北林业大学学报,2021,49(9),33-39,89.
[37]管 冠,郭等等,李倩磊,等. 生草栽培对纽荷尔脐橙根系生长土壤微生物群落的影响[J]. 江苏农业科学,2021,49(17):220-225.
[38]严 芳,娄艳华,陈建兴,等. 间作白三叶草对茶园温湿度和茶树根系生长的影响[J]. 热带作物学报,2017,38(12):2243-2247.
收稿日期:2022-09-02
基金项目:国家自然科学基金(编号:32260728);江西省科技计划(编号:20192ACB80009);江西省青年科学基金(编号:20202BABL215029)。
作者简介:管 冠(1985—),男,湖北黄石人,博士,副教授,主要从事土壤生物学研究。E-mail:guanguan_1985@aliyun.com。
