急性马兜铃酸中毒小鼠肾损伤及Wnt7b/β-catenin/MMP-7的表达变化
2023-06-28王一凡刘爽汪思齐李茂娟黄春华楼迪栋
王一凡,刘爽,汪思齐,李茂娟,黄春华,楼迪栋
(1.贵州中医药大学基础医学院法医学教研室/贵州中医药大学司法鉴定所,贵阳 550000;2.贵州省法医中药毒理学特色重点实验室,贵阳550000)
马兜铃酸(aristolochic acids,AA)是马兜铃科中药材的主要毒性成分,能引起肾损伤和纤维化[1]。其中AAⅠ的毒性最大[2],摄入含有AA的中草药引起的急性或慢性肾小管间质疾病被称为AA肾病(aristolochic acid nephropathy,AAN)[3-5]。临床上对含有AA中草药的使用有严格的规范,但相关中毒事件仍有发生[6],如未及时治疗会发展为慢性肾功能衰竭,最终形成终末期肾病[7]。
Wnt通路在机体发育、损伤修复过程中发挥着重要作用[8]。研究表明,Wnt7b能够促进肾脏发育过程中肾小管的增殖分化[9],参与斑马鱼肾脏损伤后的再生修复[10],但Wnt7b在哺乳动物致肾脏损害发展过程中的作用机制仍缺乏基础研究。本研究通过连续观察急性AAN不同时期和部位的肾脏病理改变及Wnt7b相关蛋白的表达变化,探讨急性AAN过程中的组织病理特征和Wnt7b通路作用机制,为明确AA的毒理机制提供参考依据。
1 材料与方法
1.1 药物和试剂
AAⅠ标准品(纯度96%,四川省维克奇生物科技有限公司),溶于二甲基亚砜(北京索莱宝科技有限公司)与0.4%羧甲基纤维素钠(上海展云化工有限公司)中,制成2 mg/mL AAⅠ悬浊液。HE染色液(北京索莱宝科技有限公司),免疫组化(immunohistochemistry,IHC)SP试剂盒(北京中杉金桥生物技术有限公司),Wnt7b兔多克隆抗体(赛默飞世尔科技中国有限公司),β-catenin鼠多克隆抗体(武汉三鹰生物技术有限公司),基质金属蛋白酶-7(matrix metalloproteinase-7,MMP-7)兔多克隆抗体(武汉三鹰生物技术有限公司)。
1.2 实验动物
雄性KM小鼠(长沙市天勤生物技术公司)113只,8周龄,质量(32±5)g,于贵州中医药大学实验动物中心饲养,常温环境,自由摄食、饮水。实验过程严格按照《实验动物福利伦理审查指南(GB/T358922018)》要求执行。
1.3 动物分组及给药
将113只KM小鼠于笼中适应性喂养3 d,自由进食进水。
1.3.1 生存曲线给药方式:将75只小鼠随机分为5组(n=15),每组小鼠分别灌胃给药AAⅠ20 mg/(kg·d)、15 mg/(kg·d)、10 mg/(kg·d)、5 mg/(kg·d)及0 mg/(kg·d)(溶剂对照)。
1.3.2 急性AAⅠ中毒模型给药方式:将48只小鼠随机分为2组(n=24),溶剂对照组小鼠灌胃给药AAⅠ 0 mg/(kg·2 d),模型组小鼠灌胃给药AAⅠ 5 mg/(kg·2 d)。
1.4 样本采集
用药后,对照组和模型组的小鼠各随机取6只分别于第2、4、6和8 天戊巴比妥钠腹腔注射麻醉,颈椎脱臼处死,摘眼球取血后,用PBS和固定液全身灌注,取双侧肾组织样本,沿矢状面分为2份,PBS冲洗,一份浸入4%多聚甲醛固定,另一份用2.5%戊二醛固定。
1.5 肾功能检测
将采集的血液标本1 200 r/min 4 ℃离心10 min,取上清,用mindray生化免疫流水线检测其血肌酐和尿素氮含量。
1.6 组织病理学染色
将4%多聚甲醛固定的肾脏组织经乙醇梯度脱水、二甲苯透明、浸蜡、包埋后切片(切片厚度2~4 μm),进行HE染色与Masson染色,光学显微镜下观察肾脏组织病理变化,并对肾小管损害指标等计数统计。
1.7 IHC染色
切片样本放置于60 ℃烘箱中融蜡2 h,二甲苯脱蜡、乙醇梯度脱水。PBS冲洗后,置于100 ℃的柠檬酸缓冲液(pH6)中,微波炉高火加热20 min,PBS浸洗。随后滴加内源性过氧化物阻断酶室温孵育,PBS浸洗。分别加入Wnt7b(1∶200)、β-catenin(1∶200)和MMP-7(1∶100)3种蛋白的一抗,4 ℃冰箱孵育过夜,结束后用PBS浸洗。滴加生物素标记山羊抗小鼠/兔IgG,37 ℃孵育15 min,PBS浸洗,滴加辣根酶标记链霉素工作液,37 ℃孵育15 min,PBS浸洗。滴加DAB显色液,PBS浸洗终止染色,苏木素复染,酒精梯度脱水,二甲苯透明,封片。用ImageJ软件对IHC图像进行分析统计。
1.8 免疫电镜
将组织从2.5%戊二醛固定后取出,乙醇梯度脱水,树脂渗透后进行包埋。超薄切片机切成70~80 nm超薄切片,超纯水悬浮 5 min,进行复温后TBS清洗,用1%BSA 封闭液室温封闭 30 min,加入Wnt7b(1∶200)和 β-catenin(1∶200)4 ℃过夜孵育,TBS清洗,加入4 nm胶体金羊抗鼠抗体(抗β-catenin)和12 nm胶体金羊抗兔抗体(抗Wnt7b),37 ℃烘箱孵育1 h,TBS清洗。铀复染后用70%乙醇清洗,滤纸吸干后放入网板中,透射电子显微镜下观察并采集图像。
1.9 统计学分析
Masson染色和IHC的图像参考DESHPANDE 等[11]的方法,采用ImageJ软件对光密度平均值进行统计,用随机区域计数法对HE图像和IHC图像计数统计。采用SPSS 24.0软件进行统计分析,数据均以±s表示,多组间统计学差异(方差齐性检验后)采用单因素方差分析比较。P< 0.05为差异有统计学意义。
2 结果
2.1 AAⅠ与小鼠生存曲线
将小鼠暴露于不同浓度的AAⅠ中,AAⅠ的浓度与小鼠生存时间呈负相关。当小鼠灌胃的AAⅠ浓度为20 mg/(kg·d)时,小鼠表现出急性毒性效应,5~8 d出现高死亡率。当AAⅠ浓度降至10 mg/(kg·d)时,小鼠的死亡率稍降低,当AAⅠ的浓度降至5 mg/(kg·d)时,小鼠生存率显著上升;3组生存曲线与对照组相比有统计学差异(P均<0.05),见图1。

图2 HE和Masson染色代表性图像 × 20 Fig.2 Representative images stained by HE and Masson × 20
2.2 小鼠肾脏生化指标
血清肌酐和尿素氮检测结果显示,模型组血清肌酐在小鼠暴露于AAⅠ 6~8 d时出现显著上升,8 d时为对照组的25倍,尿素氮也随着小鼠暴露于AAⅠ的时间增加,8 d时出现统计学差异(P< 0.05)。见表1。
表1 小鼠血清肌酐和尿素氮(±s,n=3)Tab.1 Serum creatinine and urea nitrogen levels in mice(±s,n=3)

表1 小鼠血清肌酐和尿素氮(±s,n=3)Tab.1 Serum creatinine and urea nitrogen levels in mice(±s,n=3)
1)P < 0.05 vs control group.
2.3 小鼠肾脏组织病理学
HE染色结果显示,小鼠肾小管损伤程度随着AAⅠ暴露时间增加而加重,肾小球无明显改变;暴露于AAⅠ 2 d后,50%以上近端小管(proximal convoluted tubule,PCT)刷状缘破坏,伴部分上皮细胞水肿,空泡样变性;4 d时85%以上的PCTEC水肿,并出现少量坏死;6 d时坏死的PCT上皮细胞(proximal convoluted tubule epithelial cells,PCTEC)逐渐从基底膜脱落;8 d时PCTEC坏死脱落增加,肾小管出现大量基底膜裸露,管型数量增加(P< 0.05)。皮髓交界(corticomedullary-junction,CMJ)在暴露于AAⅠ 6~8 d时出现大量管型,远曲小管(distal convoluted tubule,DCT)和集合管(collecting tubule,CT)在8 d时出现少量水肿。Masson染色结果显示,AAⅠ暴露8 d后,肾皮质胶原容积分数(collagen volume fraction,CVF)较对照组显著上升,有统计学差异(P< 0.01)。见图 2、表2。
表2 肾小管损伤程度及Masson染色胶原容积分数(±s,n=3)Tab.2 Extent of renal tubular injury and collagen volume fraction determined by Masson staining(±s,n=3)
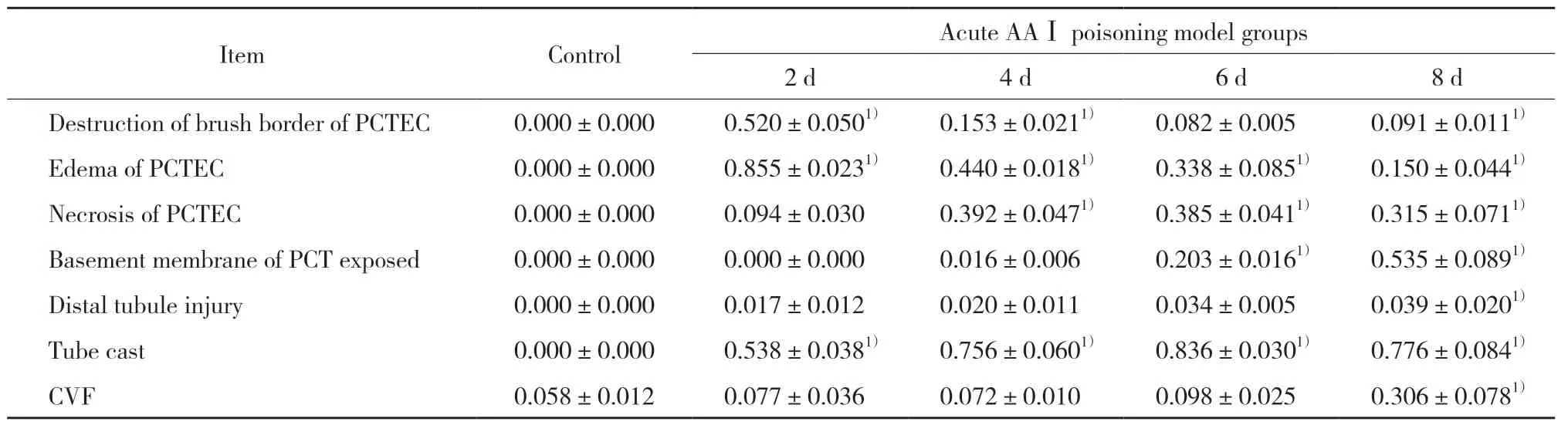
表2 肾小管损伤程度及Masson染色胶原容积分数(±s,n=3)Tab.2 Extent of renal tubular injury and collagen volume fraction determined by Masson staining(±s,n=3)
1)P < 0.01 vs control group.
2.4 小鼠肾脏Wnt7b、β-catenin和MMP-7 IHC结果
Wnt7b的IHC结果显示,模型组Wnt7b表达量上升,8 d时达到最高(主要聚集于刷状缘);暴露于AAⅠ8 d时,PCT、CMJ和CT处的Wnt7b的IHC平均光密度值增高,PCT的表达量增高至2 d时的2.5倍(P均<0.05);Wnt7b阳性的PCT比例增加,6~8 d时Wnt7b阳性小管数为70%(P均<0.05)。见图3、表3。
表3 Wnt7b免疫组化平均光密度值及阳性肾小管比例(±s,n=5)Tab.3 Proportions of positive PCT cells and mean optical density of tissues stained with Wnt7b(±s,n=5)
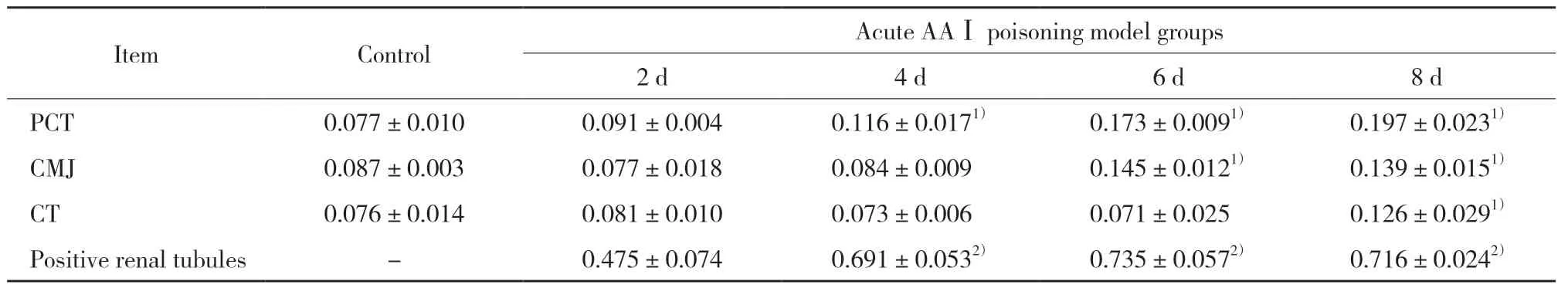
表3 Wnt7b免疫组化平均光密度值及阳性肾小管比例(±s,n=5)Tab.3 Proportions of positive PCT cells and mean optical density of tissues stained with Wnt7b(±s,n=5)
1)P < 0.01 vs control group;2)P < 0.01 vs 2 d.

图3 3种蛋白近端小管免疫组化染色代表性图像 × 20Fig.3 Representative images of immunohistochemical staining of three proteins in the proximal convoluted tubules × 20
β-catenin的IHC结果显示,模型组β-catenin表达量上升(PCT的近基底膜侧);第8天PCT、CMJ和CT处β-catenin的IHC平均光密度值和阳性小管与对照组相比明显增加,有统计学差异(P< 0.05)。见图3、表4。
表4 β-catenin免疫组化平均光密度值及阳性肾小管比例(±s,n=5)Tab.4 Proportions of positive PCT cells and mean optical density of tissues stained with β-catenin(±s,n=5)

表4 β-catenin免疫组化平均光密度值及阳性肾小管比例(±s,n=5)Tab.4 Proportions of positive PCT cells and mean optical density of tissues stained with β-catenin(±s,n=5)
1)P < 0.01 vs control group;2)P < 0.01 vs 2 d.
MMP7的IHC结果显示,模型组MMP7在胞质内表达量上升;PCT、CMJ和CT处MMP7的IHC平均光密度值和阳性肾小管与对照组相比明显增加,有统计学差异(P< 0.05)。见图3、表5。
表5 MMP-7免疫组化平均光密度值及阳性肾小管比例(±s,n=5)Tab.5 Proportions of positive PCT cells and mean optical density of tissues stained with MMP-7(±s,n=5)
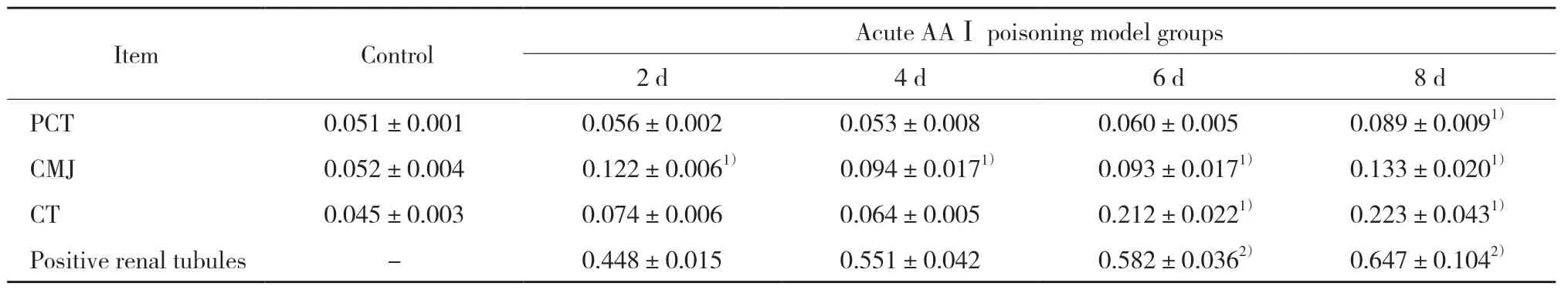
表5 MMP-7免疫组化平均光密度值及阳性肾小管比例(±s,n=5)Tab.5 Proportions of positive PCT cells and mean optical density of tissues stained with MMP-7(±s,n=5)
1)P < 0.01 vs control group;2)P < 0.01 vs 2 d.
2.5 小鼠肾脏Wnt7b和MMP7免疫电镜结果
免疫电镜结果显示,对照组的PCTEC刷状缘绒毛排列整齐,线粒体嵴清晰,数量较多;暴露于AAⅠ 2 d后PCTEC刷状缘排列紊乱,线粒体数量减少;6 d时PCTEC空泡变性,刷状缘绒毛大量脱落,线粒体数量明显减少,呈“C”或“U”形。对照组未见Wnt7b胶体金颗粒,β-catenin胶体金颗粒主要聚集在细胞膜下;暴露于AAⅠ后,刷状缘出现成簇聚集的Wnt7b胶体金颗粒,β-catenin胶体金颗粒在细胞膜下逐渐减少,核内聚集增加。见图4。

图4 Wnt7b和β-catenin免疫电镜代表性图像Fig.4 Representative immunoelectron microscopy images of Wnt7b and β-catenin proteins
3 讨论
AA致肾损伤事件在非洲、亚洲和欧洲均有发生[12],而且大量不明原因慢性肾脏病被疑与含有AA的中草药有关[13]。因此,明确急性AAN早期的病理变化,阐明AAN的致病机制,对AAN的诊断和治疗有重要价值。
急性AAN的病理改变表现为肾小管受损,主要累及PCT[4],本研究连续观察了AAN的肾小管病理学改变,结果显示,AAN以PCT损害为主,且PCTEC的损伤呈时间和AAⅠ浓度依赖性;暴露于AAⅠ后,PCTEC刷状缘绒毛脱落,线粒体形态异常,数量减少,细胞水肿、坏死、脱落。急性AAN的肾脏间质CVF增加,细胞外基质紊乱,胶原纤维增多,呈纤维化改变[14]。DCT和CT的病理改变时间较晚,以细胞水肿为主,AAⅠ主要通过分布于PCT的阴离子选择通道蛋白进入细胞[15]。
目前研究[9]已经证明Wnt4和Wnt11参与肾纤维化过程,但Wnt信号通路在急性AAN过程中的机制并不清楚。巨噬细胞所分泌的Wnt7b在组织损伤诱导的炎症过程中,参与肾小管损伤后的的修复与再生[16-19]。Wnt通路激活后β-catenin在胞质聚集并转移到核内,激活下游基因表达(如参与细胞增殖和迁移的MMP-7)[20-21]。本研究结果显示,AAⅠ可诱导Wnt7b在PCTEC的刷状缘表达,β-catenin从膜下向胞质和细胞核内聚集,核内的表达量增高,MMP-7暴露于AAⅠ后表达量也逐渐升高。在6~8 d 时PCTEC大量坏死,坏死细胞中表达的Wnt7b、β-catenin和MMP-7会随着细胞碎片在肾小管内聚集,使CMJ和CT处的蛋白表达增高,可能参与诱导启动肾祖细胞的增殖修复过程[22]。本研究结果显示,AAⅠ能够激活Wnt/β-catenin信号,可能参与肾小管上皮细胞损伤后的再生与修复过程。
急性AAⅠ中毒小鼠的肾脏损害,主要以PCT上皮坏死和脱落为主,与时间和AAⅠ浓度呈正相关;DCT和CT损伤较轻,以水肿为主;PCTEC的Wnt7b、β-catenin和MMP-7的表达量增高,可能参与肾小管上皮细胞的修复和再生过程。
