蓝、紫单色光处理对三叶青生理及总黄酮含量时空变化的影响*
2023-06-28刘守赞蒋玲苔顾依雯韩敏琪王红珍
刘守赞,蒋玲苔,张 韵,顾依雯,韩敏琪,李 姗,王红珍,白 岩
(浙江省特色中药资源保护与创新利用重点实验室/浙江农林大学植物园/浙江农林大学食品与健康学院 杭州 311300)
三叶青为葡萄科(Vitaceae)崖爬藤属(Tetrastigma)植物,学名三叶崖爬藤(Tetrastigma hemsleyanumDiels et Gilg)[1],含有多种黄酮类化合物,具有抗肿瘤[2]、抗炎[3]、退热[1]等作用,被列为“新浙八味”,具有“植物抗生素”“抗癌神草”等美誉,为民间珍稀中草药。三叶青喜阴喜湿,原生于林下荫蔽的环境中,野生资源逐渐稀少。近年来,常在低产经济林或毛竹(Phyllostachys edulis)林下套种三叶青,既可以充分利用生态资源,发展林下经济;同时对于发展绿色无公害药用植物种植、促进生态农业可持续发展,具有重要意义。
蓝紫光是植物生长发育过程中重要的环境因子之一,除了为光合作用提供能量外,还作为一种信号因子,调控生长发育或产生胁迫,进而影响次生代谢。其中,黄酮类化合物合成受光质的较大影响。例如,李小明等[4]研究发现红光、蓝光和黄光处理可以提高淫羊藿(Epimedium brevicornuMaxim.)中类黄酮含量;蓝光能调控茶树[Camellia sinensis(L.) O.Ktze]鲜叶在萎凋过程中儿茶素含量的变化,其中6 h 处理是提高茶树鲜叶儿茶素类含量的最佳工艺[5];黄光、蓝光和红光能提高黄芪[Astragalus membranaceus(Fisch.) Bunge]中的黄酮、皂苷、多糖含量等主要药效成分以及单株经济产量[6]。关于蓝、紫光调控三叶青生长特性及其生理响应机制的研究较少,但是光质对三叶青的相关研究逐渐增加,例如,程小燕等[7]、韩敏琪等[8]、Bai 等[9-10]探讨了多种光质对三叶青生长、有效成分含量以及三叶青的响应机制等。
本文通过蓝、紫两种短波光光质及光周期处理三叶青,测定其黄酮含量、合成酶活性及相关生理生化指标,揭示三叶青对光质响应的时空差异和变化规律,可丰富三叶青品质调控的研究内容,同时,研究结果可为三叶青的提质栽培提供理论依据。
1 材料与方法
1.1 试验材料
选用近3 年生块根膨大的三叶青实生苗为试验材料,经浙江农林大学周爱存博士鉴定为三叶崖爬藤。试验处理及测定在省部共建亚热带森林培育国家重点实验室进行。试验苗种植于浙江农林大学试验基地(浙江临安,30°15′30.39″N,119°43′26.92″E);盆栽(直径18 cm),基质配比为泥炭、田园土、珍珠岩、牛粪=4∶4∶4∶1,每盆栽种1 棵。
1.2 试验设计
缓苗两个月后,选取生长健壮、无病虫害、苗高及大小近似的三叶青30 盆,随机分为3 组,移入实验室内由不透光黑布完全覆盖的3 组置物架中,分别配置40 W 的白光、紫光和蓝光3 种LED 灯(购于南京华强电子有限公司),距离苗20 cm,光强范围为1630~1660 Lx。照射时间为每天7:00-19:00,每3 d浇一次水,浇水量一致。分别在处理后的7 d、15 d、30 d、45 d 和60 d 取样。每个指标重复5 次,即测定5 株,选择其中3 株标准差最小的作为最终结果。
1.3 测定指标及方法
1.3.1 光合色素含量测定
将叶片洗净、擦干、去中脉、剪碎(下同),称取0.1 g,加入5 mL 的95 %乙醇,震摇,避光浸泡45 h至叶片发白。采用紫外分光光度计(UNICO 3802 UV/VIS Spectrophotometer)测定波长663 nm、645 nm和470 nm 处的吸光度,用95%乙醇作为对照。参考Lichtenthaler[11]的方法计算。
1.3.2 保护酶活性和丙二醛含量测定
称取三叶青各处理组新鲜叶片0.5 g,采用张志良等[12]的方法,用TU-1900 双束紫外分光光度计测定过氧化氢酶(CAT)、过氧化物酶(POD)、超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量。
1.3.3 渗透调节物质含量测定
准确称取三叶青各处理组叶片和块根各0.5 g,参考徐琳煜等[13]方法,测定可溶性蛋白质和可溶性糖。
1.3.4 黄酮合成酶及总黄酮含量的测定
选用三叶青地下块根及叶片,参照胡晓甜等[14]的方法,测定三叶青中苯丙氨酸解氨酶(PAL)、查尔酮合成酶(CHS)和查尔酮异构酶(CHI)活性;测定块根及叶片中总黄酮含量。
1.4 数据分析
利用Excel 2010 和SPSS 19 软件对数据进行统计分析,运用单因素方差分析法(One-way ANOVA)和最小显著性差异法(LSD)进行方差分析和多重比较(α=0.01)。图和表中数据为平均值±标准差。
2 结果与分析
2.1 蓝光和紫光处理可调控光合色素含量变化
蓝光和紫光照射可使三叶青的光合色素含量和比例发生变化。对比试验结果发现(图1A 和1B),随着照射时间增加,蓝光更有利于叶绿素a 和叶绿素b的积累,并最终呈现了较为显著的差异;随蓝光处理时间增长,叶绿素a 含量呈现缓慢增长趋势。在处理15 d 后,蓝光处理的叶绿素a 含量显著高于紫光处理,45 d 时,蓝光处理的叶绿素a 含量显著高于白光和紫光处理。而叶绿素b 对蓝光的响应呈现先下降后上升的趋势,在照射45 d 时达到峰值[(0.10±0.02) mg·g-1(FW)],此时叶绿素b 含量显著高于其他两个处理。紫光照射与蓝光相反,短时间照射促进叶绿素含量显著升高,之后呈现波动式下降,也与对照形成了较为显著的差异(图1C)。此外,图1D 显示,在短时间(7 d)紫光照射后,胡萝卜素含量上升极快[(1.97±0.06) mg·g-1(FW)],显著高于其他处理,为白光和蓝光处理的9.37~13.70 倍,形成了一个极为显著的峰值。随着紫光照射时间的延长,胡萝卜素含量显著下降。

图1 蓝光和紫光对三叶青光合色素的影响Fig.1 Effects of blue and purple light on pigment contents of Tetrastigma hemsleyanum
2.2 蓝光和紫光可调控三叶青抗氧化保护酶及丙二醛含量
图2A 显示,与白光处理组相比,对三叶青进行蓝光和紫光处理7 d 后,CAT 活性显著受到抑制。随着光照时间增加,各处理组的CAT 活性均增加,并在45 d 达峰值,且与7 d 的活性相比,白光对照组、蓝光组和紫光组分别增加1.31 U·g-1(FW)、1.64 U·g-1(FW)和1.48 U·g-1(FW)。这表明蓝光处理提高CAT 活性的效果更好。
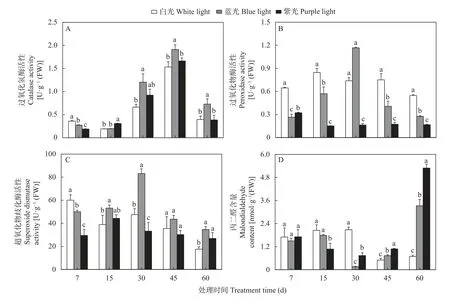
图2 蓝光和紫光对三叶青叶片保护酶活性和丙二醛含量的影响Fig.2 Effects of blue and purple light on the activities of protective enzymes and malondialdehyde content in leaves of Tetrastigma hemsleyanum
图2B 显示,与白光处理组相比,POD 活性显著受到蓝光和紫光的抑制(除蓝光处理30 d)。在处理30 d 后,蓝光处理POD 活性显著增加并达到峰值(1.17 U·g-1),随照射时间延长,POD 活性呈现显著下降趋势。在处理15 d 后,紫光处理POD 活性显著低于其他处理。
图2C 显示,SOD 活性对蓝光和紫光的短期(7 d)响应与CAT 一致,均受到抑制,显著低于白光处理组。蓝光对SOD 活性的影响趋势与POD 一致,均呈现先上升后下降的趋势,SOD 活性在30 d 达峰值[83.21 U·g-1(FW)],显著高于其他处理组。经紫光照射15 d 后,SOD 活性显著增加且达到峰值[44.31 U·g-1(FW)],随后呈现持续下降趋势。
图2D 显示,在30 d 前,白光对照处理的MDA含量缓慢上升,45 d 开始大幅度下降,比7 d 时减少1.20 nmol·g-1(FW)。蓝光和紫光处理的MDA 含量变化与前3 种酶趋势大致呈负相关,其含量先下降,至30 d 时降至最低,相比7 d 时的含量分别下降1.34 nmol·g-1(FW)和0.98 nmol·g-1(FW),随后MDA 含量上升,在60 d 时比7 d 时两处理分别增加1.83 mmol·g-1(FW)和3.58 mmol·g-1(FW)。
2.3 三叶青可溶性物质含量变化对蓝光和紫光的响应度有差异
图3A 显示,白光对三叶青叶片中的可溶性蛋白含量影响不大。经过蓝光和紫光短时间(7 d)照射,叶片中的可溶性蛋白得到迅速积累,含量显著高于白光处理,为白光处理的2.08~2.63 倍;15 d 后,可溶性蛋白含量随照射时间的延长呈持续降低的趋势。

图3 蓝光和紫光处理对三叶青渗透调节物质的影响Fig.3 Effects of blue and purple light treatments on osmotic adjustment substances of Tetrastigma hemsleyanum
图3B 显示,块根中的可溶性蛋白含量远高于叶片,且随照射时间的延长均呈现先升高后减少的趋势;在15 d 时,蓝光组块根中的可溶性蛋白含量显著低于其他处理组,紫光组块根中的可溶性蛋白含量显著高于白光和蓝光处理组。
图3C 显示,经过60 d 的处理,蓝光处理叶片可溶性糖含量始终显著高于白光对照处理。经白光照射45 d,叶片可溶性糖含量达峰值(0.06 mg·g-1),与7 d 的含量(0.04 mg·g-1)相比显著增加48%;经蓝光照射30 d,可溶性糖含量达峰值(0.16 mg·g-1),与7 d的含量相比显著增加180%;经紫光短期(7 d)照射后,可溶性糖迅速积累,含量显著高于白光处理,为白光处理的4.34 倍,随照射时间延长,其含量显著下降。
图3D 显示,块根中的可溶性糖含量远高于叶片。经过60 d 的处理,蓝光和紫光组块根中的可溶性糖含量始终显著高于白光处理组。随处理时间的延长,可溶性糖的含量均呈现先上升后下降的趋势,且在30 d 达峰值。
2.4 蓝光和紫光调控黄酮合成酶活性并影响总黄酮含量
2.4.1 三叶青黄酮合成酶活性对蓝光和紫光处理的响应
PAL、CHS 和CHI 是植物苯丙烷类代谢途径中的关键酶,其活性与黄酮类化合物变化密切相关。图4A 显示,在叶片中,经白光照射后,PAL 活性最高值为76.69 U·g-1(FW) (45 d),比7 d 仅提高8%;经蓝光照射后,PAL 活性受到持续抑制,照射60 d,PAL活性相比于7 d 减少24%,且该处理活性始终显著低于白光处理;经紫光照射后,PAL 活性呈现先上升后下降的趋势,在15 d 达峰值[96.50 U·g-1(FW)],与7 d相比增加约61%,此时PAL 活性显著高于白光和蓝光处理,在45 d 之后与白光处理无显著差异。
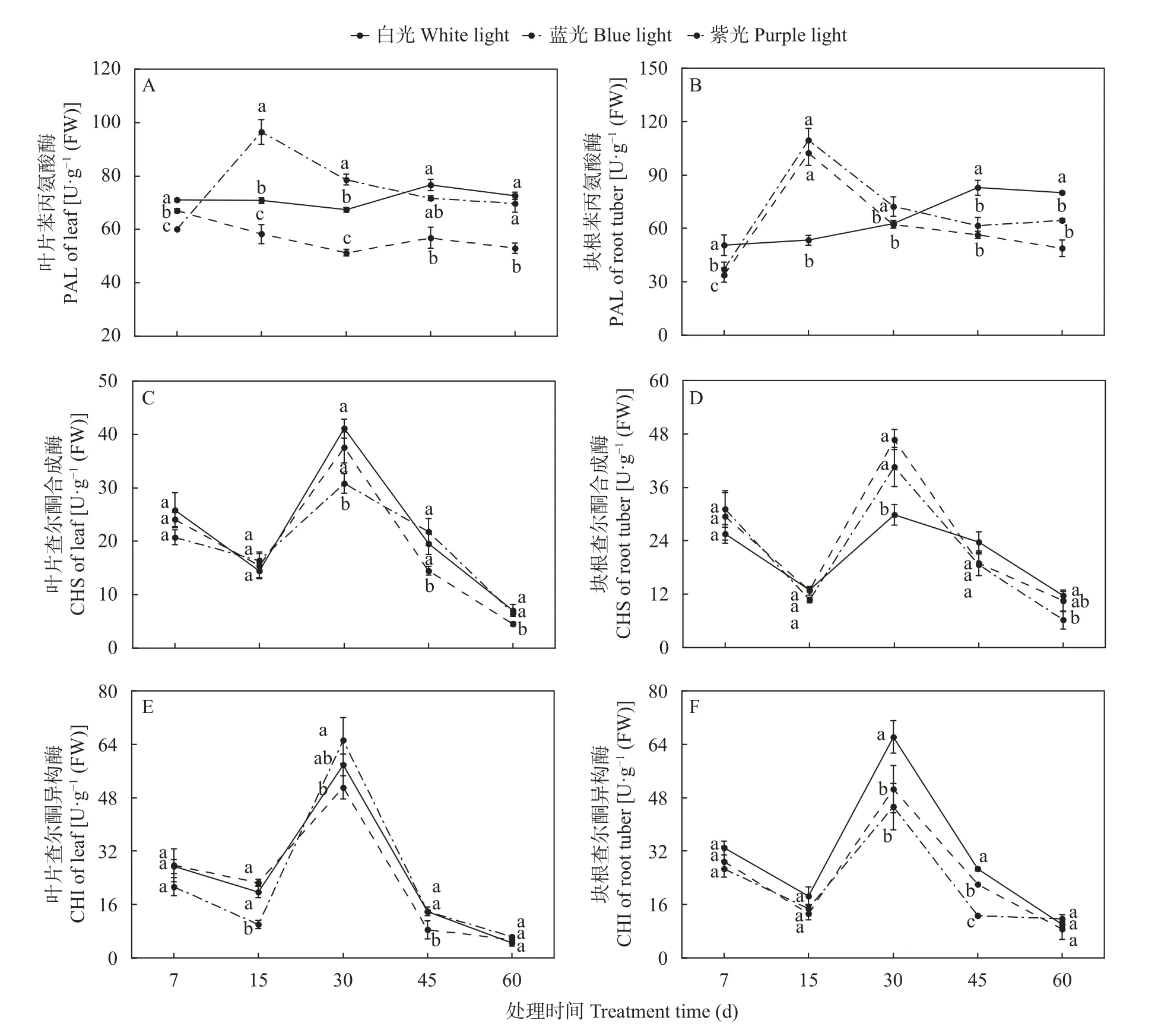
图4 蓝光和紫光对三叶青黄酮合成酶活性的影响Fig.4 Effects of blue and purple light treatments on activities of flavonoids synthases of Tetrastigma hemsleyanum
图4B 显示,在块根中,经白光处理后,PAL 活性总体呈上升趋势,于30 d 后快速上升,45 d 时达峰值,是7 d 的1.64 倍;PAL 酶活性对蓝光和紫光处理的响应一致,均呈现先上升后下降的趋势,于15 d 达峰值,为7 d 的2.96~3.01 倍,此时PAL 活性显著高于白光处理,在45 d 和60 d,PAL 活性则显著低于白光处理。
图4C 和4D 显示,叶片和块根中的CHS 活性对白光、蓝光和紫光的响应一致,均呈先上升后下降趋势,在30 d 达峰值,为7 d 的1.48~1.59 倍。叶片中,蓝光处理的CHS 活性在45 d 和60 d 时显著低于白光处理;紫光处理的CHS 活性在30 d 时显著低于白光和蓝光处理,在45 d 和60 d 时与白光处理无显著差异。块根中,蓝光和紫光处理的CHS 活性在30 d时显著高于白光处理。
由图4E 和4F 可知,叶片和块根中的CHI 活性与CHS 活性变化趋势一致,均表现为先上升后下降趋势。叶片中,蓝光处理的CHI 活性在45 d 显著低于白光处理;紫光处理的CHI 活性在15 d 显著低于白光处理,随着处理时间的延长,活性逐渐与白光处理趋于一致。块根中,蓝光和紫光处理的CHI 活性在30 d 和45 d 显著低于白光处理。
2.4.2 三叶青叶片和块根中总黄酮含量对蓝光和紫光处理的响应
图5A 显示,在叶片中,经白光处理后总黄酮含量在各时间段均有增加,但是增幅较小,与7 d 相比仅提高4%~18%;总黄酮对蓝光的响应总体呈现上升趋势,前期(7 d)处理下总黄酮含量显著低于白光和紫光处理,在45 d 时达最大值,与7 d 相比显著提高165%,且显著高于白光和紫光处理;而紫光对叶片中总黄酮的增长作用仅体现在7 d 时,此时总黄酮含量显著高于白光和蓝光处理。
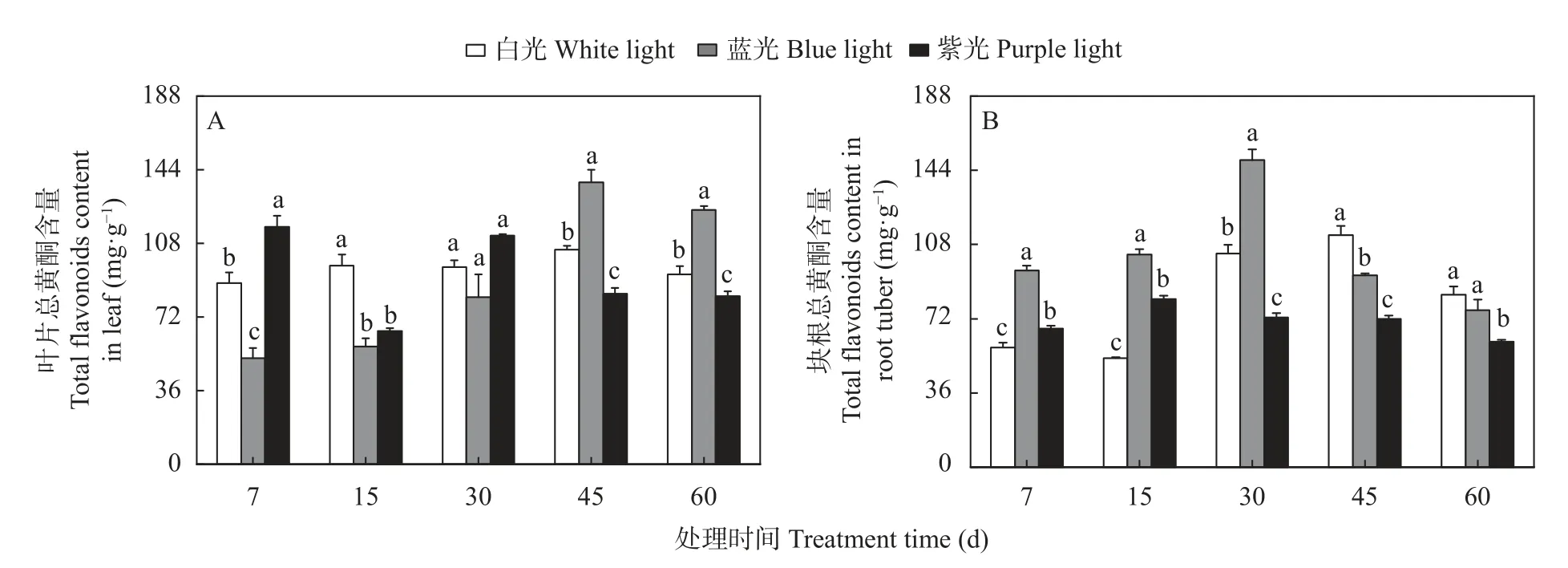
图5 蓝光和紫光对三叶青总黄酮含量的影响Fig.5 Effects of blue and purple light treatments on contents of total flavonoids of Tetrastigma hemsleyanum
图5B 结果显示,在块根中,总黄酮对白光、蓝光和紫光的响应趋势相近,呈现先升高后降低的趋势。蓝光对三叶青块根中的总黄酮的促进作用比紫光处理更持久,在7 d 和15 d 时,蓝光和紫光处理总黄酮含量显著高于白光处理;在30 d 时,总黄酮含量则表现蓝光处理>白光处理>紫光处理。白光、蓝光和紫光处理分别在45 d、30 d 和15 d 时总黄酮含量达峰值,比7 d 分别显著增加94%、56%和22%,且蓝光处理总黄酮含量最大积累量显著高于其他处理最大积累量。
3 讨论
三叶青喜阴,生长于林下,对光条件(光照强度、光质组成、光照时长)的变化较为敏感。尤其是光质,会对三叶青产生两方面影响: 一方面,影响三叶青光合作用[8]、碳氮代谢[15]、生长发育和产量;另一方面,调控三叶青的次生代谢[7]及相关酶活性,进而影响品质。本研究中,黄酮类化合物的合成和相关酶活性受光的影响十分显著,当蓝光处理15 d 和30 d时,块根中的PAL 酶和CHS 酶活性显著提升,同时总黄酮含量显著高于白光和紫光处理。分析认为PAL 和CHS 酶活性的提高促进了黄酮合成途径中的前体物质转化成黄酮化合物,显示出了较强的相关性。大量研究[16-18]佐证了此结果,例如,Liu 等[19]发现蓝光能够促进青钱柳[Cyclocarya paliurus(Batalin)Iljinsk.]特定类黄酮成分含量的提高,且与CHS、PAL 活性存在显著正相关;在拟南芥[Arabidopsis thaliana(L.) Heynh.]研究中发现[20],蓝光可以诱导CHS 和PAL 的mRNA 的积累并增加酶活力,促进类黄酮类物质的积累。另外,经紫光处理后,块根中的总黄酮含量显著低于白光和紫光处理,CHI 酶活性表现出相同的趋势,由此推断,紫光处理可能抑制了CHI 酶活性,影响黄酮的合成并导致含量降低。以上结果表明,不同波长的光启动了不同光感受器的信号级联[21],影响了各类酶活性,最终导致三叶青黄酮含量各异。
在光质调控三叶青的过程中,光合色素的含量可间接影响黄酮化合物的合成和积累。叶绿素含量随着蓝光照射不断积累(照射45 d 的叶绿素a、照射45 d 和60 d 的叶绿素b 均显著高于白光和紫光处理),与汪星星等[22]研究结果相似,即在蓝光处理后期,杉木[Cunninghamia lanceolata(Lamb.) Hook.]林幼苗中的叶绿素a 含量显著增加;代艾林等[23]研究发现蓝光能显著提高朝鲜淫羊藿(Epimedium koreanumNakai)中的叶绿素b 含量。同时,叶绿素含量变化趋势与叶片中总黄酮含量变化的趋势相似,分析认为叶绿素在植物中担当光能捕获和传递等的重要角色[24],参与光合作用,影响黄酮合成途径前期的糖酵解途径[25],最终影响黄酮化合物的合成。蓝光和紫光持续照射后,叶绿素a/b 均呈现先上升后下降的趋势,反映了三叶青叶片对光抑制具有一定的抗性[26],但超过阈值则应对光抑制的抗性变弱。此外,陈家琛等[27]利用蓝光处理杉木幼苗发现类胡萝卜素无明显变化,卢素萍等[28]对烤烟(Nicotiana tabacumL.)持续紫光处理42 d 后类胡萝卜素含量逐渐降低,均与本研究结果相似,显示了不同波段的光对类胡萝卜素的作用也是有差异的。
本研究显示,可溶性蛋白与黄酮类化合物的合成有正相关。短期(7 d)紫光照射促进了三叶青可溶性蛋白的积累,这与短期(4 d)紫光处理增加绿辣椒可溶蛋白含量的结果相近似[29];同时,可溶性蛋白变化趋势与叶片中总黄酮含量一致,显示了较强的正相关性,分析认为应该是次生代谢重要的前体物质[30]。同时,紫光处理对三叶青叶片中可溶性蛋白的促进作用显著高于蓝光。研究表明,紫光的光量子能较高,为蛋白质的合成提供了能量[31],因此,短期内影响显著,但是,当光照时长和强度超出阈值时,则显示较强的抑制作用。可溶性糖是初生代谢的重要产物[21,32],在各种生理功能中担负重要作用,常常参与渗透调节,提高细胞保水能力,保障细胞正常生理功能。本研究发现,蓝光和紫光照射后,块根中的可溶性糖含量均高于对照,与刘鑫等[33]和李慧敏等[34]的研究结果一致;长时间处理后,除了蓝光处理的叶片中黄酮含量显著高于对照之外,其余处理均明显下降,并未与可溶性糖呈现显著的相关性,分析认为可能与黄酮类化合物在药用植物中起到光保护和抗氧化作用有关[35],具体机制有待深入研究。
当三叶青处于逆境时,抗氧化酶系统可有效清除活性氧和自由基,起到较强的保护作用[36]。30 d和45 d 时,蓝光处理组的CAT、POD、SOD 酶活性较高,MDA 含量较低,说明3 种酶的共同保护降低了胁迫伤害;60 d 时,保护酶活性普遍下降,MDA 含量则迅速升高,此结果与孟畅等[37]的研究结果一致。紫光的较强能量致使POD 酶在7 d 时即下降并持续无变化,与吴娇等[29]的研究结果一致,显示出酶钝化的现象;其他酶活性在15 d 和30 d 时较活跃,随后活性逐渐降低,MDA 含量在相对应的峰值时间呈现了最低值,在60 d 时快速升高,显示出保护酶系统的协同作用。综合以上结果认为,60 d 左右的蓝光和紫光照射已经对三叶青构成了单光胁迫,产生大量的过氧化物,不利于黄酮类化合物的合成和积累。
4 结论
蓝光和紫光处理均不同程度地影响了三叶青的生理特性和总黄酮含量。适宜的照射时长(蓝光30~45 d,紫光7 d 左右)有利于提高三叶青总黄酮的含量,增加光合色素含量,提升抗氧化酶活性,降低丙二醛含量。本研究结果丰富了光质调控药用植物的研究,有利于促进三叶青块根的生长,提升其药材品质。
