黄土高原紫花苜蓿地土壤AMF 群落结构及其组装机制*
2023-06-28罗珠珠何仁元牛伊宁刘家鹤蔡立群
高 瑞,罗珠珠,**,何仁元,牛伊宁,刘家鹤,蔡立群,,海 龙
(1.甘肃农业大学资源与环境学院 兰州 730070;2.省部共建干旱生境作物学国家重点实验室 兰州 730070)
丛枝菌根真菌(arbuscular mycrrohizal fungi,AMF)能与约80%的植物产生共生体[1],尤其是豆科(Leguminosae)和禾本科(Gramineae)植物,是土壤微生物区系中分布最为广泛的一类有益微生物。菌根真菌协助植物吸收土壤中的各种营养物质,植物为菌根真菌提供生长发育所需的碳水化合物。Lukas 等[2]通过meta 分析发现,AMF 的侵染有利于作物根系生长,可使作物增产约20%[3]。特别是对于豆科作物,AMF 与根瘤菌联合调控作物根际环境,影响土壤生态环境和豆科作物生长[4-5],AMF 的侵染可通过增加豆科作物的豆血红蛋白的含量、根瘤鲜重、结瘤数量、固氮酶的活力等,强化生物固氮能力[6-8]。综上,AMF 在提高作物产量、群落组装、稳定生态系统等[9]方面受到了广泛关注。中性学说指出群落组装由随机过程或扩散限制决定;生态位学说指出确定性过程的重要性,由生物和环境过滤调控[10]。生态学家普遍认为自然条件下的微生物群落组成由确定性和随机过程共同决定,是扩散限制、环境过滤及物种相互作用的结果[11-12],最近分类单元指数(Beta Nearest Taxon Index,βNTI)通过零模型运算将所有生态变量对“选择”的影响作为一个整体进行量化,避免了主成分分析(Principal Component Analysis,PCA)和主坐标分析(Principal Co-ordinates Analysis)等传统方法对被测因素或人为关注的因素解释量的偏差。因而结合βNTI 和基于Bray-Curtis 的Raup-Crick指数(Bray-Curtis-based Raup Crick metrics,RCbray)可以综合估算生态过程,能更科学地定量评价不同生态过程对AMF 群落组装的贡献[13]。
紫花苜蓿(Medicago sativa)在我国栽种历史久远[14],是黄土高原分布较广的草种。同时抗旱、耐盐碱,在促进植被恢复、改善生态环境及提高当地畜牧业发展方面发挥重要作用。当前仅甘肃省紫花苜蓿种植面积达74.67 万hm2,商品紫花苜蓿产量达204 万t,居全国首位[15]。然而,紫花苜蓿在连续多年种植后,将严重消耗土壤水分和磷素[16],使紫花苜蓿产量下降,同时制约后续作物生长。而有研究表明,AMF 与植物形成共生体用来增加磷的吸收,最终提高土壤磷的利用率[17]。面对养分胁迫环境尤其是磷胁迫时,AMF 能释放质子动员不溶性土壤磷酸盐,并扩展其分布广泛的菌丝到磷耗尽区,用于探索更大的土壤体积以获取无机磷源[18]。AMF 分泌的果糖一方面调节蛋白质分泌系统刺激细菌中磷酸酶基因的表达,另一方面调节磷酸酶释放到生长介质中的速率。磷酸酶活性随后增加,促进植酸(即有机磷)矿化为无机磷,刺激AMF 吸收磷[19],调节植物生长。
土壤理化性质是影响土壤AMF 多样性和群落结构的重要因素[20]。在所有矿质营养中,以磷和AMF 的关系最为密切[21],其原因为土壤高磷浓度会改变宿主植物根系分泌物,导致AMF 生存环境发生改变[22]。因此,本研究假设,紫花苜蓿种植年限延长引起的土壤水分和磷素耗竭,会使得AMF 基因丰度显著增加,并促进AMF 群落特别是优势类群发生明显变化。为验证以上假设,通过高通量测序技术和荧光定量PCR 技术研究不同种植年限紫花苜蓿地土壤AMF 群落多样性和结构,采用分子生态网络技术分析AMF 属之间的关系,并基于零模型揭示AMF 群落组装过程以及主要环境驱动因子,为黄绵土AMF 研究及紫花苜蓿人工草地可持续发展提供理论依据。
1 材料与方法
1.1 研究区概况
研究基于布设在甘肃省定西市甘肃农业大学旱作农业综合试验站(104°44′E,35°28′N)的长期定位试验进行。该区海拔2000 m,干燥度2.53,无霜期140 d,年均日照时数2476.6 h,年均降水量390 mm,年蒸发量1531 mm,年均气温为6.4 ℃,年均太阳辐射量为592.9 kJ·cm-2,为半干旱雨养农业区,土壤为黄绵土。
1.2 试验设计
研究对象为紫花苜蓿草地,分别建植于2019 年(L2019)、2012 年(L2012)、2003 年(L2003);对照为农田,种植当地主栽作物玉米(Zea mays)。小区面积为7 m×3 m=21 m2,3 次重复,随机区组排列。紫花苜蓿品种均为‘陇东苜蓿’,采用条播方式播种,播量为22.5 kg·hm-2,在建植当年施P2O5105 kg·hm-2,纯N 105 kg·hm-2,紫花苜蓿生长期间未施肥,每年刈割两次。农田自2013 年开始连续每年播种玉米,品种为‘先玉335’,种植密度为5.25 万株·hm-2,每年播前以基肥施纯P2O5105 kg·hm-2,纯N 200 kg·hm-2,生育期不追肥。
1.3 土样采集
2021 年紫花苜蓿第1 茬盛花期(6 月),五点法在每个小区采集紫花苜蓿和农田玉米土壤(0~20 cm),混合成一个样品,每个处理3 次重复,剔除土样中的各种杂物,将土样充分混匀后带回实验室。将部分土壤样品放在-80 ℃冰箱中用作AMF 群落结构的测定;部分土样过筛(2 mm)留存于4 ℃冰箱用作土壤硝态氮测定;剩余土样风干后过1 mm 和0.25 mm筛,用于土壤理化指标的测定。
1.4 土壤理化指标测定
测定方法均参照《土壤农化分析》[23]。土壤水分(SW)测定使用烘干法,容重(BD)测定使用环刀法,全氮(TN)测定使用凯氏定氮法,有机碳(OC)测定使用浓硫酸-重铬酸钾(H2SO4-K2Cr2O7)外加热法,全磷(TP)测定使用高氯酸-浓硫酸(HClO4-H2SO4)-钼锑抗比色法,速效磷(AP)测定使用碳酸氢钠(NaHCO3)-钼锑抗比色法,速效钾(AK)测定使用醋酸铵(CH3COONH4)-火焰光度法,硝态氮(NO3--N)浸提使用2mol·L-1氯化钾(KCl)、全自动化学间断分析仪测定,pH 测定使用pH 计。
1.5 土壤AMF 群落测定
土壤微生物DNA 提取: 使用Power Soil® DNA试剂盒提取,DNA 的纯度和浓度在凝胶成像系统检测。荧光定量 PCR: 在DNA 完成提取后,扩增利用引物AMV4-5NF (5’-AAGCTCGTAGTT-GAATTTCG-3’)和AMDGR (5’-CCCAACTATC-CCTATTAATCAT-3’)进行。PCR 反应体系及条件: 95 ℃预变性5 min,1 个循环;95 ℃变性30 s;58 ℃退火30 s,35 个循环;72 ℃终延伸1 min,之后对PCR 产物采取纯化、定量。Illumina Miseq PE300 测序: 利用聚合DNA 产物构建Miseq 文库,借助于高通量测序平台测序,由上海美吉生物公司完成。
AMF 基因丰度: 质粒起始拷贝数换算公式(copies·μL-1)=浓度(ng·μL-1)×10-9×6.02×1023/(分子量×660),分子量指的是载体的大小加上目的基因的片段大小,采用科学计数法表示。
1.6 土壤AMF 分子生态网络构建及群落组装过程
选取土壤AMF 属间的Spearman 相关系数r>0.6,显著性P<0.05 的物种OTU,利用R 软件中“igraph”和“psych”包进行微生物群落相关性网络构建,应用Gephi0.9.2 软件进行网络可视化分析。
最近分类单元指数βNTI 借助R 软件中的picante 包中“mntd”和“ses.mntd”函数计算,表示AMF 群落组建过程。βNTI<-2 或>2,同质性选择(βNTI<-2)和异质性选择(βNTI>2),表明确定性过程占主导。-2<βNTI<2,随机性过程占主导[24]。基于群落的Raup-Crick 矩阵(简称RCbray)计算采用R 软件中的vegan 包。RCbray 值>0.95 表示扩散限制、RCbray 值<-0.95 表示同质性扩散、|RCbray|<0.95 表示不明确过程。
1.7 数据统计与分析
利用上海美吉公司I-sanger 云平台开展AMF 群落多样性及结构组成分析;使用Excel 2016 进行数据统计分析,同时绘制AMF 在属水平上的相对丰度图;使用SPSS 25.0 对数据进行单因素(ANOVA)方差分析和多重比较(LSD 法,P=0.05);分子生态网络通过R 语言计算,Gephi 软件可视化处理;SIMPER 分析采用R 软件中的vegan 包进行运算;AMF 属水平与理化因子之间运用Canoco5 进行冗余分析(RDA);群落组装过程通过R 语言计算;Origin 2021 进行绘图,并用Adobe Illustrator 2020 对图表进行调整。
2 结果与分析
2.1 不同种植年限紫花苜蓿地土壤基本理化性状及AMF 基因丰度
由表1 可以得出,农田土壤水分(SW)、土壤全磷(TP)、速效磷(AP)和硝态氮(NO3--N)显著高于(P<0.05)紫花苜蓿地,且土壤全磷和速效磷含量随紫花苜蓿种植年限延长显著降低(P<0.05);紫花苜蓿地土壤有机碳(OC)、全氮(TN)随紫花苜蓿种植年限延长呈增加趋势,L2003处理显著高于(P<0.05)农田和L2019、L2012;土壤容重(BD)、速效钾(AK)和pH在农田和紫花苜蓿地均未表现出明显差异。不同处理AMF 基因丰度为1.02×104~1.50×104copies·g-1,其随紫花苜蓿种植年限的延长增加,L2003显著高于其他处理(P<0.05)。相关分析表明(表2),AMF 基因丰度与土壤全氮(TN)呈极显著正相关(P<0.01),与土壤全磷(TP)、速效磷(AP)呈极显著负相关(P<0.01)。

表1 不同处理土壤基本理化性状及丛枝菌根真菌(AMF)基因丰度Table 1 Soil physicochemical properties and abundance of arbuscular mycorrhizal fungi (AMF) gene under different treatments
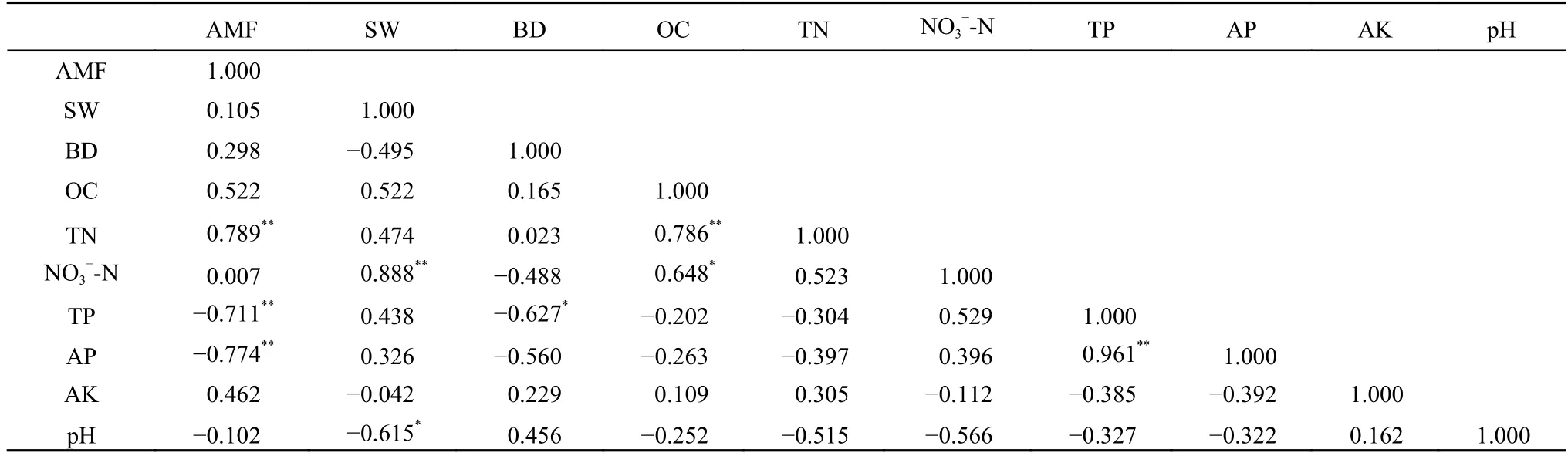
表2 丛枝菌根真菌(AMF)基因丰度与土壤理化因子相关分析Table 2 Correlation analysis of arbuscular mycorrhizal fungi (AMF) gene abundance and environmental factors
2.2 不同种植年限紫花苜蓿地土壤AMF 群落多样性
Alpha 多样性结果表明(图1),土壤AMF 群落Ace 指数(图1A)和Chao 指数(图1B) L2019处理高于农田,随紫花苜蓿种植年限延长而降低;紫花苜蓿地Shannon 指数(图1C)低于农田,且随其种植年限延长而降低;紫花苜蓿地Simpson 指数(图1D)高于农田,且随其种植年限延长而升高。Alpha 多样性指数各处理间均无显著差异。
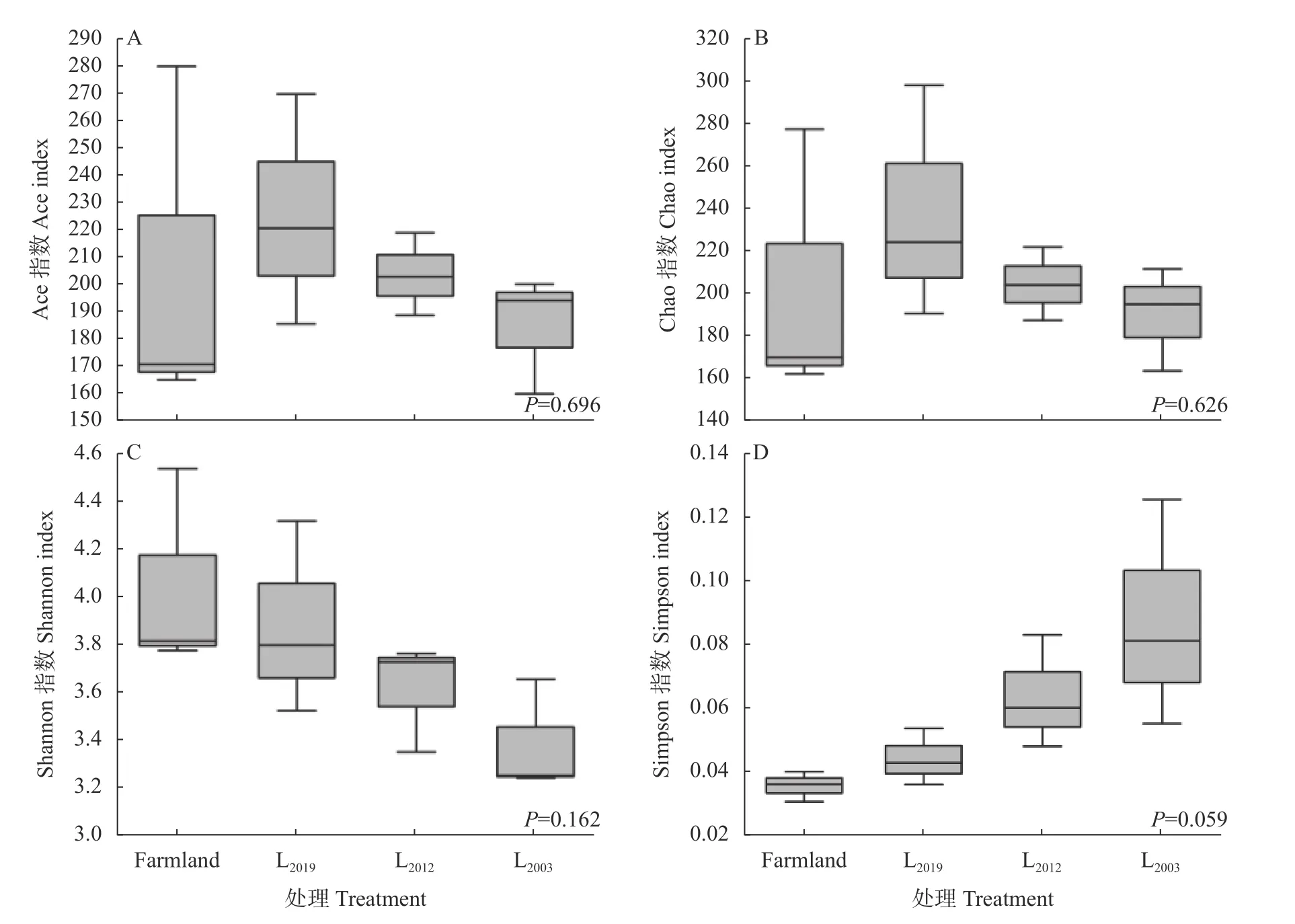
图1 不同处理土壤丛枝菌根真菌(AMF)群落多样性指数Fig.1 Diversity indexes of arbuscular mycorrhizal fungi (AMF) community under different treatments
通过计算Beta 多样性指数,基于Bray-curtis 距离算法,组间差异检验采用Adonis 对农田及不同种植年限紫花苜蓿地土壤AMF 群落进行PCoA 分析(图2)。第1 轴和第2 轴样本组成差异解释度分别为PC1 (40.80%)、PC2 (19.07%)。L2012、L2003处理主要集中在第3 象限,处理间有交集产生,表明这两处理AMF 物种信息更相似;农田主要集中在第1、2象限,L2019处理主要集中在第3、4 象限。不同处理AMF 群落组成差异显著(P<0.05)。

图2 不同处理土壤丛枝菌根真菌(AMF)群落主坐标分析Fig.2 Principal co-ordinates analysis (PcoA) of abundance of soil arbuscular mycorrhizal fungi (AMF) communities under different treatments
2.3 不同种植年限紫花苜蓿地土壤AMF 群落结构
通过对AMF 进行高通量测序,抽平根据最小样本数进行,处理后共得到650 个OTUs,分属于1 纲4目7 科7 属。从属水平群落组成发现已注释的AMF 有7 属(图3A),相对丰度占总序列的71.12%~99.99%,未明确分类物种占0.01%~28.88%,说明黄绵土中仍蕴藏着一些未知的AMF 资源有待进一步挖掘研究。紫花苜蓿地和农田共有类群为球囊霉属(Glomus)、类球囊霉属(Paraglomus)和多孢囊霉属(Diversispora),且均以球囊霉属(65.15%~99.12%)为优势属,各处理间并无显著差异。值得注意的是,本研究长期种植紫花苜蓿后促生了一些特有AMF 群落,双型囊霉属(Ambispora)和盾巨孢囊霉属(Scutellospora)仅能在紫花苜蓿地检测到,而在农田并未检测到,其中(如图3B)双型囊霉属L2019处理显著高于其他处理(P<0.05);同时长期种植紫花苜蓿也使得另外一些菌群消失,如和平囊霉属(Pacispora)和无梗囊霉属(Acaulospora)仅能在农田检测到,而在紫花苜蓿地未检测到。SIMPER 分析表明(表3),球囊霉属解释了农田、紫花苜蓿地不同分组之间的大部分差异,其相对贡献在L2019和L2003之间最高,其次是Farmland 和L2003之间。

图3 不同处理土壤丛枝菌根真菌(AMF)属水平群落结构(A)和双型囊霉属相对丰度(B)Fig.3 Relative abundance of soil arbuscular mycorrhizal fungi (AMF) community at the genus level (A) and relative abundance of Ambispora (B) under different treatments

表3 不同处理方式间丛枝菌根真菌(AMF)群落组成差异的优势属贡献率Table 3 Contribution rates of dominant genus to abundance of arbuscular mycorrhizal fungi (AMF) community compositions under different treatments %
为进一步明确AMF 群落7 个属之间的相互关系,利用网络关联分析构建分子生态网络,结果如图4 所示。网络平均度为0.571,平均加权度为0.134,网络直径为1.000,图密度为0.095,正相关节点连接存在于和平囊霉属和无梗囊霉属之间,两属均为低丰度物种,表明低丰度属之间可能存在协作关系;负相关节点连接存在于球囊霉属和类球囊霉属之间,两属均为高丰度属,表明高丰度属之间可能存在竞争关系。但由于仍有部分群落之间无明显相关关系,有待后续进一步挖掘。
为探究影响土壤AMF 群落组成的主导环境因子,以土壤AMF 群落属水平为响应变量,理化因子为解释变量进行RDA 分析(图5)。两排序轴累计变量可在49.47%解释属水平相对丰度AMF 群落结构组成的差异性。其中球囊霉属(Glomus)、盾巨孢囊霉属(Scutellospora)与容重(BD)和pH 呈正相关;和平囊霉属(Pacispora)、无梗囊霉属(Acaulospora)及类球囊霉属(Paraglomus)与土壤水分(SW)、速效钾(AK)、硝态氮(NO3--N)、全磷(TP)、速效磷(AP)呈正相关。蒙特卡洛检验结果表明,单个土壤理化因子对AMF 群落影响均未达显著水平,即土壤AMF群落受到多种土壤理化性质的共同影响。
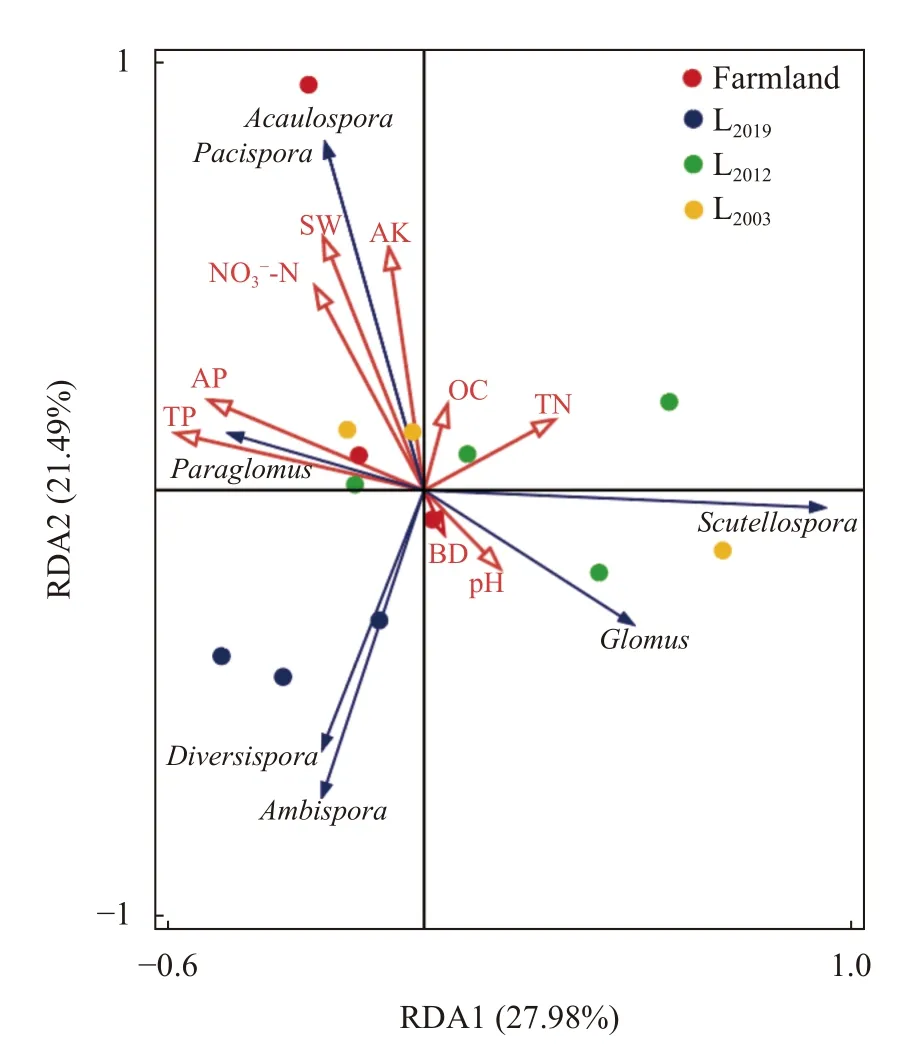
图5 不同处理方式下土壤丛枝菌根真菌(AMF)群落与土壤理化因子冗余分析Fig.5 Redundancy analysis (RDA) of abundance of soil arbuscular mycorrhizal fungi (AMF) communities and soil physicochemical properties under different treatments
2.4 不同种植年限紫花苜蓿地土壤AMF 群落组装机制
为了探寻驱动不同种植年限紫花苜蓿地土壤AMF 群落结构差异的原因,基于零模型分析微生物群落分布模式的内在组装机制。从土壤|βNTI|值来看(图6A),土壤AMF 群落组装农田和L2019处理以确定性组装为主(贡献率为66.67%),L2012和L2003处理以随机性过程为主(贡献率为100.00%)。进一步计算|βNTI|值<2 条件下RCbray 值(图6B),农田和L2019处理土壤AMF 群落随机性组装过程以确定性过程中的异质性选择(βNTI>+2)为主,其次是随机性过程中的不明确过程(|RCbray|值<0.95);L2012处理以随机性过程中的不明确过程(|RCbray|值<0.95)为主,L2003处理以随机性过程中的扩散限制(RCbray 值>0.95)为主。此外,本研究所有处理均未发现同质性选择和同质性扩散。进一步通过Mantel 分析发现(表4),βNTI与土壤理化的相关性均未达显著水平,这也进一步印证了土壤AMF 群落受到多种土壤性质的共同影响。

图6 不同处理土壤丛枝菌根真菌(AMF)群落组装生态过程Fig.6 Ecological processes governing abundance of soil arbuscular mycorrhizal fungi (AMF) community assembly under different treatments

表4 土壤理化因子与土壤丛枝菌根真菌(AMF)群落最近分类单元指数(βNTI)的Mantel 分析Table 4 Mantel tests of soil physicochemical properties and Beta Nearest Taxon Index (βNTI) of soil arbuscular mycorrhizal fungi (AMF) community
3 讨论
3.1 不同种植年限紫花苜蓿地土壤AMF 群落特征
AMF 能与80%以上的植物形成共生体-丛枝菌根进行互利互惠,是土壤微生物区系中分布最广泛的一类菌根真菌[25]。有研究表明速效磷、有机碳、全氮、黏土含量等显著影响土壤AMF 丰度[26]。本研究结果表明,紫花苜蓿地AMF 基因丰度随种植年限的延长而增加,但土壤磷素显著下降(表1),说明长期种植紫花苜蓿导致土壤缺磷刺激了植物与AMF 的共生关系。进一步的相关分析也发现,AMF基因丰度与土壤全磷和速效磷呈极显著负相关(P<0.01),进一步证实了本试验的假设。Urcoviche 等[27]研究表明,土壤磷素有效性是影响菌根共生的重要因素,低磷土壤AMF 定殖率较高,高磷水平反而会抑制其孢子的发育,因为AMF 菌丝直径比植物根直径小约10 倍,可以延伸到植物根系形成的枯竭区外并及时捕获磷酸盐,尤其是在低磷环境中更有利于菌根形成[28]。
王永明等[29]通过对AMF 归类发现,我国境内的AMF 归属于8 科12 属,其中球囊霉属为优势属(71%)。本试验也表明紫花苜蓿地和农田均以球囊霉属(65.15%~99.12%)为优势属,而且主要解释了不同处理间AMF 群落组成结构的变化,这与酸性红壤的研究结果类似[30],说明球囊霉属对土壤环境干扰的耐受性较强,其偏好性地适应不同土壤类型和不同土地利用方式。但是,由于紫花苜蓿多年种植改变了土壤理化性质,特别是水分和磷素的耗竭,促生形成了独特的丛枝菌根真菌群落。例如双型囊霉属和盾巨孢囊霉属为紫花苜蓿地特有菌属,可能是这两属AMF 的宿主特异性导致的。研究同时发现,和平囊霉属和无梗囊霉属为农田特有菌属,其中无梗囊霉属往往在酸性土壤环境具有更好的产孢率[31],而农田长期施肥造成土壤pH 低于紫花苜蓿地,导致无梗囊霉属在农田土壤中具有更好的繁殖能力;和平囊霉属更适宜于良好的水热环境,本试验农田种植玉米采用的全膜双垄沟播技术良好的蓄水保墒效果有利于和平囊霉属产孢定殖,而长期种植紫花苜蓿对土壤水分的耗竭限制了其繁殖。
3.2 不同种植年限紫花苜蓿地土壤AMF 组装过程
为了探寻驱动不同种植年限紫花苜蓿地土壤AMF 群落结构差异的原因,本研究基于零模型分析微生物群落分布模式的内在组装机制。农田与2019年建植的紫花苜蓿地的AMF群落组装主要由确定性过程为主导,说明土壤微生态环境受翻耕、施肥等农业活动的影响变化显著,进一步强化了土壤微生物群落组装的确定性过程[32],该结果与之前对旱地农田土壤微生物群落组装的研究结果一致[33]。但目前研究中种植水稻(Oryza sativa)、小麦(Triticum aestivum)等的农田土壤中微生物群落组装多为确定性过程,并且这类生态环境中确定性过程大部分以同质性选择占主导位置[34-35],然而本试验中异质性选择贡献最大,虽然较高的异质性选择过程将利于微生物群落形成更多生态功能,但具体原因还需要进一步探究。2012 年和2003 年种植的紫花苜蓿地的AMF 群落组装主要由随机性过程主导,由于紫花苜蓿本身具有固氮属性,减少了微生物进行生命活动的限制因素,直接增加了微生物可利用的碳、氮源,因此随机性过程主导其群落组装。本试验结果也表明,随紫花苜蓿种植年限的延长,土壤AMF 群落组装逐渐由确定性向随机性过渡。随机性过程相比于确定性过程能产生更加多样化的生态功能[36],还能缓冲由于环境强烈变化带来的扰动,有利于维持生态系统功能的稳定性和可持续性[37-38]。因此长期种植紫花苜蓿增加的随机性过程可丰富物种多样性,保持生态系统功能。
4 结论
长期种植紫花苜蓿后土壤氮磷变化显著影响AMF 基因丰度,其群落结构组成发生了明显的分异。球囊霉属(65.15%~99.12%)为黄绵土区紫花苜蓿和农田共有优势属,主要贡献了不同处理分组中土壤AMF 群落结构的改变。由于长期种植紫花苜蓿改变了土壤微环境,促生了一些特有AMF 群落,如双型囊霉属和盾巨孢囊霉属,也使得和平囊霉属和无梗囊霉属等群落消亡。高丰度AMF 球囊霉属和类球囊霉属呈现负相关,低丰度AMF 和平囊霉属和无梗囊霉属呈现正相关。基于生态零模型的群落组装机制发现,和农田生态系统相比,长期种植紫花苜蓿形成稳定的土壤环境使其随机性过程增加,而确定性过程下降,这有助于维持紫花苜蓿地人工草地生态系统功能的稳定性和可持续性。
