氢氧化铝佐剂吸附肠道病毒71型灭活病毒的特性
2023-06-28严皎赵勇贺凌煜納锐雄李亚东袁明翠蒋曦易力
严皎,赵勇,贺凌煜,納锐雄,李亚东,袁明翠,蒋曦,易力
中国医学科学院医学生物学研究所质量检定室国家药品监督管理局疫苗及生物制品质量控制与评价重点实验室,云南 昆明 650000
肠道病毒71 型(enterovirus 71,EV71)是手足口病(hand foot,and mouth disease,HFMD)的主要病原体之一,灭活EV71疫苗是采用氢氧化铝佐剂吸附灭活EV71 制备而成,该疫苗已在我国广泛应用,可有效控制HFMD 的发生和流行[1-3]。目前,创新疫苗佐剂的发展迅速,AS0 系列、MF59、CpG 等佐剂在疫苗的临床前研究及临床应用中获得了较大进展[4-8]。尽管铝佐剂并不能满足临床疫苗发展的所有需求,但仍是目前应用最广泛、机制研究较深入、明确安全有效的疫苗佐剂。铝佐剂的作用机制包括抗原缓释、保护抗原稳定、促吞噬、刺激固有免疫细胞活化等。铝佐剂的制备及抗原吸附过程对疫苗的免疫效力具有重要影响,包括铝佐剂的制备技术、组成成分、形态特征及抗原吸附量、吸附强度等[9-10]。铝佐剂吸附蛋白抗原的主要机制包括静电吸引、疏水相互作用和基团置换等[11-12]。研究发现,多数采用氢氧化铝佐剂的疫苗,吸附抗原率越高,激发免疫应答的能力越强[13];但也有研究显示,吸附力太强,可能不利于抗原释放和抗原递呈细胞摄取及加工,反而影响免疫应答刺激的产生[14]。因此,在疫苗的铝佐剂吸附中,应重点考虑抗原的吸附率和吸附作用力,以确保工艺的合理性及免疫效力的稳定性。在常用的疫苗配方中,PO43-和NaCl 浓度等因素会影响佐剂对抗原的吸附,离子强度越高,静电吸引力越低;离子强度升高,可能促进疏水相互作用。一般而言,通过静电吸引力或疏水作用力吸附蛋白质的吸附系数较低。基团置换作用具有更强的吸附力,其在抗原与佐剂带相同电荷时也能发生吸附,且受离子强度影响小,通过基团置换方式吸附系数通常较高,但基团置换作用会被溶液中的PO4
3-所破坏。
铝佐剂吸附亚单位蛋白抗原的研究较多[15-18],基于铝佐剂在临床应用中的成熟性,有多项研究致力于其性能提升[19-20],但关于铝佐剂对病毒颗粒吸附特性研究的报道相对较少。本研究利用中国医学科学院医学生物学研究所制备的灭活EV71,根据《预防用含铝佐剂疫苗技术指导原则》的相关内容[21],评价铝佐剂吸附EV71 灭活病毒颗粒的特性,以确保在EV71 灭活疫苗半成品配制过程中,抗原与佐剂吸附生产工艺的稳定性、可控性及合理性。
1 材料与方法
1.1 抗原及佐剂 灭活EV71 原液(批号:IF201931,抗原含量为4 000 U/mL)及氢氧化铝佐剂(批号分别为:2019-04-S、2019-05-S、2019-06-S;浓度分别为13.21、11.39 及13.53 mg/mL)均由中国医学科学院医学生物学研究所生物制品八室提供。
1.2 主要试剂及仪器 兔抗EV71多克隆抗体及生物素标记兔抗EV71抗体由中国医学科学院医学生物学研究所制备;亲和素-HRP 结合物购自北京索莱宝科技有限公司;生物素偶联试剂盒购自美国Abcam公司;甘氨酸购自美国Sigma公司;EV71抗原国家标准品由中国食品药品检定研究院提供;常规化学试剂均为国产分析纯;ZETA 电位粒度分析仪(ZS90)购自英国马尔文仪器有限公司;高效液相色谱(high-performance liquid chromatography,HPLC)仪LC-10A购自日本岛津公司;凝胶排阻层析高效液相色谱(size exclusion chromatography HPLC,SEC-HPLC)柱(SRT SEC-1000:7.8 mm×300 mm)购自美国Sepax Technologies公司;超滤离心管Amicon Ultra-15购自美国Merck Millipore公司。
1.3 病毒及氢氧化铝佐剂形态、纯度及粒径分布考察
1.3.1 电镜观察 委托中国医学科学院医学生物学研究所中心实验室进行。将灭活EV71原液经40 000×g离心3 h,浓缩为20 000 U/mL 的样品,将样品滴于铜网,再滴加50 μL 2%磷钨酸染液(pH 6.5)染色5 min,置透射电镜(80 kV)下观察。将氢氧化铝佐剂用PBS(20 mmol/L PB,150 mmol/L NaCl,pH 7.2)进行50倍稀释,按上述步骤置透射电镜下观察。
1.3.2 SEC-HPLC分析 将灭活EV71原液经40 000×g离心3 h,浓缩为40 000 U/mL浓度的样品,再经6 500×g离心1 min,超滤浓缩30倍后,进行SEC-HPLC 分析。以SRT SEC-1000(7.8 mm×300 mm)为色谱柱,流动相为:PBS(20 mmol/L PB,150 mmol/L NaCl,pH 7.2),流速为:0.2 mL/min。
1.3.3 动态光散射(dynamic light scatter,DLS) 按1.3.1 项方法制备20 000 U/mL 的灭活EV71 及50倍稀释的氢氧化铝佐剂(2019-06-S)样品,用粒度仪进行动态光散射分析,考察粒径分布特征。
1.4 吸附能力考察
1.4.1 单剂量疫苗氢氧化铝佐剂完全吸附最高抗原量 将灭活EV71 原液经40 000 ×g离心3 h,使抗原含量不低于40 000 U/mL。用2 mmol/L PBS 配制供试品,使EV71抗原含量分别为4 000、6 000、8 000、10 000、11 000、12 000、13 000、14 000、20 000、30 000 U/mL,氢氧化铝佐剂(2019-04-S、2019-05-S、2019-06-S)含量为0.35 mg/mL(按铝含量计),甘氨酸(作为病毒颗粒稳定保护剂)终浓度为3 mg/mL,室温吸附30 min;6 500×g离心5 min,取上清液,检测游离抗原含量,每批氢氧化铝佐剂制备的供试品均重复检测3 次。以未检出游离抗原的最高抗原含量浓度作为氢氧化铝佐剂对EV71 抗原的最高完全吸附量。
1.4.2 完全吸附单剂量疫苗抗原所需铝佐剂最低量 用2 mmol/L PBS 配制供试品,使EV71 抗原含量为250 U/mL,氢氧化铝佐剂(2019-04-S、2019-05-S、2019-06-S)含量为0.35、0.25、0.17、0.085 mg/mL(按铝含量计),甘氨酸终浓度为3 mg/mL,室温吸附30 min;6 500×g离心5 min,取上清液,检测游离抗原含量。
1.4.3 吸附动力学 用2 mmol/L PBS 配制供试品,使EV71抗原含量为250 U/mL,氢氧化铝佐剂(2019-04-S、2019-05-S、2019-06-S)含量为0.35、0.25、0.17、0.085 mg/mL(按铝含量计),甘氨酸终浓度为3 mg/mL,于室温分别吸附0、30及120 min;6 500×g离心5 min,取上清液,检测游离抗原含量;取沉淀,用解离剂处理30 min后,6 500×g离心5 min,取上清,检测吸附抗原量。各批氢氧化铝佐剂制备的供试品均进行3 次重复检测。
1.5 离子强度及磷铝摩尔比(P/Al)对灭活EV71 抗原吸附影响的检测
1.5.1 离子强度 用2 mmol/L PBS 配制供试品,使EV71抗原含量为250 U/mL,氢氧化铝佐剂含量为0.35 mg/mL(按铝含量计),甘氨酸终浓度为3 mg/mL,室温吸附30 min;加入NaCl 溶液至终浓度分别为0.15、0.75 和1.25 mol/L,4 ℃处理过夜;6 500 ×g离心5 min,取上清液,检测游离抗原含量,并按下式计算吸附率。
1.5.2 P/Al 同1.5.1 项方法配制供试品,室温吸附30 min;加入不同浓度的磷酸盐溶液,使P/Al 分别为0.15、0.64、2.08 及7.87,pH 为7.5;6 500×g离心5 min,取上清液,检测游离抗原含量。
1.6 抗原含量的检测 采用ELISA 法。用兔抗EV71多克隆抗体包被96 孔板,加入国家标准品(0.625~80 U/mL)及待检供试品,37 ℃孵育2 h;洗板液(0.5 mL Tween 20,0.01 mol/L PBS,pH 7.3)洗涤5 次,加入生物素标记兔抗EV71 抗体(1∶1 000 稀释),37 ℃孵育1 h;洗板液洗板5 次,加入亲和素-HRP 结合物(1∶1 000稀释),37 ℃孵育0.5 h;洗板液洗板5次,加入TMB 显色,以2 mol/L H2SO4终止反应,用酶标仪检测A450及A630,通过标准品建立的标准曲线获得抗原浓度。
1.7 数据整理及分析 应用GraphPad Prism 5.0 软件对试验数据进行整理及分析。
2 结果
2.1 病毒及氢氧化铝佐剂形态、纯度及粒径分布
2.1.1 电镜观察 镜下观察可见,灭活EV71 具有典型及完整的病毒颗粒形态,形态均一,直径约为30 nm;氢氧化铝佐剂稀释50 倍后进行电镜观察,其具有纳米化的特征,粒径分布在200~700 nm 之间。见图1。
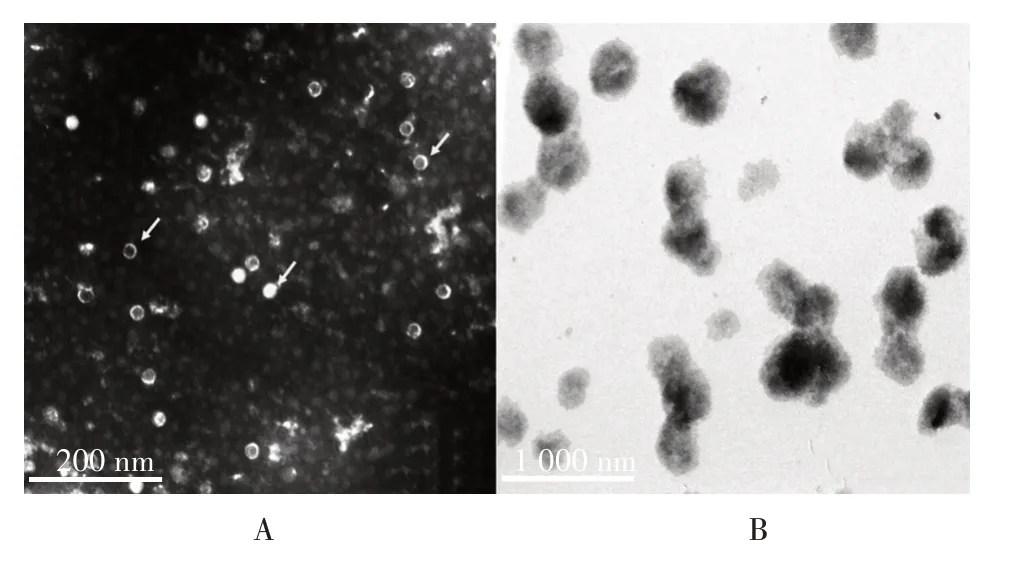
图1 透射电镜观察病毒颗粒(A)及氢氧化铝佐剂(B)的形态Fig.1 Observation of morphology of virus particles(A)and aluminum hydroxide adjuvant(B)by transmission electron microscope
2.1.2 SEC-HPLC 分析 灭活EV71 于42 min 出现病毒颗粒峰,存在少量聚合或解聚蛋白,可能是杂蛋白,表明病毒抗原主要以病毒颗粒形式存在,见图2。

图2 灭活病毒的SEC-HPLC分析Fig.2 Analysis of inactivated virus by SEC-HPLC
2.1.3 DLS 分析 氢氧化铝佐剂主要粒径分布在2 000 nm 附近,而EV71 病毒颗粒的粒径分布主要在20 nm附近,见图3。两者均具有较好的均一性。
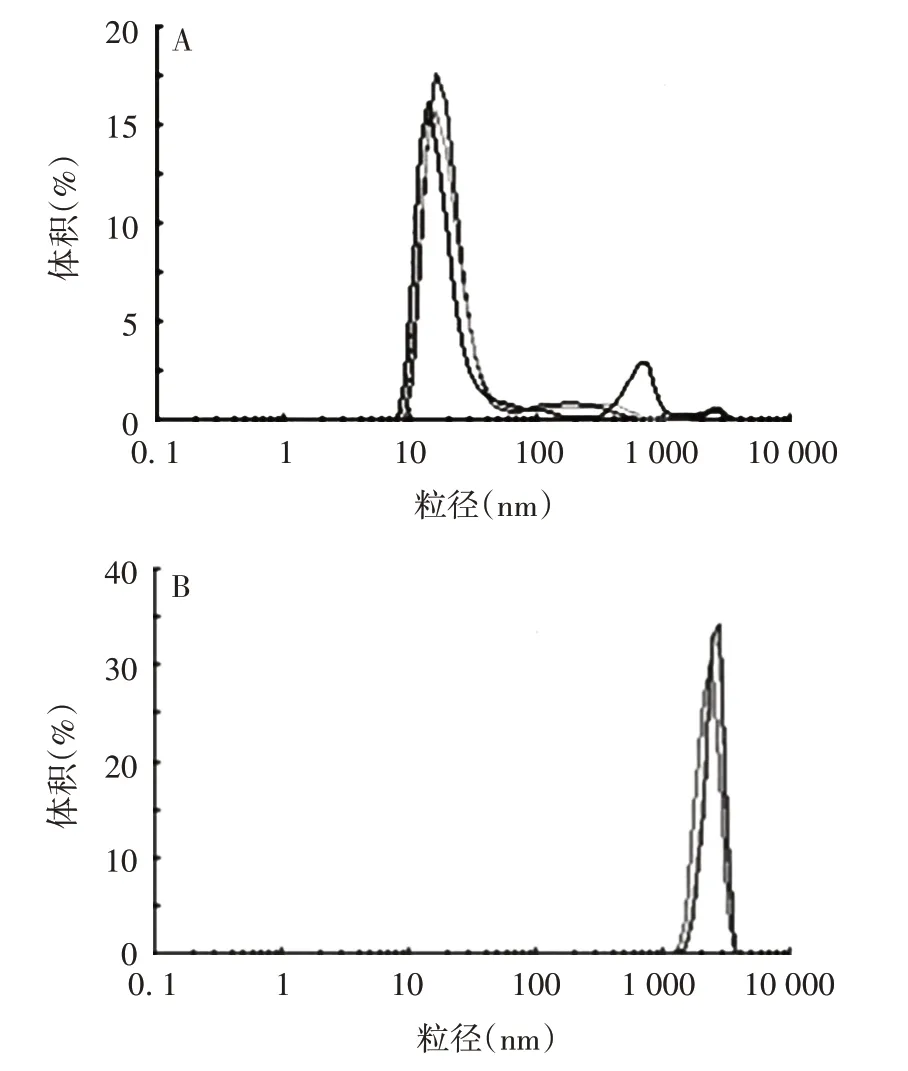
图3 灭活EV71(A)及氢氧化铝佐剂(B)的DSL分析Fig.3 DSL analysis of inactivated EV71 virus(A)and aluminum hydroxide adjuvant(B)
2.2 吸附能力考察
2.2.1 单剂量疫苗铝佐剂完全吸附最高抗原量 ≤11 000 U/mL浓度的灭活EV71抗原于室温孵育30 min条件下可被0.35 mg/mL(按铝含量计)氢氧化铝佐剂完全吸附,上清中未检出游离抗原;从12 000 U/mL起,随抗原量的增加,上清中未吸附的游离抗原含量也增加,见图4(2019-04-S 批为例),3 批氢氧化铝佐剂制备的供试品检测结果相同。表明单剂量疫苗的氢氧化铝佐剂(0.175 mg铝含量)可完全吸附5 500 U的灭活EV71 抗原,证明疫苗的半成品制备工艺稳定,可确保所用铝佐剂能够有效、完全吸附产品中全部EV71抗原。

图4 氢氧化铝佐剂对灭活EV71的吸附能力Fig.4 Adsorption capability of aluminum hydroxide adjuvant with inactivated EV71 virus
2.2.2 完全吸附单剂量疫苗抗原所需的氢氧化铝佐剂最低量 含量为0.35、0.25、0.17、0.085 mg/mL(按铝含量计)的氢氧化铝佐剂能完全吸附250 U/mL的灭活EV71抗原,上清中未检出游离抗原,3批氢氧化铝佐剂制备的供试品检测结果相同。表明4 个浓度的氢氧化铝佐剂均能完全吸附单剂量疫苗的抗原(125 U)。
2.2.3 吸附动力学 经不同时间(0、30 及120 min)孵育后,含量为0.35、0.25、0.17、0.085 mg/mL(按铝含量计)的氢氧化铝佐剂能完全吸附250 U/mL的灭活EV71抗原,上清中未检出游离抗原,3批氢氧化铝佐剂制备的供试品检测结果相同。表明不同含量的氢氧化铝佐剂可立即(吸附0 min)完全吸附单剂量疫苗125 U 的灭活EV71 抗原。灭活EV71 吸附前抗原浓度为(271.7±3.930)U/mL,0.35、0.25、0.17、0.085 mg/mL(按铝含量计)氢氧化铝佐剂制备的供试品解离后的抗原含量分别为(260.7±5.364),(264.0±4.509),(262.0±2.646)及(261.0±4.619)U/mL,吸附前及解离后的抗原含量差异较小,进一步证明抗原被佐剂完全吸附。
2.3 离子强度及P/Al对灭活EV71抗原吸附的影响
2.3.1 离子强度 ELISA 法检测EV71抗原含量的标准曲线见图5。标准方程为Y=0.030 79X+0.054 57,R2=0.980 0。随着NaCl浓度的增加,上清中并未检出游离抗原,氢氧化铝佐剂对EV71 病毒颗粒的吸附率保持在100%,表明在单剂量疫苗氢氧化铝含量(0.35 mg/mL,按铝含量计)及灭活EV71 抗原含量(250 U/mL)条件下,NaCl 离子强度对灭活EV71 吸附无影响。

图5 ELISA法检测EV71抗原含量的标准曲线Fig.5 Standard curve of ELISA for detecting EV71 antigen content
2.3.2 P/Al 随着P/Al(0.15、0.64、2.08及7.87)的增加,在氢氧化铝佐剂制备的供试品上清中可检测到游离EV71 抗原,且含量逐渐增加,铝佐剂对灭活EV71 抗原的吸附率逐渐下降,分别为97.04%、96.40%、94.56%和89.20%。表明在EV71颗粒与氢氧化铝佐剂的吸附作用中,基团置换发挥重要作用。
3 讨论
随着EV71 疫苗的应用,该病毒引起的HFMD 得到了有效控制。目前,针对引起HFMD 的其他肠道病毒疫苗的研发进展迅速[22-24]。本研究以多批氢氧化铝佐剂及1 批灭活EV71 原液为研究对象,按生产条件配制半成品,一方面用于探讨氢氧化铝佐剂对灭活EV71 抗原的吸附特性,另一方面,也对该半成品的生产工艺进行验证。结果表明,该生产工艺稳定可靠,具有较好的稳定性和可控性。
抗原结构、氢氧化铝佐剂形态及粒径分布对两者之间的吸附及疫苗的免疫刺激能力具有重要影响[10,25]。透射电镜和粒径分析结果显示,多批铝佐剂均具有较好的纳米形态及均一性;灭活病毒抗原也可见良好的病毒颗粒形态,进一步的SEC-HPLC分析未发现颗粒解聚或聚合现象,从而排除非颗粒抗原对本实验结论的影响,确保吸附后疫苗产品的免疫效力。粒径分析仪检测的灭活病毒抗原及铝佐剂颗粒大小与电镜结果略有差异,这是由DSL 分析的原理导致的,其结果目前只能作为参考。本研究的目的是反映纳米颗粒大小的分散性及均一性,电镜观察的粒径结果更为直观及可信。中国医学科学院医学生物学研究所制备的EV71 疫苗单剂量为0.5 mL,铝佐剂铝含量为0.35 mg/mL,本实验主要基于此浓度,考察铝佐剂对灭活EV71抗原的吸附能力。吸附试验结果表明,疫苗配方中的铝佐剂含量能够充分确保单剂量疫苗抗原被完全吸附。尽管采用低至0.042 5 mg 铝含量的铝佐剂即可吸附125 U的疫苗剂量抗原,但铝佐剂的作用除了吸附抗原,还有一定免疫辅助效果,有效的免疫反应同样需要一定量的铝佐剂。因此,疫苗采用0.175 mg铝含量的铝佐剂是合理的。研究结果还提示,必要时可经完善的免疫原性评价及临床试验研究,在确保产品免疫原性的基础上,适当降低EV71灭活疫苗中的铝佐剂用量。由于灭活病毒抗原是以高度规律化装配的多拷贝抗原呈现,其免疫原性远超过单体亚单位蛋白,其单剂疫苗所需抗原量较低,且铝佐剂是以一个病毒颗粒单位吸附,其吸附特点与游离的亚单位蛋白抗原不同。
在铝佐剂吸附抗原的作用力评价中,静电吸引是最常见的吸附力;疏水作用需要分子疏水基团的暴露,在一般正确折叠的蛋白中,疏水基团内掩,而表面更趋于亲水特征,因此,疏水作用介导的铝佐剂吸附较弱;基团置换是Al(OH)3表面的羟基被抗原表面的磷酸基团(PO43-)所取代,这种吸附力在铝佐剂吸附机制中最强。本研究发现,在不同离子强度作用下,上清中的抗原并未明显增加,一方面提示静电引力可能不是主要的吸附作用力;另一方面,不能排除铝佐剂吸附能力远超病毒颗粒抗原量。因此,即使吸附力有所降低,但抗原仍被铝佐剂以相同或不同的机制所吸附。该结论在考察最大完全吸附力的试验中也有所体现,5 500 U抗原在30 min被0.175 mg铝含量的氢氧化铝佐剂完全吸附,上清中未检测到游离抗原,而即使增加至15 000 U,检测到的游离抗原虽然增加,但实际绝大部分仍被铝佐剂所吸附。与NaCl 不同,在PO43-升高的情况下,上清中的游离抗原检出量随之增加,原因可能是佐剂与抗原间的基团置换受到破坏,提示基团置换发挥了重要作用。本研究为了解铝佐剂吸附病毒颗粒的特性及EV71灭活病毒疫苗的质量控制提供了参考。
