广东紫珠标准汤剂制备及质量评价
2023-06-27向燕芬邓桂珠甘国兴卢泳龙国斌朱卫星
向燕芬 邓桂珠 甘国兴 卢泳 龙国斌 朱卫星
【摘 要】 目的:制备广东紫珠标准汤剂并评价其质量。方法:收集10批广东紫珠药材制备标准汤剂,测定标准汤剂的pH和出膏率,建立标准汤剂的指纹图谱并采用化学计量学方法进行评价。结果:10批广东紫珠标准汤剂的pH为4.4~5.3,出膏率为11.9%~26.1% ,指纹图谱有10个共有峰,且10批广东紫珠标准汤剂指纹图谱与对照指纹图谱的相似度均大于0.90。结论:制备的广东紫珠标准汤剂具有一定的代表性,建立的指纹图谱方法可行。
【关键词】 广东紫珠;标准汤剂;指纹图谱
【中图分类号】R284.1 【文献标志码】 A 【文章编号】1007-8517(2023)02-0024-05
Preparation and Quality Evaluation of Standard Decoction of Callicarpa Kwangtungensis
XIANG Yanfen1,2 DENG Guizhu1,2 GAN Guoxing1,2* LU Yong1,2 LONG Guobin1,2 ZHU Weixing1,2
1.Qingyuan Hospital of Traditional Chinese Medicine,Qingyuan 511500,China;
2.Engineering Technology Research Center of Fresh Medicine and National Medicine
of Guangdong Province, Qingyuan 511500,China
Abstract:Objective To prepare standard decoction of Callicarpa kwangtungensis and evaluate its quality.Method 10 batches of Callicarpa kwangtungensis were collected and prepared for standard decoctions.The pH and extraction rate were determined.The standard decoction fingerprint was established with HPLC and evaluated with chemo-metrics method. Result The pH in 10 batches of Callicarpa kwangtungensis standard decoction were from 4.4 to 5.3,the extraction rates were from 11.9% to 26.1%.10 peaks were identified in the HPLC fingerprint,and the similarity was higher than 0.90 between the fingerprints of 10 batches of standard decoction and the control finger-print.Conclusion The Callicarpa kwangtungensis standard decoction was represent-ative,and the fingerprint method was feasible.
Keywords:Callicarpa Kwangtungensis;Standard Decoction; Fingerprint
廣东紫珠是马鞭草科植物广东紫珠Callicarpa kwangtungensis Chun.的干燥茎枝和叶,具有收敛止血、散瘀、清热解毒的功效[1]。目前有关于广东紫珠化学成分、药理作用、质量标准等方面的研究报道[2-7],但是没有关于广东紫珠标准汤剂的研究报道。本研究制备广东紫珠标准汤剂并评价其质量,为广东紫珠不同的饮片用药形式之间剂量换算提供参考,提高临床用药的准确性和疗效的一致性。
1 材料
1.1 仪器设备 e2695高效液相色谱仪(美国沃特世公司),XS205型电子分析天平(瑞士梅特勒-托利多公司),FE28型pH计(上海梅特勒-托利多仪器有限公司), RE-2000A旋转蒸发仪(上海亚荣生化仪器厂),电热恒温鼓风干燥箱(上海精宏实验设备有限公司),等。
1.2 试剂与药材 连翘酯苷B对照品(成都曼斯特生物科技有限公司,纯度98.46%,批号:MUST-20111105),色谱纯磷酸为上海麦克林生化科技有限公司产品;色谱纯乙腈及分析纯甲醇均为广州化学试剂厂产品;超纯水(广州屈臣氏食品饮料有限公司);广东紫珠药材在集贸市场收集。
2 方法与结果
2.1 广东紫珠标准汤剂制备 收集10批广东紫珠药材,参考《中药饮片标准汤剂研究策略》[8]的方法,分别称取广东紫珠药材100 g,置于3000 mL圆底烧瓶中,加入10倍量水,浸泡30 min,加热回流提取30 min,趁热用200目筛过滤,药渣加8倍量水,加热回流提取20 min,趁热用200目筛过滤,合并2次滤液,旋转蒸发仪60 ℃减压浓缩至500 mL,即得0.2 g·mL-1的广东紫珠标准汤剂。
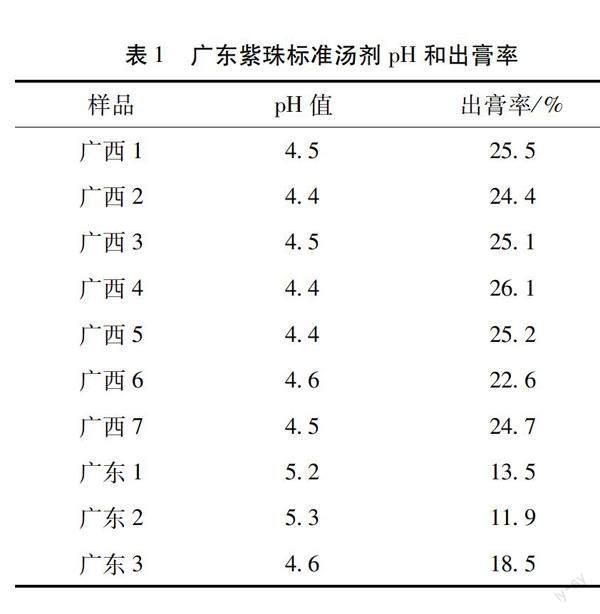
2.2 广东紫珠标准汤剂pH测定 采用pH计测定10批广东紫珠标准汤剂的pH,重复3次,取平均值为广东紫珠标准汤剂的pH。10批广东紫珠标准汤剂的pH为4.4~5.3,平均pH为4.6。结果见表1。
2.3 广东紫珠标准汤剂出膏率 精密量取广东紫珠标准汤剂25 mL,置于已干燥至恒重的蒸发皿中,水浴蒸干,置于电热鼓风干燥箱中105 ℃干燥3 h,移至干燥器中,冷却30 min,迅速称定重量,计算广东紫珠标准汤剂的出膏率,重复3次,取平均值为广东紫珠标准汤剂的出膏率。10批广东紫珠标准汤剂的出膏率为11.9%~26.1%,平均出膏率为21.8%。结果见表1。
2.4 广东紫珠标准汤剂指纹图谱建立及评价
2.4.1 色谱条件 Phenomenex Gemini C18色谱柱(4.6 mm×250 mm,5 μm);乙腈为流动相A,0.1%磷酸溶液为流动相B,梯度洗脱,0~35 min,5%A,95%B;35~40 min,5%~9%A,95%~91%B;40~55 min,9%~10%A,91%~90%B;55~80 min,10%A,90%B;80~81 min,10%~11A,90%~89%B;81~91 min,11%A,89%B;91~92 min,11%~10%A,89%~90B;92~130 min,10%A,90 %B;130~131 min,10%~12%A,90 %~88%B;131~151 min,12%~13%A,88 %~87%B;151~175 min,13%~14%A,87 %~86%B;柱温25 ℃,流速1.0 mL·min-1,检测波长332 nm,进样量5 μL。
2.4.2 对照品溶液制备 取连翘酯苷B对照品适量,精密称定,加50%甲醇制成浓度54.153 μg·mL-1,过0.45 μm的微孔滤膜,进样量5 μL。
2.4.3 供试品溶液制备 取标准汤剂10 mL,置具塞锥形瓶中,精密加入50%甲醇20 mL,称定重量,超声30 min,放冷,再称定重量,用50%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。
2.4.4 精密度试验 取同一供试品溶液,按2.4.1项下色谱条件连续进样6次,记录色谱图,结果各色谱峰相对保留时间的RSD均<1.0%,相对峰面积的RSD均<4.5%,表明仪器具有良好的精密度。
2.4.5 稳定性试验 取同一供试品溶液,按2.4.1项下色谱条件分别在0 h、4 h、8 h、12 h、20 h、24 h测定,记录色谱图,结果表明各色谱峰相对保留时间的RSD均<1.0%,相对峰面积的RSD均<4.5%,表明供试品溶液在24 h内稳定。
2.4.6 重复性试验 取同一标准汤剂样品6份,按2.4.3项下方法制备供试品溶液,2.4.1项下色谱条件测定,结果各色谱峰相保留时间的RSD均<1.1%,相对峰面积的RSD均<4.8%,表明该方法的重复性良好。
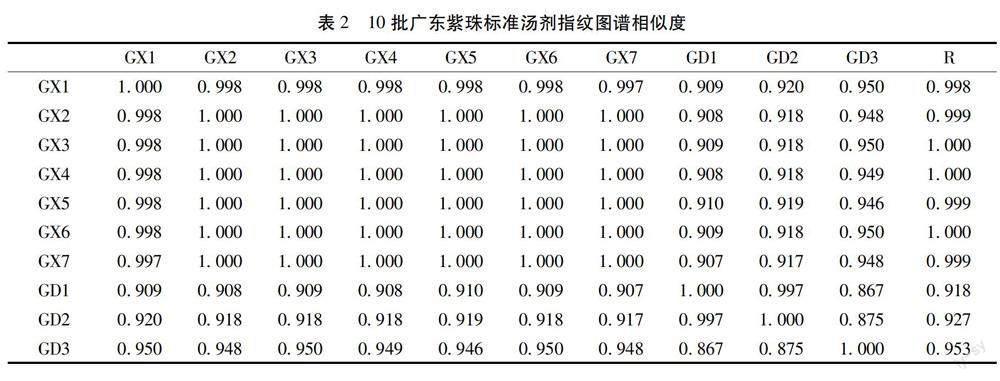
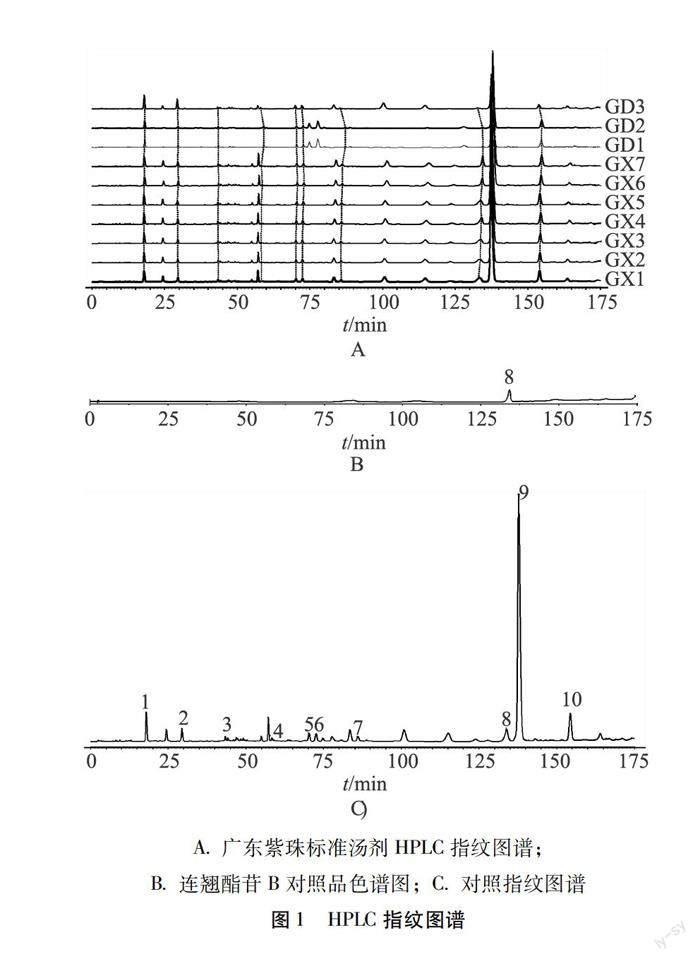
2.4.7 指纹图谱分析 将10批广东紫珠标准汤剂供试品按2.4.1项下色谱条件进样,记录色谱图。利用“中药色谱指纹图谱相似度评价系统软件”(2012版),采用中位数法和多点矫正法,时间宽度0.9 min,生成相应的对照指纹图谱1,其中共有峰10个,通过对照品指认出8号峰为连翘酯苷B。相似度分析结果表明,10批广东紫珠标准汤剂与对照指纹图谱相似度均大于0.90,符合標准汤剂指纹图谱相似度要求(大于0.90)。结果见表2,如图1。
2.4.8 指纹图谱聚类分析(HCA) 采用 SPSS 26.0 数据分析软件,对10批广东紫珠标准汤剂共有峰的相对峰面积进行系统聚类,采用组间联接法,测量区间为欧氏距离,聚类结果见图2,10批广东紫珠标准汤剂可分为2类,GX1、GX2、GX3、GX4、GX5、GX6、GX7为第1类,GD1、GD2、GD3为第2类。
2.4.9 主成分分析(PCA) 选择10批广东紫珠标准汤剂的10个共有峰的峰面积为变量,导入 SIMCA-P+12.0软件进行 PCA 处理,得分矩阵图见图3。结果发现 10 批样品聚为2组,GX1、GX2、GX3、GX4、GX5、GX6、GX7为一组,GD1、GD2、 GD3为第2组,与 HCA 结果一致。
2.4.10 正交偏最小二乘法判别分析 (OPLS-DA) 将10批广东紫珠标准汤剂的10个共有峰的峰面积导入 SIMCA-P+12.0软件进行OPLS-DA处理,得分矩阵图如图4。结果发现 10 批样品聚为2组,GX1、GX2、GX3、GX4、GX5、GX6、GX7为一组,GD1、GD2、 GD3为第2组,且与 PCA 和 HCA 结果一致。图5中的点离原点越远,表明对应变量(色谱峰)权重值越大,结合以变量重要性投影(VIP)值>1 为判定标准,筛选差异组分,如图6。结果共找到1个已知成分连翘酯苷B。
3 讨论
3.1 标准汤剂制备 《中药饮片标准汤剂研究策略》中要求药材样品需具有代表性,收集的药材样品应不少于10批,尽可能包括不同产区的药材样品。本研究收集广东紫珠药材10批,其中广西产7批、广东产3批,未能收集到湖南和江西产的药材样品。《中药饮片标准汤剂研究策略》中要求采用加热回流提取和减压浓缩的方法制备标注汤剂。因此,根据广东紫珠药材的特点,选择浸泡时间为30 min,采用加热回流提取,第一次加10倍量水,提取30 min,第二次加8倍量水,提取20 min,合并滤液后减压浓缩制备标准汤剂。
3.2 标准汤剂质量评价 《中药饮片标准汤剂研究策略》中要求以pH、出膏率范围、成分转移率范围、指纹图谱或特征图谱等指标评价标准汤剂质量。本研究中,10批广东紫珠标准汤剂的pH为4.4~5.3,平均pH为4.6,符合《中药配方颗粒质量控制与标准制定技术要求》中各批次值在均值加减3倍SD范围的要求;出膏率为11.9%~26.1%,平均出膏率为21.8%,广东产的出膏率均低于广西的;各批次标准汤剂指纹图谱与对照指纹图谱的相似度均大于0.90,符合《中药饮片标准汤剂研究策略》中相似度不低于0.90的要求。由于在药店和医疗机构无法买到广东紫珠饮片,本研究所用广东紫珠的种植时间和存放时间均无法确定,其指标成分含量可能存在较大差异,所得成分转移率范围没有指导意义,因此本研究未测定广东紫珠中连翘酯苷B和金石蚕苷的含量,计算其成分转移率。
3.3 指纹图谱条件选择 本研究根据2020年版中国药典第一部,考察了265 nm、254 nm和332 nm 3个检测波长,发现以332 nm为波长,色谱峰数量较多,面积较大,色谱图基线最佳。在332 nm检测波长下,分别考察了甲醇-0.05%甲酸水、甲醇-0.1%磷酸水、乙腈-0.05%甲酸水、乙腈-0.1%磷酸水等流动相的色谱图情况。甲醇-0.05%甲酸水、甲醇-0.1%磷酸水为流动相,色谱图峰数量较少,峰形较差,基线较差,色谱峰分离度较差。乙腈-0.05%甲酸水为流动相,色谱图峰形较好,但峰面积较大的色谱峰分离度较差。乙腈-0.1%磷酸水为流动相,色谱图基线平稳,色谱峰数量较多,色谱峰分离度较好,故选择乙腈-0.1%磷酸水为广东紫珠标准汤剂指纹图谱的流动相。
本研究参考《中药饮片标准汤剂研究策略》的要求制备了10批广东紫珠药材标准汤剂,并以pH、出膏率、指纹图谱等为指标进行评价。但是由于在药店和医疗机构无法买到广东紫珠饮片,本研究收集的广东紫珠产地较少,也没有测定广东紫珠指标性成分连翘酯苷B和金石蚕苷的含量,计算化学成分转移率,存在一定的不足。今后如果能收集到合适的广东紫珠饮片,将进一步补充完善相关研究,使结果更加科学合理。
参考文献
[1]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2020:200.
[2]毕红玉,付辉政,王栋,等.广东紫珠茎枝和叶乙酸乙酯部位的化学成分[J].中药材,2021(10):2345-2349.
[3]黄逸敏,袁欢,陈萍,等.广东紫珠中的萜类化合物及其抗炎活性[J].天然产物研究与开发,2022,34(1):50-56.
[4]汪冶,郑钦方,肖聪颖,等.广东紫珠药材标准研究[J].中南民族大学学报(自然科学版),2019,38(4):562-565.
[5]杨智颖,袁欢,周莹,等.广东紫珠中的苯丙素类化合物及其抗菌活性[J].天然产物研究与开发,2019,31(11):1928-1933.
[6]郑钦方,丁野,肖聪颖,等.不同产地广东紫珠的连翘酯苷B和金石蚕苷含量测定及指纹图谱[J].中国医药工业杂志,2018,49(4):469-473.
[7]聂韡,朱培林,房海灵,等.HPLC指纹图谱结合化学计量学评价不同产地广东紫珠药材的质量[J].中草药,2017,48(1):185-191.
[8]陈士林,刘安,李琦,等.中药饮片标准汤剂研究策略[J].中国中药杂志,2016,41(8):1367.
(收稿日期:2022-05-25 编辑:刘 斌)
