药物纳米晶的制备及其口服转运机制研究进展
2023-06-26吴帅聪秦超韩晓鹏尹莉芳
吴帅聪, 秦超, 韩晓鹏, 尹莉芳
(中国药科大学药学院, 江苏 南京 211198)
随着计算机辅助药物设计技术的发展,新药研发在缩短研发周期、节约研发成本、提高药物设计命中率等方面取得了重大成果。然而目前研发的药物化合物中约70%以上存在相对分子质量较大、水溶性较差等问题[1-2]。现阶段有多种技术可改善难溶性药物的溶解度,比如药物微粉化、环糊精包合技术、制备固体分散体、制备纳米乳剂、药物纳米晶化等[3-5]。其中,纳米晶技术可显著降低难溶性药物粒径从而提高其饱和溶解度及溶出速率,口服给药后使其生物利用度提高数十倍,展现出巨大的优势[6]。由于人体胃肠道环境复杂,研究纳米晶口服给药后体内转运过程常需借助相关的体外细胞培养模型,且目前尚不清楚纳米晶是以晶体态还是游离态形式跨肠道上皮细胞转运[7],因此研究纳米晶跨膜转运机制对纳米晶剂型设计具有指导意义。本文系统地介绍了药物纳米晶的制备工艺、体外细胞培养模型以及影响其转运吸收的相关因素,以期帮助研究人员从分子水平上解读纳米晶体内转运过程以及指导难溶性药物纳米晶剂型的设计。
1 纳米晶简介
药物纳米晶是指选取适宜稳定剂制备的胶体药物微粒分散体系,除稳定剂外无其他药用载体,尺寸通常小于1 000 nm[8]。药物纳米晶通常以纳米混悬液的形式制备,并通过旋蒸或离心的方法除去有机溶剂,冷冻干燥后得到可重新分散的药物微粒[9]。与制备药物分子前药、环糊精包合物、固体分散体以及固体脂质纳米粒等工艺相比,药物纳米晶化可获得较高的载药量和口服生物利用度,且易于工业化生产。目前多种纳米晶药物被批准上市,部分上市产品如表1 所示。
2 制备工艺及表征
制备药物纳米晶的基本方法有2 种:Top-down法(粉碎法)和Bottom-up 法(纳米沉淀法)。Top-down 法是指通过物理方法粉碎药物粗颗粒从而得到纳米级的微粒,主要手段为高压均质(high pressure homogenization,HPH)和湿法介质研磨;Bottom-up 法的主要手段为反溶剂法,即通过超声等物理方法制备适宜粒径大小的微粒。上述2 种制备方法也可联合应用。此外,研究表明药物纳米晶的理化性质对其稳定性有显著影响,目前有多种技术可表征药物纳米晶,其中最基本的表征为粒径分布、Zeta 电位测定、形态学表征和晶型研究等。
2.1 制备工艺
2.1.1 Top-down 法该方法通过施加较高的物理机械能粉碎药物颗粒制备纳米晶,主要包括HPH 以及湿法介质研磨技术[12]。HPH 技术又可细分为活塞间隙型和微流化型。活塞间隙型原理是将药物分散在含有稳定剂的溶液中并通过高压迫使药物混悬液通过微小的空隙来降低药物粒径;微流化型原理是指利用2 组高压气体流碰撞药物颗粒从而降低其粒径。第2 代HPH 技术(Nanopure®技术)采用非水溶剂全部或部分替换水性溶剂制备药物纳米晶,避免了部分药物在水溶液中易降解的缺陷,如采用甘油-水体系制备满足静脉注射等渗要求的纳米混悬液。湿法介质研磨主要将药物分散于含有稳定剂的水相中得到粗混悬液,之后将其加入研磨机中,依靠研磨珠剪切摩擦从而降低药物粒径。该制备方法通常要求药物质量分数在2% ~ 30%以内,且研磨珠的材质、数量、尺寸、碰撞速度以及研磨时间等参数均会影响纳米晶的粒径和稳定性[13]。相较于Bottom-up 方法,Top-down 法的优点是适用范围广、不含有机溶剂、制备方法灵活、批间差异小且可进行大批量生产。但该方法操作烦琐,并不适用于静脉注射药物,故其应用受到一定限制[14]。目前大部分被批准上市的口服药物纳米晶采用了湿法介质研磨的制备工艺,如Tricor®和Avinza®等药品[15-16]。
2.1.2 Bottom-up 法该方法常被称作反溶剂法,是目前实验室制备药物纳米晶的常用手段。其主要过程如下:首先将药物溶解于有机溶剂中作为有机相,将稳定剂溶于蒸馏水中作为水相,然后在磁力搅拌的条件下将有机相缓缓注入水相中使药物结晶析出,探头超声制备纳米微粒[17]。为了获得稳定的药物纳米晶,除了选择合适的稳定剂外还要筛选投药量、有机相与水相的体积比、药物与稳定剂的质量比、超声功率以及时间等参数。但该方法存在难以控制晶核形成的过程、选择合适的有机溶剂与稳定剂相对困难且有残留有机溶剂的缺点,因此不易实现工业化生产。目前应用超临界流体(supercritical fluid,SCF)技术可以弥补残留有机溶剂带来的缺陷,其具体操作是将药物先溶于超临界液体中,然后通过微小空隙雾化干燥,超临界液体因受热气化从而使得药物晶体析出[18]。此法避免了有机溶剂的使用,但喷雾干燥会导致药物颗粒粘连,无法制备稳定的纳米晶。
2.1.3 组合方法组合方法是指将Top-down 与Bottomup 方法联合起来,利用其各自优点制备易于工业化生产的药物纳米晶[19]。组合技术避免了反溶剂法中晶核增长以及湿法研磨过程中研磨时间过长的问题。美国百特(Baxter)公司申请了一项叫做NanoEdgeTM的组合方法专利,该联用技术先通过反溶剂法制备药物纳米晶,而后通过HPH 进一步降低药物粒径,提高其物理稳定性[20]。
2.2 药物纳米晶的表征
药物纳米晶的粒径及其表面电荷影响了纳米晶的理化性质,纳米晶的粒径大小是最关键的物理参数。一般使用动态光散射技术(dynamic light scattering,DLS)测定粒径,同时利用多分散指数(polydispersity index,PDI)评估粒径分布的均一性,PDI 的值越小说明粒径分布越均匀。粒子的表面电荷可通过测定其Zeta 电位表征。X 射线衍射(X-ray diffraction,XRD)技术通常用来评估药物晶体结构是否发生变化;纳米晶从定形到无定形或多晶型的转变往往通过差示热量扫描分析(differential scanning calorimetry,DSC)测定。纳米晶的形状、粒径以及形态通过扫描电子显微镜(scanning electron microscope,SEM)或透射电子显微镜(transmission electron microscope,TEM)评估。SEM 表征纳米晶形态需先将纳米混悬液冻干,并使用冻干保护剂(如甘露醇)防止冻干过程中药物微粒聚集。药物纳米晶的相变过程采用拉曼光谱技术表征,此外该技术也可用于药物辅料相容性研究、纳米晶表面改性研究以及定量分析等。药物纳米晶化学性质的改变以及与辅料间的相互作用还可以通过傅里叶变换红外光谱仪(Fourier transform infrared,FT-IR)技术测定[21-23]。
3 药物纳米晶的口服吸收研究
3.1 纳米晶的口服递送概述
药物纳米晶有多种给药途径,如透皮给药、静脉注射、肺部吸入、眼部递送和口服给药等[24]。其中口服给药是临床治疗的首选方案。大量研究表明药物纳米晶口服递送可以显著提高难溶性药物的口服生物利用度。Nimotop®(尼莫地平片)由美国拜耳公司研发,该药因绝对生物利用度(约13%)较低,患者必须每4 h 服用2 片(规格:30 mg),极大地降低了患者的依从性。Fu 等[25]通过HPH 的方法制备了粒径为833.3 nm 的尼莫地平纳米晶,经口给药后,与原研制剂相比其生物利用度显著提高,出现该结果的原因为部分纳米晶通过M 细胞转运至肠系淋巴膜吸收从而避免了肝脏首过效应。Chen 等[26]采用反溶剂组合微流化的方法制备了贝沙罗汀纳米晶,与对照组相比,纳米晶的体外溶出速率显著提高,大鼠药动学实验研究表明,贝沙罗汀纳米晶显著提高了口服生物利用度并降低了药物的毒性和副作用。Sarnes 等[27]制备了伊曲康唑纳米晶口服片剂,通过湿法介质研磨制备伊曲康唑纳米混悬液后,冷冻干燥并制备片剂。相较于市售制剂Sporanox®,伊曲康唑纳米晶显示出更高的溶出速率,但大鼠药动学研究表明,与市售产品相比,纳米晶的口服生物利用度并未显著提高,且其体内转运机制尚未阐明。
3.2 体外转运研究细胞模型的建立
借助相关的体外细胞培养模型可以从细胞水平深入分析药物纳米晶的转运机制。基于Transwell 培养小室的体系是研究药物转运途径的经典方法。该小室由10 μm 的聚碳酸酯或聚酯膜将其分隔为上室和基底室,分别对应于肠腔黏膜以及黏膜下层。基于Transwell 小室的细胞培养模型包括单一的细胞培养模型、共培养细胞模型、三重细胞培养模型和3D细胞培养模型等。
3.2.1 单一的细胞培养模型人克隆结肠腺癌细胞(Caco-2 细胞)为最经典的模型。Caco-2 细胞模型可以表达多种肠道上皮细胞代谢酶,常用于测定药物渗透性及其转运机制的研究。通常将Caco-2细胞以1×105cells · cm-2的密度接种于12 孔的Transwell 板上培养约21 天,隔天测量跨膜电阻值(transepithelial electrical resistanc,TEER)来监测细胞的生长状态,顶端微绒毛以及紧密连接的形成是判断该模型是否培养成功的标志。但因培养周期较长、缺少黏液层、P-糖蛋白(P-glycoprotein,P-gp)表达过高等缺点,其应用受到了限制[28]。犬肾脏上皮细胞(MDCK 细胞)模型也被用于纳米晶跨膜机制的研究,其具有跨膜电阻值与小肠上皮细胞相近、培养周期较短等优点,但因其为非人源性细胞且缺少相关的内吞作用途径,其应用也受到限制[29]。单一的细胞培养模型无法准确研究药物纳米晶的转运机制,通常采用细胞共培养模型具体研究其转运机制。
3.2.2 共培养细胞模型人结肠癌细胞(HT29 细胞)在含有甲氨蝶呤(methotrexate,MTX)的培养基中可以分化为分泌黏液的杯状细胞,但因其生长缓慢且不表达P-gp,通常将HT29 细胞与Caco-2 细胞以1 : 9或3 : 7 的比例建立共培养细胞模型,研究药物纳米晶的跨膜转运机制[30-31]。该共培养细胞模型具有黏液层,且紧密连接更加松散,通透性更加接近人体胃肠道细胞,因此常被用于研究药物纳米晶与黏膜之间的相互作用。该模型的不足之处是黏液层覆盖不均匀,导致共培养模型中出现无黏液层覆盖的Caco-2 细胞。
3.2.3 三重细胞培养模型有研究表明建立Caco-2/HT29-MTX/Raji-B 细胞共培养模型可以精确模拟人体胃肠道细胞[32]。Raji-B 细胞为人Burkitt,s 淋巴瘤细胞,其可诱导部分Caco-2 细胞分化为M 细胞,M 细胞是抗原采集样细胞,可以介导药物微粒、细菌和生物大分子等的转运,常被视作口服纳米粒的重要转运通路。将HT29-MTX 和Caco-2 细胞以1 : 9或3 : 7 的比例接种于Transwell 上室,培养至14 天后,向下室加入Raji-B 细胞可以诱导上室的Caco-2 细胞分化为M 细胞。由于M 细胞的TEER 小于Caco-2细胞,所以通过检测TEER 可以判断三重细胞培养模型是否成功建立。当TEER 降低至200 ~ 250 Ω · cm2时可认为模型建立成功[32]。
3.2.4 3D 细胞培养模型与上述细胞模型相比,3D细胞培养模型可以精准模拟体内细胞存活的微环境,从而提供更加可靠的分子生物学信号,比如:提供代谢分析、肿瘤特征、细胞间相互作用机制和干细胞研究等。然而3D细胞培养技术因可操作性难度大、原代细胞容易丧失活性、培养支架基质胶材料较为昂贵等因素,使得该模型培养技术开展受限、操作风险高且重现性较差[33]。随着3D 细胞培养模型技术的不断发展,相信在不久的将来,3D 细胞培养模型会成为研究体外细胞实验的主要手段。
3.3 影响药物纳米晶口服转运机制的因素
一般而言,影响药物纳米晶吸收机制的主要因素为:药物的饱和溶解度以及溶出速率、黏膜的吸附作用、药物在黏液层中的扩散、跨膜转运途径以及稳定剂种类等[34]。
3.3.1 饱和溶解度及溶出速率纳米晶技术可提高药物的饱和溶解度及溶出速率,在肠道上皮细胞处形成较高的药物浓度梯度,从而促使药物以游离或晶体形式跨膜转运。根据Ostwald-Freundlich 方程可知,药物粒径减小,药物的饱和溶解度增加;根据Noyes-Whitney 方程可知,药物饱和溶解度增加会导致其在胃肠道的溶出速率增加[35]。此外,通过改变纳米晶的粒径、晶型、形状等因素可以显著影响药物的饱和溶解度及溶出速率。因此纳米晶凭借较低的粒径以及较大的表面积显著提高了难溶性药物的口服生物利用度。Song 等[36]制备了美洛昔康纳米晶速溶舌下膜剂(meloxicam-nanocrystals-fast dissolving sublingual films,MLX-NS-FDSFs), 该纳米晶粒径为(196.4 ± 6.3)nm,极大地提高了美洛昔康的饱和溶解度和溶出速率;与美洛昔康粗混悬液相比,美洛昔康纳米晶的体外溶出速率显著提高;大鼠药动学实验表明,舌下给予MLX-NSFDSFs 后,与美洛昔康粗混悬液膜剂相比,达峰时间(Tmax)显著缩短且生物利用度提高了3.0 倍。Seto 等[37]采用反溶剂法制备了平均粒径为230 nm的叶黄素纳米晶,与叶黄素粗混悬液相比,其在水中的饱和溶解度显著提高;大鼠药动学研究表明,其相对生物利用度提高了15.2 倍。
3.3.2 黏膜吸附黏液层主要由高度糖基化的黏蛋白组成,在胃肠道中起到了保护和润滑的作用,其可以与药物颗粒之间相互作用形成致密的网状结构,而药物与黏液层之间的吸附以及黏液层的厚度对药物的口服吸收产生影响[38]。药物纳米晶通过静电吸引、氢键和范德华力等作用机制增强了纳米晶与黏膜之间的相互作用,从而延长了药物在胃肠道的保留时间。但较强的吸附作用使得部分药物纳米晶无法转运至肠道上皮细胞中,导致其口服生物利用度降低。与游离药物相比,纳米晶因其较小的粒径可以与黏液层之间形成储库,合适的稳定剂可以避免黏液粘连,从而提高药物在黏液层中的穿透能力。Soisuwan 等[39]分别使用泊洛沙姆407、泊洛沙姆407 和月桂基硫酸钠 (sodium lauryl sulfate,SLS)、泊洛沙姆407 和十六烷基三甲基溴化铵(hexadecyltrimethylammonium bromide,CTAB)作为稳定剂,制备了电中性、带负电荷以及带正电荷的克拉霉素纳米晶。通过Caco-2 细胞模型研究得知,与电中性和带负电荷的纳米晶相比,带正电荷的纳米晶具有更强的黏膜粘附力,且药物渗透量更高。分析其原因可能是黏膜层带负电,带正电荷的纳米晶与黏膜层通过静电吸引可产生更强的粘附力,进而提高了纳米晶的药物渗透量。Ueda 等[40]选择用羟丙甲纤维素(hydroxy propyl methyl cellulose,HPMC)作为稳定剂并采用湿法介质研磨技术制备非诺贝特纳米晶;研究发现HPMC 可以作用于黏蛋白而改善非诺贝特与黏液层之间的渗透性,从而促进药物在黏液层中的扩散;此外还发现当使用较低相对分子质量的HPMC 时会增加非诺贝特纳米晶柔韧性并抑制其与黏液层的相互作用。
3.3.3 跨膜转运途径近年来,药物纳米晶是否以完整的晶体形式跨膜转运成为研究的热点,图1 简述了目前常见的几种纳米晶跨膜转运途径。大量研究表明,内吞作用是纳米晶进入肠道上皮细胞的主要机制,纳米晶的体内转运途径复杂,内吞入胞后还可能伴有转胞吞、胞吐等过程。内吞作用的主要机制有网格蛋白介导、小窝蛋白介导、脂筏介导以及巨噬细胞介导[41]。此外,高尔基体、溶酶体、M 细胞以及内体等也参与了纳米晶胞内转运的过程。其中M 细胞介导的纳米晶转运过程至关重要。M 细胞位于派尔集合淋巴结(Peyer’s patch)表面的滤泡相关上皮(follicle-associated epithelial,FAE)中,M细胞在胃肠道中的含量极少(<1%),但M 细胞作为抗原采样细胞具有良好的转运功能,可以转运病毒、抗原、细菌以及各种药物微粒等。Shen 等[42]的研究表明,M 细胞可以识别并转运完整的杂化槲皮素纳米晶,并将其转运至肠系膜淋巴管中从而提高口服生物利用度;Ma 等[43]制备了表面由聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid),PLGA]修饰的纳米微球,包裹蛋白质口服递送,研究发现该纳米粒可被M 细胞识别并转运至淋巴吸收;根据Liu 等[44]的研究发现,完整的卡维地洛纳米晶可以通过M 细胞转运,避免了肝脏首过效应从而极大地改善了其口服生物利用度。
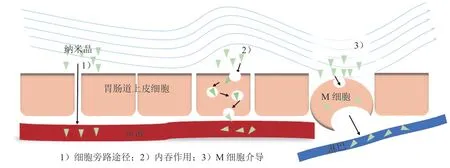
图1 药物纳米晶的转运途径概况Figure 1 Trans-epithelial pathways of drug nanocrystals
3.3.4 稳定剂的影响稳定剂的主要功能是防止药物微粒的聚集,提高药物纳米晶的稳定性。稳定剂的种类包括离子型[如:壳聚糖和SLS]和非离子型(如:HPMC 和F127)两大类。对于离子型稳定剂而言,维持稳定的主要机制为静电排斥;对于非离子型稳定剂而言,稳定剂可以在药物微粒之间形成保护膜,依靠空间位阻效应维持稳定。稳定剂还可以通过提高药物的饱和溶解度及溶出速率、增强药物与黏膜之间的粘附、打开细胞的紧密连接以及抑制P-gp 转运等方式促进纳米晶跨肠道转运。例如,Ullah 等[45]采用HPMC-聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)和HPMC-聚丙烯酸树脂(Eudragit,EUD)组合作为稳定剂,采用反溶剂法制备了难溶性药物右旋布洛芬(dexibuprofen,Dexi)纳米晶。实验结果表明:Dexi 原料药在水中和该稳定剂溶液中的饱和溶解度分别为(51.0±2.0)和(92.0±3.0)mg · L-1,而采用该稳定剂制备的Dexi 纳米晶的饱和溶解度显著增加至(270.0±3.5)mg · L-1;与Dexi原料药和上市片剂相比,Dexi 纳米晶的溶出速率也显著提高。又如,Shweta 等[46]开发了新型泊洛沙姆接枝壳聚糖(Pluronic -grafted- chitosan,Pl-g-CH)共聚物,并将其作为功能性稳定剂制备了紫杉醇纳米晶;体外Caco-2 单层细胞模型实验发现,与紫杉醇相比,用该稳定剂制备的紫杉醇纳米晶极大地提高了紫杉醇在Caco-2 细胞内的累积量,且TEER 值明显下降,后者表明该稳定剂能够打开细胞间的紧密连接,从而促进药物的细胞旁转运。再如,P-gp广泛存在于各种细胞表面,其主要功能是识别并转运外来异物,使机体免受有毒物质的侵害。紫杉醇是典型的难溶性药物,同时也是P-gp 的底物,通过选取具有P-gp 抑制作用(如Tween80)的稳定剂制备紫杉醇纳米晶可以较好地改善其口服生物利用度。据Sharma 等[47]报道,HPH 研磨制备的Tween80 紫杉醇纳米晶可以有效抑制紫杉醇的外排转运;大鼠药动学实验研究表明,其口服生物利用度较紫杉醇纳米晶提高了约12.5 倍。Du 等[48]以具有P-pg 抑制作用的维生素E 聚乙二醇琥珀酸酯作为稳定剂,湿法介质研磨制备的难溶性药物穿心莲内酯纳米晶也被证实抑制了药物的P-gp 外排转运;大鼠药动学实验结果发现,与对照组HPMC-E5 制备的穿心莲内酯纳米晶(E5-NCs)相比,其具有更高的达峰浓度(Cmax)及血药浓度-时间曲线下面积(AUC0-24h)。
4 总结与展望
药物纳米晶技术可以有效降低药物粒径,显著提高药物饱和溶解度以及溶出速率,从而促进其跨肠道上皮细胞转运。尽管通过Caco-2,HT29-MTX和MDCK 等单层细胞模型以及Caco-2/HT29-MTX和Caco-2/HT29-MTX/Raji-B 等多重细胞培养模型可以研究纳米晶口服给药后的体内转运过程,但仍无法定量考察药物纳米晶口服吸收时游离态和晶体态的比例。由于药物间理化性质存在差异,且药物纳米晶经胃肠道吸收入血过程复杂,根据胃肠道生理结构精准设计药物纳米晶剂型具有较大挑战。随着分子生物学的发展,相信在未来会有更加精准的细胞培养模型从分子水平上分析口服药物纳米晶的跨肠道转运机制。
