不同雌激素浓度对重组人骨形态发生蛋白2干预乳腺癌MCF-7细胞生长和迁移影响的体外研究
2023-06-26刘书中姚思远吴昀效
刘书中,姚思远△,吴昀效,刘 勇*
(1.中国医学科学院 北京协和医学院 北京协和医院 骨科,北京 100730;2.北京大学公共卫生学院,北京100191)
骨形态发生蛋白(Bone morphogenetic protein,BMP)是生长因子β超家族成员之一,迄今已经发现了30多种BMP,其中应用最为广泛的是骨形态发生蛋白2(BMP-2)[1-2]。自2002年,重组人骨形态发生蛋白-2(rhBMP-2)在美国已被广泛应用于骨不连、骨缺损、脊柱融合的手术治疗中且临床效果满意。但与此同时,rhBMP-2的临床应用是否会增加包括乳腺癌在内的多种恶性肿瘤的患病风险也引发了学界的关注[3]。此外,越来越多的研究证实了BMP通路在乳腺癌微钙化灶形成和上皮间质转化过程中的关键作用[4-5]。
BMP-2参与多种生物学过程,如组织分化、细胞增殖与凋亡、细胞功能调节等,并且在肿瘤的发生发展中亦扮演着重要角色[6-7]。有证据表明BMP-2异常表达与乳腺癌发生和进展密切相关,BMP相关通路在调节乳腺肿瘤细胞生物学功能方面以及调节肿瘤间质和骨转移微环境中发挥重要作用[8]。本团队前期研究已证实在体外条件下,以不同浓度的rhBMP-2处理细胞可显著抑制乳腺癌MCF-7细胞的增殖能力,并增加G1期细胞所占比例、促进p21表达、抑制cyclin E表达,并显著抑制PI3K/Akt信号通路的磷酸化过程[9]。在体内实验中rhBMP-2可减小瘤体体积,免疫组化检测显示rhBMP-2处理可显著降低瘤体组织中ki-67的表达水平[9]。
值得注意的是,乳腺癌的发生和发展过程与人体内环境中的雌激素水平密切相关[10-11]。Al Saleh等的研究表明沉默ERα可使体内雌二醇增加伴随BMP-2过表达,并与乳腺癌上皮-间质转化(EMT)过程相关[12]。Wang等研究发现BMP-2对MCF-7和MDA-MB-231细胞生长的抑制作用可被三苯氧胺拮抗,提示该作用与雌激素受体有关[13]。不同的雌激素水平很可能在体内、体外条件下对rhBMP-2干预乳腺癌细胞的生物学行为产生进一步的影响,干扰甚至可能会逆转rhBMP-2对乳腺癌细胞的生物学作用。目前尚缺乏不同浓度雌激素对上述过程影响的论证结果,本研究拟探究不同浓度雌激素对rhBMP-2干预乳腺癌MCF-7细胞增殖、迁移、侵袭以及细胞周期的影响。
1 材料和方法
1.1 材料
人乳腺癌MCT-7细胞(由中国医学科学院基础医学研究所提供)、rhBMP-2(Novoprotein,上海)、Noggin(PrimeGene,上海)、雌激素(17β-oestradiol)(BioGems,美国)。试验中使用的青霉素/链霉素溶液、胰蛋白酶、PBS缓冲液、MTT试剂、总RNA提取试剂盒、通用反转录试剂盒、实时定量PCR荧光定量试剂盒均购自索莱宝公司,无水乙醇(国药集团化学试剂有限公司),胎牛血清、RPMI 1640培养基及其他细胞培养试剂购自Gibco公司,Transwell嵌套、细胞培养板购自Corning公司,细胞周期检测试剂盒购自4A Biotech公司。
1.2 方法
1.2.1细胞培养 将人乳腺癌MCF-7细胞培养于含体积分数10%胎牛血清、100 U/mL青霉素、100 mg/L链霉素的RPMI 1640培养基中,所有细胞在体积分数5% CO2的37℃培养箱中常规培养,培养液每2 d或3 d更换1次,当细胞长至80%铺满时消化传代。
1.2.2细胞处理 MCF-7细胞按适当密度铺板(第二天达80%汇合度),第二天换无血清培养基培养24 h,然后加入BMP-2、雌激素或noggin处理24 h。BMP-2处理浓度为100 ng/ml;noggin处理浓度为100 ng/ml。
1.2.3细胞分组 根据处理MCF-7细胞的rhBMP-2、noggin以及不同雌激素浓度条件,将各处理组分为:(1)MCF-7细胞+rhBMP-2;(2)MCF-7细胞+rhBMP-2+雌激素10-9mol;(3)MCF-7细胞+rhBMP-2+雌激素10-8mol;(4)MCF-7细胞+rhBMP-2+雌激素10-7mol;(5)MCF-7细胞+rhBMP-2+雌激素10-6mol;(6)MCF-7细胞;(7)MCF-7细胞+noggin;(8)MCF-7细胞+rhBMP-2+noggin。
1.2.4MTT试验 消化对数生长期细胞,在96孔板中接种细胞悬液(100 μL/孔),将培养板放在培养箱中预培养一段时间(37℃,5% CO2),并按以上分组进行处理。向每孔加入10 μL MTT反应液,将培养板在培养箱内孵育4 h;吸走上清液,每孔加入100 μL的DMSO振荡10 min,酶标仪测定在490 nm处的吸光度。
1.2.5Transwell迁移试验与侵袭试验 首先细胞采用常规消化传代方法,制成细胞悬液,计数,调整浓度为2×105个/ml。将含10%血清的培养基加入培养板底部,上室加入200 μL细胞悬液,继续在孵箱培养24 h。4%多聚甲醛孔中进行固定。取出培养板,PBS清洗两次。100%甲醇室温固定20 min后移到预先加入约700 μL 2.5%结晶紫溶液中,室温染色15 min。PBS清洗、晾干后,使用荧光倒置显微镜完成细胞计数并拍照保存。
1.2.6流式细胞仪检测细胞周期 收集细胞,加入1 ml冰浴预冷的PBS重悬细胞。1 ml细胞悬液与95%乙醇混匀后4℃固定12 h,1000 rpm离心3 min,弃上清。加入5 ml 冰浴预冷的PBS重悬细胞,1000 rpm离心3 min,弃上清,配置PI染色液。染色:每管加入400 μl PI染色液,涡旋,避光30 min。上机检测(在激发波长488 nm波长处检测红色荧光)。
1.2.7qPCR试验 ①RNA提取:收集细胞沉淀,加入1 ml Trizol,室温放置5 min,使得核酸蛋白复合物完全分离。重复离心、去废液操作萃取RNA。②逆转录反应:在冰浴的无RNase的离心管中加入反应成分。70℃保温5 min后迅速在冰上冷却2 min。将离心管置25 ℃温浴10 min,42 ℃温浴60 min。再于95 ℃条件下加热。终止反应后用RNase Free ddH2O将反应体系稀释到200 μl,取5 μl作为PCR反应模板。③qPCR:根据合适条件配置反应体系,进行qPCR反应。以2-ΔΔCt法(Livak法)进行定量分析。
1.3 主要观察指标
①体外试验中不同雌激素浓度对rhBMP-2干预下乳腺癌MCF-7细胞增殖的影响及相关mRNA、蛋白的表达情况;②体外试验中不同雌激素浓度对rhBMP-2干预下乳腺癌MCF-7细胞迁移、侵袭和细胞周期的影响。
1.4 统计学方法
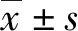
2 结果
2.1 不同浓度雌激素对rhBMP-2作用下MCF-7细胞增殖能力的影响
MTT试验结果表明rhBMP-2组、noggin组较对照组有统计学差异(P<0.05),提示rhBMP-2、noggin均可抑制MCF-7细胞增殖见图1A。在不同浓度雌激素处理组与对照组的对比中,我们发现10-9mol与10-8mol浓度的雌激素对rhBMP-2干预后的MCF-7细胞增殖有抑制作用(P<0.05),10-7mol与10-6mol浓度的雌激素对rhBMP-2干预后的MCF-7细胞增殖有促进作用(P<0.05),见图1B。
图注:A.rhBMP-2、noggin对MCF-7细胞增殖的影响;B.不同雌激素水平对rhBMP-2干预下MCF-7细胞增殖的影响
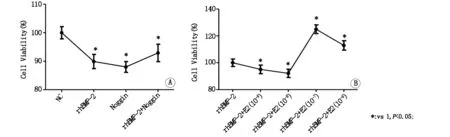
2.2 不同浓度雌激素对rhBMP-2作用下MCF-7细胞迁移能力的影响

图注:A.NC组 B.rhBMP-2组 C.noggin组 D.rhBMP-2+noggin组E.统计分析显示各组间无统计学差异

图注:A.rhBMP-2组 B.rhBMP-2+10-9 mol雌激素组 C.rhBMP-2+10-8 mol雌激素组 D.rhBMP-2+10-7 mol雌激素组E.rhBMP-2+10-6 mol雌激素组 F.统计分析显示部分浓度的雌激素水平对rhBMP-2干预下的MCF-7细胞迁移具有统计学意义
2.3 不同浓度雌激素对rhBMP-2作用下MCF-7细胞侵袭能力的影响
Transwell侵袭试验中,rhBMP-2、noggin具有减少MCF-7细胞侵袭的趋势,但无统计学差异,见图4。不同浓度的雌激素对于rhBMP-2干预后MCF-7细胞的侵袭能力有降低趋势,但均无统计学差异,见图5。
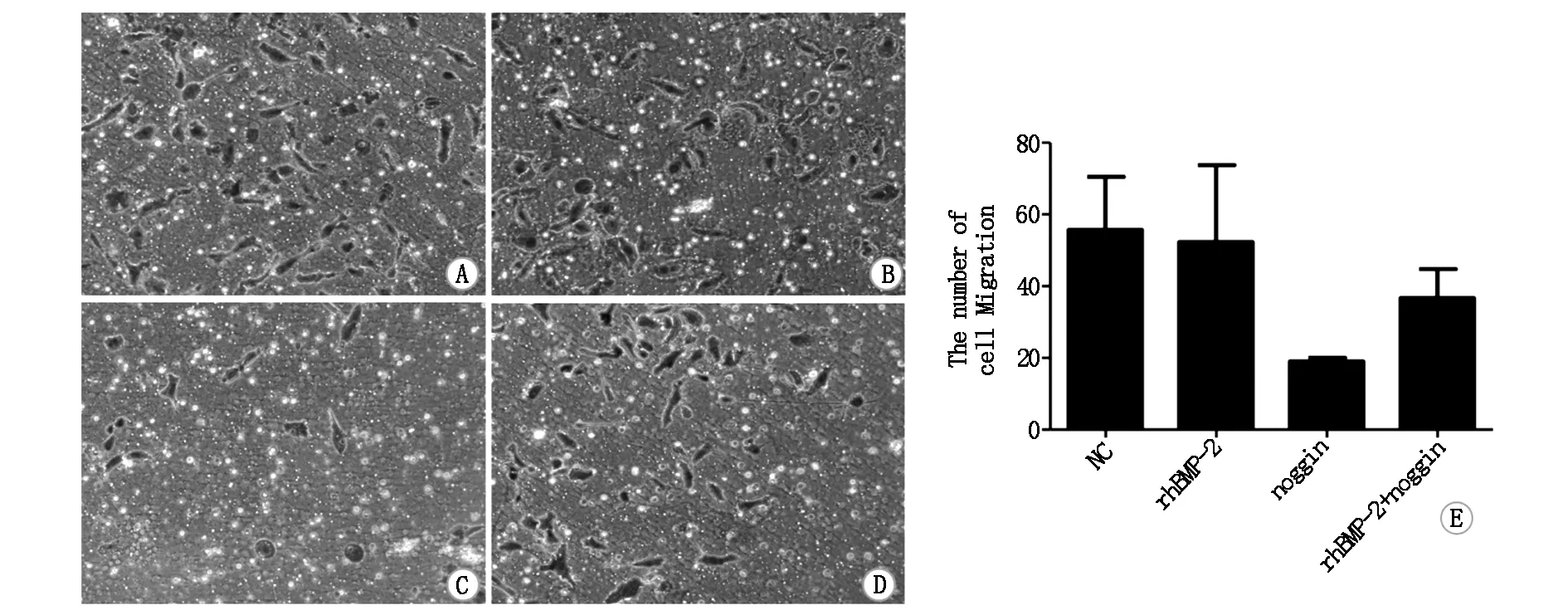
图注:A.对照组 B.rhBMP-2组 C.noggin组 D.rhBMP-2+noggin组E.统计学分析结果显示各组间无统计学差异

图注:A.rhBMP-2组 B.rhBMP-2+10-9 mol雌激素组 C.rhBMP-2+10-8 mol雌激素组 D.rhBMP-2+10-7 mol雌激素组E.rhBMP-2+10-6 mol雌激素 F.统计学分析显示各组间无统计学差异
2.4 不同浓度雌激素对rhBMP-2作用下MCF-7细胞周期的影响
流式分析结果显示rhBMP-2可影响乳腺癌MCF-7细胞的G1期(P<0.05),noggin可影响MCF-7细胞的S期(P<0.05),两者共同作用可进一步影响MCF-7细胞的S期(P<0.01),而对G2期均无显著性影响,见图6。10-9mol雌激素浓度可影响G1期(P<0.05),10-9mol、10-7mol、10-6mol雌激素浓度可影响S期(P<0.05),不同雌激素浓度对细胞G2期均无显著性影响,见图7。
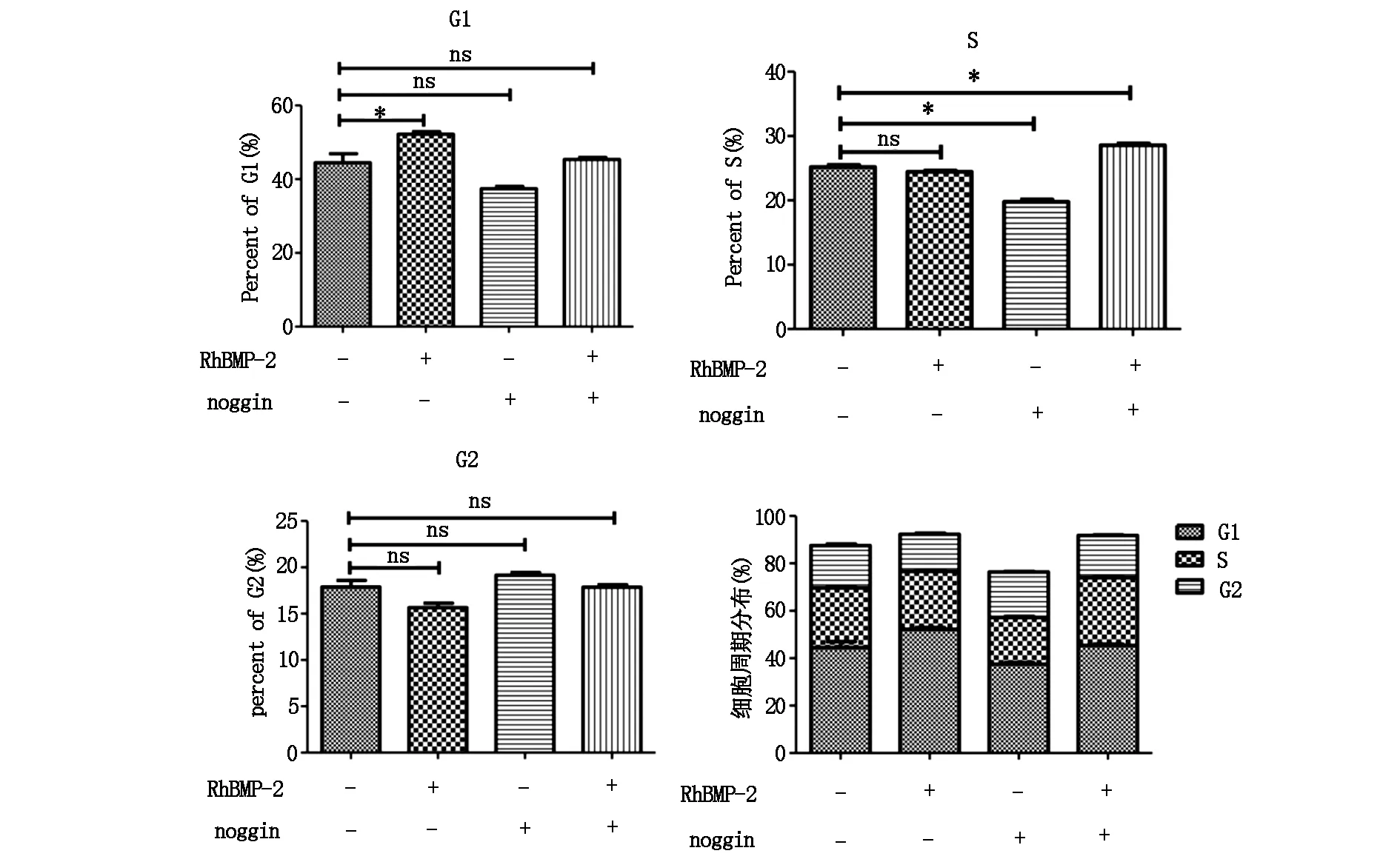
图6 rhBMP-2、noggin对乳腺癌MCF-7细胞周期的影响

图7 不同浓度梯度的雌激素对乳腺癌MCF-7细胞周期的影响
2.5 不同浓度雌激素对rhBMP-2作用下MCF-7细胞周期相关蛋白转录情况的影响
2.5.1CDK2转录 相对于“MCF-7细胞+rhBMP-2”组而言,“MCF-7细胞+rhBMP-2+10-9mol雌激素”组、“MCF-7细胞+rhBMP-2+10-8mol雌激素”组、“MCF-7细胞+rhBMP-2+10-6mol雌激素”组基因CDK2转录水平显著降低,而“MCF-7细胞+rhBMP-2+10-7mol雌激素”组则无统计学差异,见图8A。相对于“MCF-7细胞”组而言,“MCF-7细胞+rhBMP-2+noggin”组的CDK2转录水平明显降低,而“MCF-7细胞+ noggin”组、“MCF-7细胞+rhBMP-2”组CDK2转录水平并无统计学差异,见图8B。
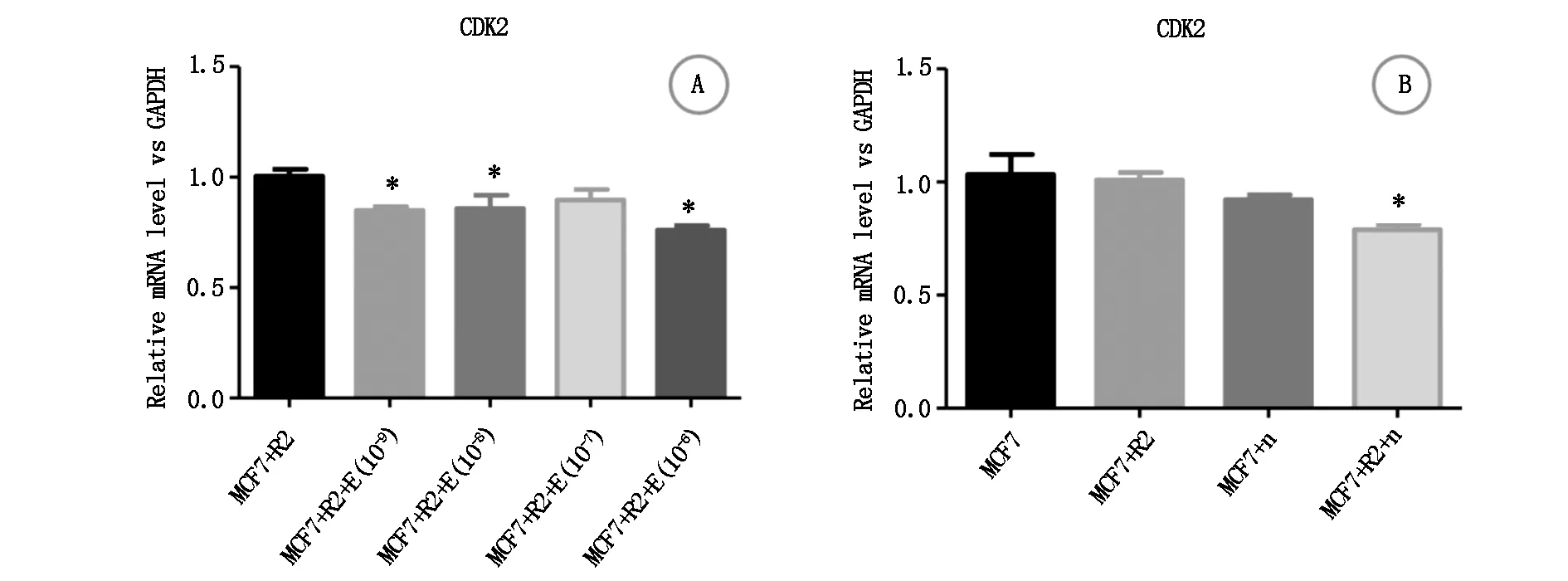
图8 不同浓度雌激素对rhBMP-2干预下MCF-7细胞CDK2转录的影响
2.5.2CDK4转录 相对于“MCF-7细胞+rhBMP-2”组而言,“MCF-7细胞+rhBMP-2+10-7mol雌激素”组基因CDK4转录水平显著降低,而其余各组(“MCF-7细胞+rhBMP-2+10-9mol雌激素”组、“MCF-7细胞+rhBMP-2+10-8mol雌激素”组、“MCF-7细胞+rhBMP-2+10-6mol雌激素”组)均无统计学差异,见图9A。相对于“MCF-7细胞”组,“MCF-7细胞+rhBMP-2”组CDK4转录水平降低,“MCF-7细胞+noggin”组、“MCF-7细胞+rhBMP-2+noggin”组CDK4转录水平无显著统计学差异,见图9B。
这种书桌除了护眼以外,最大的功效就是能自动调整孩子写作业的时间。当在手机软件上“作业”那一栏中填上所需要完成的作业后,机器便会自动设置时间。听到这儿你一定觉得:“不就是设置个时间吗,怎么会成了最大的功效呢?”因为如果时间一到,座椅就会把你弹到床上。在这期间,它会给你讲一个个小故事,休息时间一到,它会提醒你继续回去写作业。嘿嘿,怎么样,很方便吧!

图9 不同浓度雌激素对rhBMP-2干预下MCF-7细胞CDK4转录的影响
2.5.3cyclin D1转录 相对于“MCF-7细胞+rhBMP-2”组,“MCF-7细胞+rhBMP-2+10-9mol雌激素”组和“MCF-7细胞+rhBMP-2+10-6mol雌激素”组cyclin D1转录水平降低,另外2组(“MCF-7细胞+rhBMP-2+10-8mol雌激素”、“MCF-7细胞+rhBMP-2+10-7mol雌激素”)没有显著统计学差异,见图10A。相对于“MCF-7细胞”组,另外3组(“MCF-7细胞+rhBMP-2”、“MCF-7细胞+noggin”、“MCF-7细胞+rhBMP-2+noggin”)cyclin D1转录水平无统计学差异,见图10B。
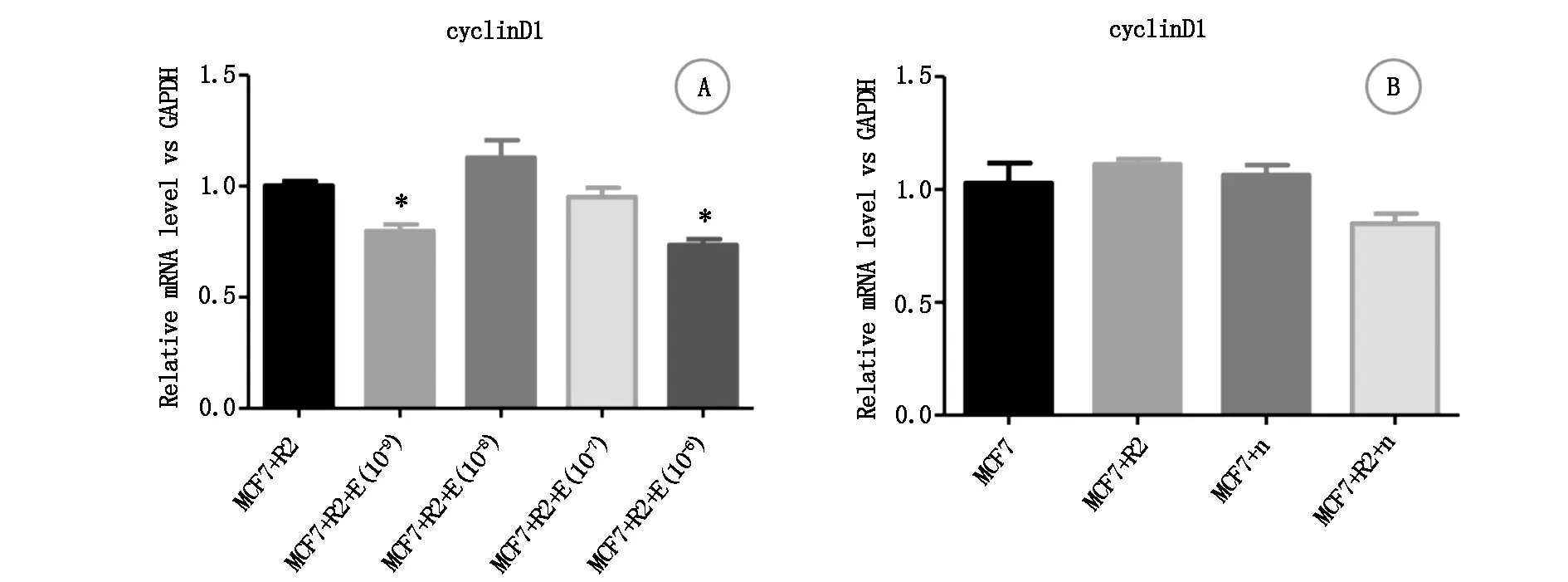
图10 不同浓度雌激素对rhBMP-2干预下MCF-7细胞cyclin D1转录的影响
2.5.4cyclin E转录 相对于“MCF-7细胞+rhBMP-2”组,“MCF-7细胞+rhBMP-2+雌激素10-6mol”组cyclin E转录水平降低,其他3组(“MCF-7细胞+rhBMP-2+雌激素10-9mol”、“MCF-7细胞+rhBMP-2+雌激素10-8mol”、“MCF-7细胞+rhBMP-2+雌激素10-7mol”)没有统计学差异,图11A。相对于“MCF-7细胞”组,其他3组(“MCF-7细胞+rhBMP-2”、“MCF-7细胞+noggin”、“MCF-7细胞+rhBMP-2+noggin”)cyclin E转录水平没有统计学差异,见图11B。
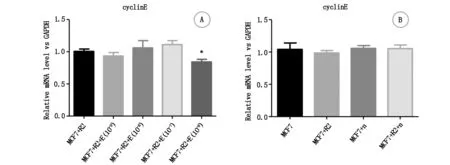
图11 不同浓度雌激素对rhBMP-2干预下MCF-7细胞cyclin E转录的影响
2.5.5p21转录 相对于“MCF-7细胞+rhBMP-2”组,“MCF-7细胞+rhBMP-2+雌激素10-9mol”组p21转录水平降低,其他3组(“MCF-7细胞+rhBMP-2+雌激素10-8mol”、“MCF-7细胞+rhBMP-2+雌激素10-7mol”、“MCF-7细胞+rhBMP-2+雌激素10-6mol”)没有统计学差异,见图12A。相对于“MCF-7细胞”组,其他3组(“MCF-7细胞+rhBMP-2”、“MCF-7细胞+noggin”、“MCF-7细胞+rhBMP-2+noggin”)p21转录水平没有统计学差异,见图12B。

图12 不同浓度雌激素对rhBMP-2干预下MCF-7细胞p21转录的影响
3 讨论
2002年美国FDA率先批准rhBMP-2的临床应用至今,其诱导骨骼形成及组织修复的功效已经得到国际上的普遍认可,并且在生物组织工程学领域展现出了广阔的应用前景[2,14-15]。然而,多项体外和在体试验证明肿瘤细胞中可表达BMP-2受体,并且发现rhBMP-2具有促进包括乳腺癌在内的多种恶性肿瘤发生及肿瘤细胞生长、增殖、侵袭和转移的潜能[6-7]。这就使得rhBMP-2临床应用的安全性问题成为学界关注的热点议题[16-17]。
迄今为止,尚缺乏关于rhBMP-2的临床应用与乳腺癌的发生、发展的相关性研究,Ghosh-Choudhury等以乳腺癌MDA-MB-231细胞系为研究对象,运用体外试验证实了BMP-2对乳腺癌MDA-MB-231细胞增殖的抑制作用可通过调控Rb蛋白的CDK磷酸化过程而实现[18]。Katsuno等发现BMP-2可调控Smad通路促进乳腺癌MDA-231-D细胞的侵袭能力和骨转移事件的发生[19]。在此基础上,Ye等[20]进一步推测rhBMP-2是通过调节多种细胞周期蛋白表达及Smad、Wnt信号通路而抑制乳腺癌细胞增殖。
在乳腺癌发生、发展过程中,雌激素水平的调节发挥着极其关键的生物学作用。在MDA-MB-231细胞中,BMP-2诱导ER剪接变异体(ERα-36)的表达呈剂量依赖性,雌二醇可刺激MDA-MB-231细胞的生长,当BMP-2信号通路被si-BMPR IA和si-BMPR IB沉默时,ERα-36诱导即被解除[21]。袁霞等[22]研究发现BMP-2可阻滞雌二醇诱导的 MCF-7、T-47D以及ZR-75-1细胞系生长,提示BMP-2可有效抑制雌激素敏感乳腺癌细胞的增殖,研究表明BMP-2主要抑制细胞周期的G1期并与诱导p21蛋白相关。同时研究者探究了BMP-2对非雌激素依赖的乳腺癌细胞增殖的作用,发现BMP-2抑制了MDA-MB-231细胞增殖,而MDA-MB-468细胞系的增殖却未受到抑制[22]。
张丽等证实rhBMP-2可促进乳腺癌细胞增殖并增强其迁移、侵袭能力,同时降低凋亡能力,反之noggin可抑制肿瘤增殖、侵袭及迁移能力,并可以促进细胞凋亡[23]。汪炬等的研究与本团队先前的研究均支持rhBMP-2对乳腺癌MCF-7细胞增殖具有显著的抑制作用,且呈浓度依赖性[9,24]。此外,张丽等发现BMP-2可以通过激活PI3K/Akt信号通路促进MCF-7细胞发生乳腺癌上皮-间质转化,从而诱导肿瘤侵袭转移,这也与本团队先前的研究结果一致[9,23]。汪炬等[24]研究表明BMP-2可上调与迁移力正相关的ID1、Pail等基因表达,并通过激活BMP信号途径,诱导细胞发生EMT转化,从而促进乳腺癌细胞迁移及侵袭。李珍等[25]亦提出rhBMP-2可通过上调CD44表达来增加乳腺癌MCF-7细胞迁移能力。在本研究中,我们发现不同浓度的雌激素可影响rhBMP-2干预后MCF-7细胞的迁移,但并未发现rhBMP-2对MCF-7细胞的迁移和侵袭显著的促进作用,这可能是由于本研究与先前研究中使用的rhBMP-2浓度与作用时间不同所致。
BMP能够调节乳腺癌细胞的生长,BMP信号的抑制显著降低有丝分裂检查点组分BUB3、Hec1、TTK和MAD2的蛋白质水平,导致细胞分裂和肿瘤发生,而BMP信号通路的激活则可对乳腺癌细胞产生相反的影响[26]。在BMP-2作用的研究中,发现BMP-2在体外对肿瘤细胞有直接的抗增殖作用[9,27]。另外,有学者证明BMP-2能增加MCF-7细胞中PTEN的表达,从而导致增殖减少[28]。PTEN是一种通过调节PI3K/Akt途径影响增殖的肿瘤抑制因子,PTEN突变者,乳腺癌的风险明显增加。在BMP-2存在下,PTEN与泛素结合蛋白的结合减少,表明BMP-2可能降低PTEN的降解,从而抑制细胞增殖。本研究中MTT试验结果提示较低浓度的雌激素对rhBMP-2干预后的MCF-7细胞增殖有抑制作用,而较高浓度的雌激素对rhBMP-2干预后的MCF-7细胞增殖则具有促进作用。
多项研究表明BMP-2可在体外和体内促进MCF-7和MDA-MB-231细胞的运动性和侵袭性[29,30]。BMP-2对肿瘤微环境、肿瘤细胞迁移和侵袭的影响对乳腺癌的发生和进展具有重要意义[8]。通过BMP信号通路激活刺激成纤维细胞可促进乳腺肿瘤细胞侵袭并增加炎性细胞因子的产生[31-32]。在三阴性乳腺癌MDA-MB-468细胞中,上调的BMPR IB显示出BMP-2作用下的细胞迁移能力增加,BMPR拮抗剂可消除上述现象[33]。BMP-2可能通过在肿瘤周围基质中诱导细胞外基质糖蛋白Tenascin-W的形成而促进肿瘤细胞的侵袭和迁移,乳腺癌间质中Tenascin-W的过度表达通过与α8整合素的相互作用促进癌细胞的侵袭和迁移[34]。在乳腺癌中,BMP信号对干细胞群的影响尚不明确,并且因实验条件而异。BMP2/7异二聚体在体外显著降低乳腺癌干细胞群的大小,在体内能够抑制骨转移的形成[35]。本实验中Transwell迁移试验提示不同浓度的雌激素均可促进rhBMP-2干预后MCF-7细胞的迁移,其中部分浓度具有统计学意义。
在细胞周期方面,多种BMPs在乳腺癌中具有直接或间接的抗肿瘤增殖作用,但这可能与BMP受体平衡或功能异常有关。BMP-2可通过上调细胞周期蛋白激酶抑制剂p21抑制雌二醇诱导的乳腺癌细胞增殖,进而抑制雌二醇诱导的细胞周期蛋白D1相关激酶活性[36]。有研究证实rhBMP-2可通过Rb和CD44信号通路诱导乳腺癌细胞EMT和干细胞凋亡,进而促进乳腺癌转移[37-38]。BMP-2促进MCF10A乳腺细胞产生管腔祖细胞,而BMP-4则可阻止分化,表明BMP-2和BMP-4之间的平衡决定了乳腺细胞的命运[39]。有研究提示BMPs可诱导干细胞静止,当肿瘤抑制因子ΔNp63α在MCF-7细胞中表达时,BMP靶基因ID-1上调,增殖显著减少。祖细胞样细胞比例增加,细胞处于可逆G0期。因而,研究者认为BMP信号诱导MCF7细胞静止是由ΔNp63α介导[40]。我们的研究发现10-9mol雌激素浓度可影响乳腺癌MCF-7细胞的G1期,10-9mol、10-7mol、10-6mol雌激素浓度可影响MCF-7细胞的S期,并且不同浓度的雌激素水平处理下细胞周期相关基因CDK2、CDK4、cyclin D1、cyclin E、p21的转录水平亦发生相应改变。本研究首次通过实验证实不同浓度雌激素对rhBMP-2干预乳腺癌MCF-7细胞增殖、迁移、侵袭以及细胞周期的影响。
本研究尚存在诸多不足之处:(1)本研究仅以MCF-7细胞系为研究对象,乳腺癌分子表型多样,研究结论是否适用于其他乳腺癌细胞亚型尚需进一步探索;(2)雌激素于人体内存在不同的活性类型,不同类型雌激素及其组合对于MCF-7细胞增殖、迁移、侵袭及细胞周期的影响有待进一步实验加以论证;(3)本实验未进行细胞周期蛋白表达水平的Western blot检测及分析,不同浓度梯度的雌激素对于乳腺癌MCF-7细胞周期蛋白表达的影响有待进一步深入探讨。
综上所述,不同浓度雌激素对重组人骨形态发生蛋白2干预乳腺癌MCF-7细胞增殖、迁移、侵袭及细胞周期存在一定影响。本项研究的意义在于:一方面为rhBMP-2的临床应用并发症与安全性提供了一定的理论依据,另一方面则为乳腺癌及乳腺癌骨转移的预防和治疗靶点的选择提供了新的思路。我们需要开展更为深入的研究来阐明BMP-2及其相关通路在乳腺癌发生发展中的作用及不同浓度雌激素对乳腺癌发生及疾病进展的影响及其作用机制。
