基于广泛靶向代谢组学的不同干燥方式丹参成分差异分析
2023-06-26王向东马艳芝张胜珍王晓英客绍英
王向东,马艳芝,张胜珍,王晓英,客绍英
(1.唐山师范学院 实验管理中心,河北 唐山 063000;2.唐山师范学院 生命科学系,河北 唐山 063000;3.河北农业大学,河北 保定 071001)
丹参(Salvia miltiorrhizaBunge)为唇形科鼠尾草属的多年生草本植物,是1 种传统大宗中药材,在我国种植历史悠久,《神农本草经》中对丹参有了最早记载[1]。丹参用药部位一般取自其根茎,有活血祛癖、通经止痛、清心除烦、凉血消痈之功效[2],其次生代谢物质还具有抗炎等活性[3]。丹参药物在世界很多国家和地区都得到了广泛应用,尤其是东南亚国家、印度、中东国家;但是其有效成分和潜在的作用机制并不非常清楚。近年来,为了阐明丹参的药效组分,科研人员已经从丹参中分离出100多种纯化合物,根据其结构特征和化学性质基本可以分为2 组:一组是丹酚酸类为主的水溶性成分[4];一组是丹参酮类为主的亲脂性成分[5]。中国药典(2020 版)规定丹参商品药材中丹酚酸B 含量不低于3.0%,丹参酮IIA 含量不低于0.2%。
随着科技进步,现代分析仪器和技术被用于传统中药成分分析和研究当中,丹参基因组学、蛋白质组学和代谢组学研究取得了较大进展。2010 年,世界上第一个药用植物的基因组框架图成功绘制并发布,而这个药用植物就是丹参[6]。2021 年,中国中医科学院对丹参进行了基因组测序,获得了较好的基因组序列信息,并解析丹参纯合基因组和新基因簇在丹参酮合成中的作用[7]。Guo 等[8]利用蛋白质组学方法研究丹参在炮制“发汗”过程中的生化变化情况。代谢组学(Metabolomics)是继基因组学和蛋白质组学之后新近发展起来的1门学科,是系统生物学的重要组成部分[9-10],近年来得到迅速发展并渗透到多项领域。代谢物质反映细胞的营养状态以及外界因素对它的影响。中药材中的有效成分多数为植物次生代谢物质,所以代谢组学在中药材研究中起到了非常重要的作用。Zhang 等[11]利用UHPLC-QTOF/MS 技术对丹参治疗老年痴呆病的代谢组学进行了研究。Kum 等[12]使用质子核磁共振波谱(1H-NMR)代谢组学方法结合高效薄层色谱(HPTLC)有效地分析了不同丹参产品中的化学成分。
收获后的新鲜丹参一般要经过干燥脱水后才能长期保存或进行下一步加工。目前,丹参常用的干燥方法有晒、阴、烘等多种方法。丹参的不同干燥处理方法会对主要代谢产物尤其是与药效相关的代谢产物有很大影响。因此,研究丹参采后不同干燥处理方式、不同干燥条件、优化干燥工艺对提高丹参有效药用成分和药材品质具有十分重要的意义。本研究旨在利用广泛靶向代谢组学方法分析不同干燥方式对丹参成分的影响,研究结果可为选择合适的干燥方法、提高丹参药材质量提供理论依据。
1 材料与方法
1.1 材料与试剂
供试材料为药材丹参(Salvia miltiorrhizaBunge),丹参苗由河北省唐山禾盛源生态农业科技开发有限公司提供,2021 年4 月19 日移栽于唐山市王官营镇中药材大田种植试验基地,2021 年11 月1 日收获,田间管理同一般丹参种植田。
甲醇、乙腈和标准品均为色谱纯(德国Merck公司)。
1.2 干燥方法
丹参收获后,称取无虫害、无霉变、均匀一致鲜根5 份,每份50 g,切成厚度均匀的片状,分别以不同方式进行干燥。(1)阴干(Treat 1):将丹参根平铺于纸上,室内通风处阴干。(2)晒干(Treat 2):将丹参根平铺于纸上,室外阳光充足处晒干。(3)微波干燥(Treat 3):将丹参根均匀放在微波炉里,低火干燥。(4)50 ℃烘干(Treat 4):将丹参根均匀放在电热烘箱中,50 ℃干燥。(5)70 ℃烘干(Treat 5):将丹参根均匀放在电热烘箱中,70 ℃干燥。以上均处理至样品恒重。
1.3 方法
1.3.1 样品前处理 超低温冷冻保存的3 次重复共15 组供试样本,通过Scientz-100F 真空冷冻干燥机冷冻干燥。冻干样品使用Retsch-MM 400 研磨仪30 Hz 粉碎1.5 min。称取100 mg 冷冻干燥粉末,用1.2 mL 70%甲醇溶液溶解,将样品置于冰箱(4 ℃)中过夜,期间进行6 次旋涡振荡。提取的样品离心(10 000 g,10 min)后取上清,用微孔滤膜(0.22 μm)过滤,滤液保存到进样瓶,备用。
1.3.2 广泛靶向代谢组检测 广泛靶向代谢组检测使用UPLC-ESI-MS/MS 系统(UPLC,SHIMADZU Nexera X2;MS,Applied Biosystems 6500 Q TRAP)完成。色谱条件与陈秀萍等人的研究一致[13]。将流出物连接到ESI 三重四极线性离子阱(Q TRAP)-MS。LIT 和三重四极杆(QQQ)扫描在AB6500 Q TRAP UPLC/MS/MS 系统上获得,系统条件与高建飞等人的研究一致[14]。
1.3.3 质控样本 采用供试样本提取物混合制备,按照1∶10 的比例在检测样本中插入质控样本以检测分析过程的可重复性。
1.4 数据统计分析
单变量统计分析包括Student-t 检验、U-test、ANOVA、相关性分析,多元统计分析包括主成分分析(PCA)、正交偏最小二乘判别分析(OPLS-DA),使用R 软件包进行代谢组数据分析。样品和代谢物的聚类分析(HCA)结果用R 软件包Complex-Heatmap 热图展示,样品间的皮尔逊相关系数(PCC)用R 软件包cor 计算,K-means 算法采用无监督的聚类算法。
1.5 差异代谢物筛选
质谱数据利用软件Analyst1.6.3 处理,供试样本代谢物的质谱定性分析采用迈维公司自建数据库MWDB 二级谱信息,定量分析使用多反应检测模式(MRM)进行。差异代谢物的筛选条件:OPLSDA 中VIP ≥1、Fold Change ≥2 或≤0.5。
1.6 KEGG 注释和富集分析
利用KEGG 数据库和通路库进行差异代谢物的注释和映射,具体分析方法参照冯婧玮等[15]的研究,利用R 软件包Cluster Profiler 超几何检验法对差异代谢物进行富集分析。
2 结果与分析
2.1 样本质控分析
代谢组研究中,数据的重复性及可靠性至关重要。代谢物的检测结果如图1 所示,总离子流(TIC)曲线重叠性高,即保留时间、峰强度均一致,表明了质谱对同一样品在不同时间进行检测时,信号稳定性好,结果可靠[16]。

图1 质控样本质谱检测TIC 重叠图Fig.1 TIC chart of mass spectrometry detection of quality control sample
2.2 样本主成分分析
主成分分析(PCA)结果如图2 所示,各处理组间的差异较大,组内即重复间的差异较小,说明样本重复性较好。

图2 各组样品与质控样品质谱数据的PCA 图Fig.2 PCA diagram of each group of samples and quality control samples
2.3 总体样品代谢物聚类分析结果
本研究对代谢物数据先后进行归一化处理和层次聚类分析,结果如图3 所示,横、纵坐标分别为样品名称和代谢物信息。标准化处理代谢物相对含量获得的值用不同颜色表示,红、绿色分别代表高含量和低含量。从图中可以看出,不同干燥方法的处理间代谢物差异显著,而同一处理的3 个样本间重复性较好。

图3 总体样本代谢物聚类图Fig.3 Metabolite cluster diagram of all the sample
2.4 差异代谢物筛选鉴定
基于UPLC-MS/MS 检测平台,通过与迈维公司自建数据库进行比对,共检测到637 种代谢物。不同干燥方法间差异代谢物数量如表1 所示。

表1 各处理间差异代谢物汇总表Table 1 Summary of different accumulated metabolites among treatments
从表1 可以看出,50 ℃烘干(Treat 4)与阴干(Treat 1)、晒干(Treat 2)之间差异代谢相对较少;70 ℃烘干(Treat 5)与微波干燥(Treat 3)之间差异相对较小,但与其它方法间差异均较大;阴干与50 ℃烘干方法间总差异代谢物数量最小(143 个),而70 ℃烘干与50 ℃烘干间总差异代谢物数量最多(237 个)。Venn 图(图4)显示5 种不同干燥处理间共同的差异物有43 个。

图4 各处理间差异代谢物Venn 图Fig.4 Venn diagram of different metabolites among treatments
2.5 差异代谢物火山图结果
火山图(Volcano Plot)清晰地展示出代谢物在2 组样品中的相对含量差异以及统计学上差异的显著性。图5 为不同干燥处理间差异代谢物的火山图。代谢物用图中点表示,其中绿色、红色和灰色点分别代表下调、上调和差异不显著代谢物。从图中可以看出不同处理间存在显著差异的代谢物。
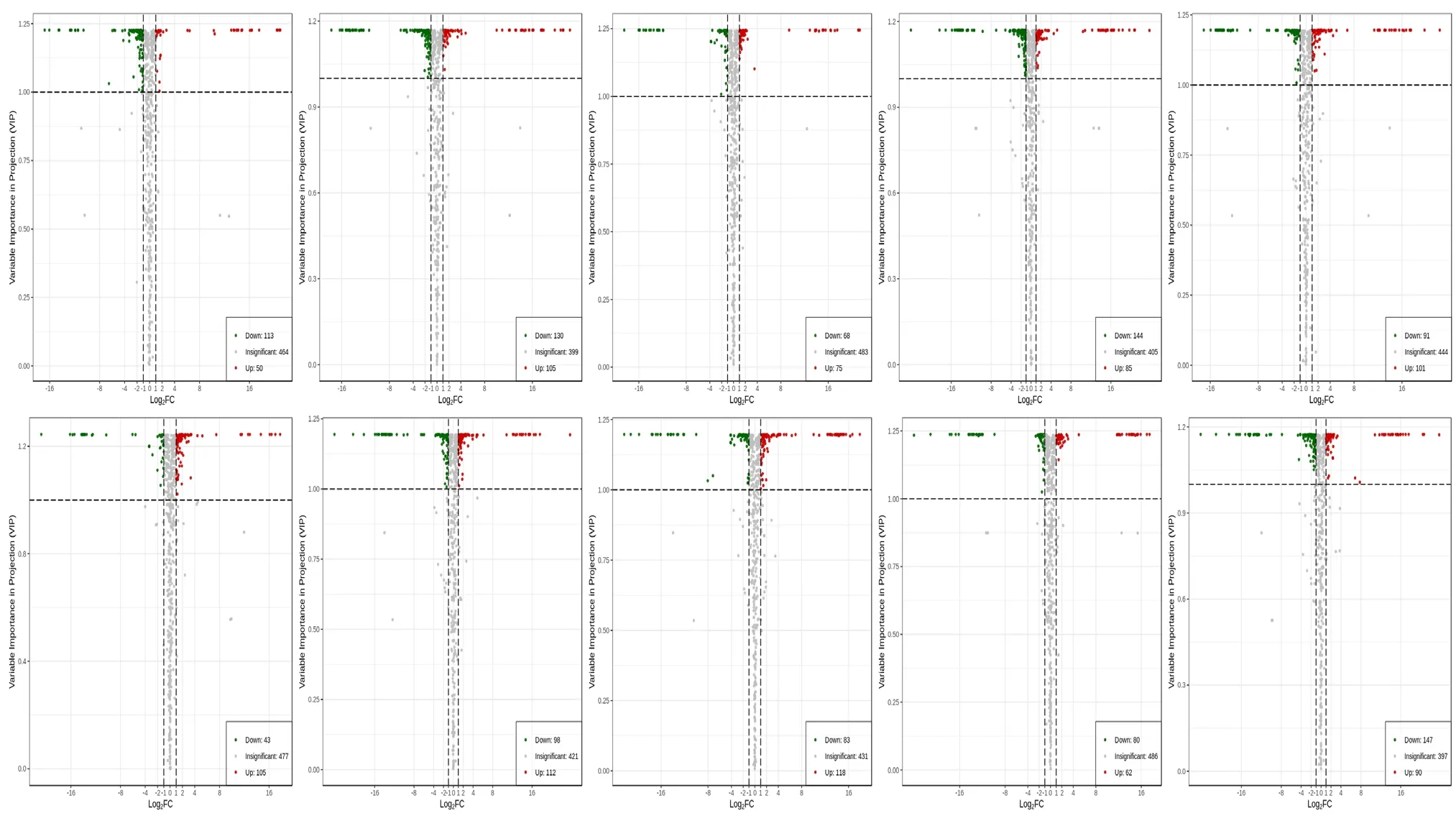
图5 各处理间差异代谢物火山图Fig.5 Volcanic map of differential metabolites among treatments
2.6 差异代谢物含量差异动态分布分析
本研究选取变化量最大的20 个代谢物(包含10个上调的代谢物和10 个下调代谢物)进行代谢物含量差异动态分布图分析(图6),结果显示含量变化最显著的代谢物主要集中在酚酸类和酮类物质,还有一些萜类、生物碱类物质,少量鞣质、醌类物质。

图6 各处理间代谢物含量差异动态分布图Fig.6 Dynamic distribution diagram of metabolite content difference among treatments
除20 种含量差异最显著的代谢物外,研究对丹参中常见的几种水溶性成分的含量进行了分析,结果如表2 所示。从水溶性成分(主要为酚酸类物质)含量变化情况看,阴干、晒干法和50 ℃烘干法丹酚酸含量高于微波干燥法;70 ℃烘干法丹酚酸含量高于晒干法;阴干、晒干和50 ℃烘干3 种方法在丹酚酸含量方面无显著差异。

表2 常见丹参水溶性成分含量变化Table 2 Content changes of water-soluble components in Salvia miltiorrhiza
2.7 差异代谢物KEGG 功能注释及富集分析
利用KEGG 数据库对不同处理间的差异代谢物进行注释和通路富集分析。图7 结果显示,差异代谢组分为酪氨酸代谢、色氨酸代谢、苯丙类物质合成等14 类,其中属于代谢通路分类中的差异代谢物占比最高(61.9%),其次为次生代谢物合成分类(47.62%),归属于苯丙类物质合成和黄酮-黄酮醇合成中差异代谢物占比也较高,分别为23.81%和19.05%,这2 个分类与植物酮类物质合成密切相关。将差异代谢物进行KEGG 通路富集分析,结果显示这些代谢物位于氨基酸合成(如甘氨酸、精氨酸、苯丙氨酸、色氨酸等)、黄酮和黄酮醇合成、类黄酮合成、次生代谢物合成等几个通路,但其中含量差异最显著的代谢物(红色、绿色的点分别代表含量显著增加和显著下降)均属于黄酮和黄酮醇合成通路当中,如图8 所示。

图7 差异代谢物KEGG 分类图Fig.7 KEGG classification diagram of differential metabolites

图8 差异代谢物KEGG 通路图Fig.8 KEGG pathway diagram of differential metabolites
3 讨论
干燥是中药材产后加工中的重要环节,不同的干燥方式和干燥条件对中药材成分和含量等品质有较大影响,进而影响临床疗效[17]。
目前,丹参生产中有阴干、晒干、微波干燥、冷冻干燥和烘干等方法,农民种植户以晒干为主,而丹参加工企业多采用烘干的方式,但烘干的温度也各不相同。户外晾晒和阴干虽然操作简便,但存在干燥周期长、易受气候影响等缺点,也易造成发霉变质或污染等问题[18]。微波干燥具有干燥速度快、加热均匀、干燥效率高等特点[18],近年来逐渐用于人参、银杏、淮山等中药材的干燥[19]。由于丹参酮Ⅰ和丹参酮ⅡA 等成分容易发生光解,阳光下干燥过长、曝晒过度,则有效成分降低较大,同时影响光泽度、颜色等外观品质。同时,丹参原材料及相关制剂中酚酸类成分含量变化幅度大,这都造成了丹参产品质量不稳定[20]。然而,有关对丹参干燥过程中代谢物的动态变化及代谢机制研究还较少。
张薇等[18]用HPLC 方法测定了微波干燥对丹参药材中丹参酮I 和丹参酮IIA 等主要有效化学成分含量的影响。结果表明,采用不同的干燥方法,药材中丹参酮I 和丹参酮IIA 的含量相差较大,其中阴干和晒干的方法有效化学成分丹参酮I 和丹参酮IIA 含量较高。微波加热干燥和烘干法,不同程度地降低了丹参酮类(I 和IIA)有效成分的含量,这表明丹参酮类物质对温度较敏感。裘汉幸等[21]比较了阴干、曝晒、烘干(60 ℃)和发汗4 种加工方法对丹参酮IIA 含量的影响,认为丹参酮IIA 在阳光直射下容易分解,阴干法避免了丹参酮IIA 的破坏,烘干加热过程中有效成分也容易遭到破坏,含量比阴干法偏低。杨翼信等[22]探讨了冷冻、真空、阴、晒干4 种干燥方式对丹参主要化学成分的影响,表明与冷冻干燥相比,真空干燥和阴干处理的丹参酮类成分含量下降约50%,但酚酸类成分影响不大;晒干处理后二类成分均严重损失达90%左右。张小博等[23]采用阴干、80 ℃烘干、60 ℃烘干和40 ℃烘干等不同干燥方法,结果表明,40 ℃烘干处理时丹酚酸B 含量最高,而较高温度下烘干(60 ℃和80 ℃)后含量较低。而对于丹参酮,80 ℃烘干下含量最高,阴干条件下丹参酮含量最低。原因可能是因为丹参酮类成分性质不稳定,在光照条件下易分解,阴干和烘干条件下损失较少。赵成等[24]认为阳光曝晒干燥方法中,由于阳光直射,丹参酮ⅡA 易遭到破坏,而阴干法则相对较好。赵欣等[25]研究认为60 ℃条件下隐丹参酮含量最佳。邓寒霜等[26]认为丹参酮ⅡA 在有光照的晒干处理时含量降低,阴干、烘干等避光处理时含量升高,且温度越高丹参酮ⅡA 含量越高。
本研究对丹参样品进行阴干、晒干、微波干燥、50 ℃烘干和70 ℃烘干等不同干燥方法处理,采用UPLC-MS/MS 技术对丹参的代谢物进行系统分析,共获得637 种代谢物,代谢物种类非常丰富。通过对代谢物含量变化情况进行严格筛选,在各组不同干燥方法间筛选到差异显著的代谢物(表1)。各组间总差异代谢物数量在142 ~237 个,含量下调的代谢物在43 ~147 个,含量上调的代谢物在50 ~118 个,表明不同干燥方法间代谢物差异非常显著。本研究对各组间含量变化最大的20 个代谢物进行了差异代谢物含量动态分布进行分析,并进行差异代谢物注释、映射和通路富信分析,结果显示(图7)代谢通路分类中的差异代谢物占比最高(61.9%),其次为次生代谢物合成分类(47.62%),归属于苯丙类物质合成和黄酮-黄酮醇合成中差异代谢物占比也较高,分别为23.81%和19.05%,这几个分类增多与丹参有效成分物质合成密切相关。本研究又对丹参中常见的几种水溶性成分的含量进行了分析(如表2),从水溶性成分(主要为酚酸类物质)含量变化情况看,阴干、晒干法和50 ℃烘干法丹酚酸含量高于微波干燥法;70 ℃烘干法丹酚酸含量高于晒干法;阴干、晒干和50 ℃烘干3 种方法在丹酚酸含量方面无显著差异。
