外源NO 对低温胁迫下仁用杏花器官AsA-GSH 循环的影响
2023-06-26赵子媛佟冠杰李彦慧
赵子媛,佟冠杰,李彦慧
(1.河北农业大学,河北 保定 071000;2.河北绿景工程咨询服务有限公司,河北 石家庄 050000)
仁用杏(Kernel-apricot)是我国重要的经济林树种,也是木本油料树种的主要成员之一[1],具有耐寒、耐旱、耐瘠薄、对土壤要求不严等特性,是适应性强的树种,常作为重要的荒山绿化和防护林树种。杏仁具有丰富的营养,既是食品,又是药品和上等滋补品的原料。仁用杏具有良好的经济价值,仁用杏产业的综合开发利用涉及食品、油料、饮料、中药、化工、化妆品等多个领域[2],发展仁用杏生产也成为了增加农村收入的有效途径之一。但在仁用杏的实际生产中,由于其在春季开花较早,花期易受到低温冻害从而导致减产甚至绝收,使经济效益受到巨大损失,这一问题一直制约着仁用杏的生产发展,因此提高仁用杏花期抗寒性的研究已成为仁用杏产业重要的课题。
NO 作为植物体内重要的信号分子,当植物处于逆境条件时发挥信号传导作用,能够缓解逆境胁迫对植物造成的伤害。抗坏血酸-谷胱甘肽(AsAGSH)循环系统是植物体内抵抗氧化胁迫,清除活性氧(ROS)的重要调节系统。许多研究表明,外源NO 参与着许多植物的AsA-GSH 循环的调节,缓解植物在逆境胁迫受到的伤害,如缓解盐胁迫[3-4],高温胁迫[5],金属胁迫[6]等。但目前关于喷施外源NO 在低温胁迫下仁用杏花器官AsA-GSH 循环系统的影响的研究鲜见报道。因此,本试验以3 个品种仁用杏花器官为材料,通过喷施不同浓度的外源NO,研究不同浓度的外源NO 对低温胁迫下仁用杏花器官活性氧水平及AsA-GSH 循环系统中的主要抗氧化物质和酶活性的影响,为缓解低温逆境对仁用杏的伤害提供理论依据和科学指导,对实现仁用杏产业的生产发展具有重要的指导意义。
1 材料与方法
1.1 试验材料
试验选用‘龙王帽’(‘Longwangmao’)、‘优一’(‘Youyi’)和‘围选1 号’(‘Weixuan 1’)3 个仁用杏品种作为供试材料,分别于2018 年4 月13 日、4 月16 日、4 月18 日在承德市围场县杨家湾乡务本堂村选择长势整齐一致、生长健壮、无病虫害的10 年生植株各30 株于显蕾期分别从树冠东、西、南、北4 个方向采取1 年生花枝,在实验室中进行水培。
1.2 试验方法
1.2.1 外源NO 处理 试验所用外源NO 供体为硝普钠(Sodium nitroprusside,SNP)。将3 个仁用杏品种的花器官分别喷施浓度为0(CK,蒸馏水)、0.1、0.2、0.3、0.4、0.5 mmol/L 的SNP,每品种每处理3 次重复,每重复20 枝。在室温下早晚各喷施1 次,每次每处理喷施80 mL,共喷施2 d,之后进行低温处理。
1.2.2 低温处理 将经过SNP 喷施的花枝放入以PID 调节方式控温和Fros Tem40 数据采集的MSZ-2F 型模拟霜箱内。人工霜箱1.5 h 降到0 ℃,之后以1 ℃/0.5 h 的速度降温,根据宁超[7]测定的各品种的过冷却点温度,‘优一’和‘龙王帽’降到-2 ℃后保持4 h,‘围选1 号’降到-3 ℃后保持4 h,取出材料立即摘取花器官混匀,用于生理指标的测定,所有生理指标每个处理均3 次重复。
1.3 指标的测定方法
过氧化氢(H2O2)含量的测定采用林植芳[8]等的方法;超氧阴离子自由基(O2-)产生速率采用王爱国[9]等的方法;抗坏血酸(AsA)和脱氢抗坏血酸(DHA)的测定参照Arakawa[10]的方法;谷胱甘肽(GSH)和氧化型谷胱甘肽(GSSG)的测定参照Griffith[11]的方法;抗坏血酸过氧化物酶(APX)和脱氢抗坏血酸还原酶(DHAR)的测定参照Nakano 和Asada[12]的方法;谷胱甘肽过氧化物酶(GPX)的测定采用张景萍[13]的方法。
1.4 统计分析
采用Excel 和SPSS17.0 软件对试验数据进行统计分析和绘图处理。
2 结果与分析
2.1 外源NO 对低温胁迫下仁用杏花器官活性氧水平的影响
2.1.1 对过氧化氢(H2O2)含量的影响 如图1 所示,

图1 外源NO 对低温胁迫下仁用杏花器官H2O2 含量的影响Fig.1 Effects of exogenous NO on the H2O2 content of kernel apricot floral organs under low temperature stress
在低温胁迫下,3 个仁用杏品种喷施外源NO 各处理的H2O2含量均低于CK,‘优一’和‘龙王帽’H2O2含量随外源NO 浓度的增大呈现先下降后上升的变化趋势,2 个品种均在SNP 浓度为0.4 mmol/L 时H2O2含量降至到最低,分别比CK 降低了13.71%、25.17%,均与CK 差异极显著;随外源NO 浓度的增大,‘围选1 号’H2O2含量持续下降,当SNP浓度为0.5 mmol/L 时H2O2含量降至到最低,比CK降低了25.17%,与CK 差异极显著。
外源NO 各处理对3 个仁用杏品种的H2O2含量降低的程度不同,除0.5 mmol/L SNP 处理外,‘龙王帽’在外源NO 各处理下H2O2含量下降幅度均高于‘优一’和‘围选1 号’。
2.1.2 对超氧阴离子自由基(O2-)产生速率的影响喷施不同浓度外源NO 对仁用杏花O2-产生速率的影响见图2,‘优一’花器官在喷施0.1、0.2、0.3、0.4、0.5 mmol/L SNP 处理的O2-产生速率分别是CK 的60.31%、53.99%、42.19%、34.80%、44.46%,各处理均与CK 有极显著性差异。‘龙王帽’花器官 在 喷 施0.1、0.2、0.3、0.4、0.5 mmol/L SNP 处理的O2-产生速率分别是CK 的79.09%、46.07%、38.08%、14.38%、27.43%,各处理均与CK 有极显著性差异。‘围选1 号’花器官在喷施0.1、0.2、0.3、0.4、0.5 mmol/L SNP 处理的O2-产生速率分别 是CK 的83.25%、65.67%、51.58%、36.82%、22.89%,0.1 mmol/L SNP 处理与CK 差异显著,其他各处理均与CK 有极显著性差异。外源NO 各处理不同程度的降低了3 个仁用杏品种花器官的O2-产生速率,在0.4 mmol/L SNP 处理下,‘优一’‘龙王帽’和‘围选1 号’分别比CK 降低了65.20%、85.62%、63.18%。

图2 外源NO 对低温胁迫下仁用杏花器官O2-产生速率的影响Fig.2 Effects of exogenous NO on the generation rate of O2- of kernel apricot floral organs under low temperature stress
2.2 外源NO 对低温胁迫下仁用杏花器官抗坏血酸循环的影响
喷施不同浓度外源NO 对仁用杏花器官抗坏血酸循环的影响见表1,施加不同浓度的外源NO 均提高了3 个仁用杏品种的AsA、AsA+DHA 含量和AsA/DHA 值,降低DHA 含量。

表1 外源NO 对低温胁迫下仁用杏花器官抗坏血酸循环的影响Table 1 Effects of exogenous NO on the ascorbate cycle of kernel apricot floral organs under low temperature stress
‘优一’花器官在0.1、0.2、0.3、0.4、0.5 mmol/L SNP 处理下的AsA 含量分别比CK 提高了7.94%、21.19%、27.91%、26.48%、21.95%;‘龙王帽’花器官在0.1、0.2、0.3、0.4、0.5 mmol/L SNP 处理下的AsA 含量分别比CK 提高了3.26%、6.30%、9.65%、15.11%、8.45%;‘围选1 号’花器官在0.1、0.2、0.3、0.4、0.5 mmol/L SNP 处理下的AsA 含量分别比CK提高了3.03%、5.40%、7.76%、12.08%、14.61%。3 种仁用杏均在SNP 浓度为0.1 mmol/L 时,与CK无显著性差异。外源NO 对3 个仁用杏品种花器官AsA 含量的影响是不同的,‘优一’在外源NO 各处理下AsA 含量上升幅度均高于‘龙王帽’和‘围选1 号’。
‘优一’在0.1、0.2、0.3、0.4、0.5 mmol/L SNP 处理下DHA 含量分别比CK 降低了19.40%、34.04%、41.98%、52.56%、47.44%;‘龙王帽’在0.1、0.2、0.3、0.4、0.5 mmol/L SNP 处 理 下DHA含量分别比CK 降低了4.97%、25.73%、37.92%、61.63%、45.60%;‘围选1 号’在0.1、0.2、0.3、0.4、0.5 mmol/L SNP 处理下DHA 含量分别比CK 降低了28.86%、33.16%、38.48%、50.13%、64.30%。3个仁用杏品种在0.4 mmol/L SNP 处理时均与CK 差异极显著。
‘优一’花器官喷施0.1、0.2、0.3、0.4、0.5 mmol/L SNP 处理的AsA+DHA 含量分别比CK提高了4.77%、14.73%、19.71%、17.22%、13.90%,0.2、0.5 mmol/L SNP 处理与CK 差异显著,0.3、0.4 mmol/L SNP 处理与CK 差异极显著。‘龙王帽’花 器 官 喷 施0.1、0.2、0.3、0.4、0.5 mmol/L SNP处理的AsA+DHA 含量分别比CK 提高了2.42%、3.43%、5.45%、8.28%、3.64%,0.4 mmol/L SNP处理与CK 差异显著,其余浓度处理均无显著差异。‘围选1 号’花器官喷施0.1、0.2、0.3、0.4、0.5 mmol/L SNP 处理的AsA+DHA 含量分别比CK提高了0.60%、2.39%、4.18%、7.17%、8.37%,0.4、0.5 mmol/L SNP 处理与CK 差异极显著。外源NO对3 个仁用杏品种花器官AsA+DHA 含量的影响是不同的,‘优一’在外源NO 各处理下AsA+DHA含量上升幅度均高于‘龙王帽’和‘围选1 号’。
‘优一’和‘龙王帽’各处理的AsA/DHA 随外源NO浓度的增大呈现先上升后下降的变化趋势,均在0.4 mmol/L SNP 处理时升到最大,分别是CK的2.74、3.13 倍,与CK 差异极显著;‘围选1 号’各处理的AsA/DHA 随外源NO 浓度的增大呈现上升的变化趋势,0.5 mmol/L SNP 处理是CK 的3.15倍,与CK 差异极显著。
2.3 外源NO 对低温胁迫下仁用杏花器官谷胱甘肽循环的影响
喷施不同浓度外源NO 对仁用杏花器官谷胱甘肽循环的影响见表2。施加不同浓度的外源NO 均提高了3 个仁用杏品种的GSH、GSH+GSSG 含量和GSH/GSSG 值,降低GSSG 含量。

表2 外源NO 对低温胁迫下仁用杏花器官谷胱甘肽循环的影响Table 2 Effects of exogenous NO on the glutathione cycle of kernel apricot floral organs under low temperature stress
‘优一’0.1、0.2、0.3、0.4、0.5 mmol/L SNP处理GSH 含量均极显著高于CK,分别比CK 提高了7.94%、10.40%、13.91%、17.83%、12.57%。‘龙王帽’0.1 mmol/L SNP 处理与CK 无显著性差异,但比CK 提高了2.33%;0.2、0.3、0.4、0.5 mmol/L SNP 处理均极显著高于CK,分别比CK 提高了4.55%、6.81%、8.00%、6.61%。‘围选1 号’0.1 mmol/L SNP处理显著高于CK,比CK 提高了3.28%;0.2、0.3、0.4、0.5 mmol/L SNP 处理均极显著高于CK,分别比CK提高了4.89%、7.57%、10.01%、13.41%。外源NO对3 个仁用杏品种GSH 含量的影响是不同的,除0.5 mmol/L SNP 处理外,‘优一’在外源NO 各处理下GSH 含量上升幅度均高于‘龙王帽’和‘围选1 号’。
‘优一’在0.1、0.2、0.3、0.4、0.5 mmol/L SNP处理下GSSG 含量分别是CK 的98.34%、96.52%、93.35%、90.19%、91.85%;‘龙王帽’在0.1、0.2、0.3、0.4、0.5 mmol/L SNP 处理下GSSG 含量分别是CK 的98.96%、97.06%、95.16%、94.22%、94.62%;‘围选1 号’在0.1、0.2、0.3、0.4、0.5 mmol/L SNP 处理下GSSG 含量分别是CK 的97.95%、96.63%、94.50%、93.78%、92.60%。3 个品种仁用杏在0.1 mmol/L SNP处理时均与CK 无显著性差异。外源NO 对3 个仁用杏品种GSSG 含量的影响是不同的,除0.1 mmol/L SNP 处理外,‘优一’在外源NO 各处理下GSSG含量降低幅度均高于‘龙王帽’和‘围选1 号’。
‘优一’花器官喷施0.1、0.2、0.3、0.4、0.5 mmol/L SNP 处理的GSH+GSSG 含量分别比CK 提高了3.26%、3.63%、3.89%、4.36%、2.47%,外源NO 各处理与CK均呈极显著性差异。‘龙王帽’花器官喷施0.1、0.2、0.3、0.4、0.5 mmol/L SNP 处理的GSH+GSSG 含量分别比CK 提 高 了0.69%、0.91%、1.15%、1.31%、0.78%,外源NO 各处理与CK 均无显著性差异。‘围选1 号’花器官喷施0.1、0.2、0.3、0.4、0.5 mmol/L SNP 处理的GSH+GSSG 含量分别比CK 提高了0.71%、0.90%、1.25%、2.16%、3.35%,0.5 mmol/L SNP 处理与CK 差异极显著。外源NO 各处理均不同程度的提高了3 个仁用杏品种花器官的GSH+GSSG 含量,除0.5 mmol/L SNP 处理外,‘优一’在外源NO 各处理下GSH+GSSG 含量上升幅度均高于‘龙王帽’和‘围选1 号’。‘优一’和‘龙王帽’花器官的GSH/GSSG 均随外源NO 浓度的增大呈现先上升后下降的变化趋势,均在0.4 mmol/L SNP 处理时达到最大,极显著高于CK(P<0.01),分别是CK 的1.31、1.15 倍;‘围选1 号’花器官的GSH/GSSG 随外源NO 浓度的增大而增大,在0.5 mmol/L SNP 处理时达到最大,极显著高于CK,是CK 的1.22 倍。外源NO 对3 个仁用杏品种花器官GSH/GSSG 的影响是不同的,‘优一’在外源NO 各处理下GSH/GSSG 上升幅度均高于‘龙王帽’和‘围选1 号’。
2.4 外源NO 对低温胁迫下仁用杏花器官AsAGSH 循环系统中抗氧化物酶活性的影响
2.4.1 对抗坏血酸过氧化物酶(APX)活性的影响 由图3 可知,外源NO 均可以增加3 个仁用杏品种的APX 活性。‘优一’在0.1、0.2、0.3、0.4、0.5 mmol/L SNP 处理的APX 活性分别是CK 的1.22、1.59、2.13、2.67、2.11 倍。‘龙王帽’在0.1、0.2、0.3、0.4、0.5 mmol/L SNP 处理的APX 活性分别是CK 的1.31、1.44、1.63、1.77、1.54 倍。‘围 选1号’在0.1、0.2、0.3、0.4、0.5 mmol/L SNP 处理的APX活性分别是CK的1.16、1.47、1.63、1.88、2.15倍。3 个仁用杏品种均在0.2 mmol/L SNP 处理与CK 差异显著,在0.3、0.4、0.5 mmol/L SNP 处理均与CK均呈极显著性差异(P<0.01)。
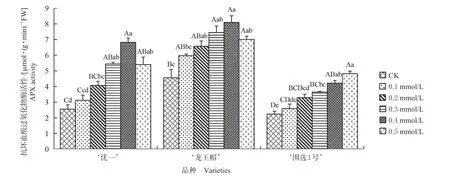
图3 外源NO 对低温胁迫下仁用杏花器官APX 活性的影响Fig.3 Effects of exogenous NO on the APX activity of kernel apricot floral organs under low temperature stress
2.4.2 对谷胱甘肽过氧化物酶(GPX)活性的影响 施加外源NO 对3 个仁用杏品种GPX 活性如图4 所示,在低温胁迫下,外源NO 各处理的GPX活性均高于CK。‘优一’0.1、0.2 mmol/L SNP 处理比CK 提高了61.67%、97.67%;0.3 mmol/L SNP处理显著高于CK,比CK 提高了130.00%;0.4 和0.5 mmol/L SNP 处理均极显著高于CK,分别比CK 提高了197.00%、163.00%。‘龙王帽’0.1、0.2 mmol/L SNP 处理与CK 无显著性差异,但分别比CK 提高了30.17%、64.07%;0.3、0.4、0.5 mmol/L SNP 处理显著高于CK,分别比CK 提高了98.64%、103.39%、101.02%。‘围选1 号’0.1、0.2、0.3、0.4、0.5 mmol/L SNP 处理分别比CK 提高了2.73%、34.13%、38.91%、65.87%、68.94%,但各处理与CK 均无显著性差异。外源NO 对3 个仁用杏品种花器官GPX 活性的影响是不同的,‘优一’在外源NO 各处理下GPX 活性上升幅度均高于‘龙王帽’和‘围选1 号’。
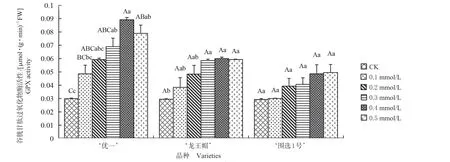
图4 外源NO 对低温胁迫下仁用杏花器官GPX 活性的影响Fig.4 Effects of exogenous NO on the GPX activity of kernel apricot floral organs under low temperature stress
2.4.3 对脱氢抗坏血酸还原酶(DHAR)活性的影响 由图5 可知,‘优一’施加外源NO 各处理DHAR 活性随外源NO 浓度的增大呈现先上升再下降的变化趋势,‘龙王帽’和‘围选1 号’施加外源NO 各处理DHAR 活性则随外源NO 浓度的增大呈现持续上升的变化趋势。‘优一’花器官喷施0.1、0.2、0.3、0.4、0.5 mmol/L SNP 处理的DHAR 活性分别是CK 的1.33、1.51、1.64、1.85、1.49 倍。当SNP 浓度为0.4 mmol/L 时,仁用杏花的DHAR 活性上升到最大值,与CK 差异极显著,0.3 mmol/L SNP 处理与CK 差异显著。‘龙王帽’花器官喷施0.1、0.2、0.3、0.4、0.5 mmol/L SNP 处理的DHAR 活性分别是CK 的1.32、1.50、1.77、1.94、1.99 倍,0.3、0.4、0.5 mmol/L SNP 处理均与CK 差异极显著。‘围选1 号’花器官喷施0.1、0.2、0.3、0.4、0.5 mmol/L SNP 处理的DHAR 活性分别是CK 的1.34、1.66、1.70、2.05、2.12 倍,0.5 mmol/L SNP 处 理 与CK差异显著。

图5 外源NO 对低温胁迫下仁用杏花器官DHAR 活性的影响Fig.5 Effects of exogenous NO on the DHAR activity of kernel apricot floral organs under low temperature stress
3 讨论与结论
3.1 讨论
低温胁迫会使植物体内的ROS 大量累积,H2O2在植物体内是ROS 的一种,具有损伤生物大分子、产生细胞毒害的能力[14]。O2-既可以和植物体内的蛋白质和核酸等活性物质直接作用,又能和H2O2反应生成攻击性更强的羟自由基,这些羟自由基则会引发膜脂过氧化反应。吴旭红[15]在外源NO 对低温胁迫下南瓜(Cucurbita moschata)幼苗氧化损伤的保护效应研究中发现,低温胁迫下,外源NO 处理可以降低南瓜幼苗H2O2含量和O2-产生速率。本试验研究表明,外源NO 处理降低了3 个品种仁用杏花器官H2O2含量和O2-产生速率,说明适宜浓度范围内的外源NO 可以减缓低温胁迫下膜脂过氧化作用进程,降低对细胞膜结构的伤害,从而在一定程度上提高仁用杏花抵抗低温的能力。
AsA-GSH 循环系统是植物组织中直接消除H2O2的酶促催化系统。AsA 和GSH 是植物体内的两种重要的非酶抗氧化物质,在AsA-GSH 循环系统中发挥着积极的作用[16]。AsA 和GSH 在清除ROS 的同时,自身被氧化形成DHA 和GSSG,再在DHAR 和GR 的还原作用下生成AsA 和GSH[17]。在逆境条件下,往往用AsA/DHA、GSH/GSSG 来表示细胞的氧化还原状态,比值越低说明细胞遭受的氧化胁迫越重[16]。本研究表明,低温胁迫下,外源NO 各处理均提高了3 个仁用杏品种的AsA、GSH、AsA+DHA、GSH+GSSG 含量和AsA/DHA、GSH/GSSG 的比值。‘优一’和‘龙王帽’均随外源NO 浓度的增大呈现先升后降的变化趋势,而‘围选1 号’则随外源NO 浓度的增大而升高,说明在一定浓度范围内,外源NO 可以促进低温胁迫下3个仁用杏品种的抗坏血酸和谷胱甘肽的合成,提高AsA-GSH 循环速率,清除低温胁迫造成的H2O2累积,从而提高仁用杏花的抗氧化能力。这与肖春燕[18]和孙兵[19]等在黄瓜(Cucumis sativusL.)和曼地亚红豆杉(Taxus media)幼苗的研究结果一致。但刘建新[6]等在探讨外源NO 对镧胁迫下燕麦(Avena nuda)幼苗的抗氧化系统调节机制中发现,外源NO 降低了镧胁迫下燕麦幼苗的AsA 和GSH 含量,这与本研究结果略有不同,可能是由于植物受到的胁迫不同以及研究的材料不同所致。‘优一’和‘龙王帽’DHA 和GSSG 含量均随外源NO 浓度的增加呈现先下降后上升的变化趋势,‘围选1 号’随外源NO 浓度的增加而减少,说明在一定浓度范围内,外源NO 可以减少仁用杏花DHA 和GSSG 含量。降低活性氧的累积对DHA 和GSSG 向AsA 和GSH转化的抑制作用,促进AsA-GSH 循环效率,提高3 种仁用杏抵抗低温胁迫的能力。这与相昆[20]等对核桃(Juglans regia)幼苗和张丽[21]对旱柳(Salix matsudanaKoidz.)叶片的研究结果一致。而李晓云[22]研究发现,外源NO 提高了铜胁迫下番茄(Lycopersicon esculentumMill.)根系的GSSG 含量,这与本研究结果相反,这可能与胁迫类型、植物种类、组织器官等有关。
APX、GPX 和DHAR 是AsA-GSH 循环系统中重要的酶,在逆境胁迫下发挥清除H2O2等ROS 的重要作用[23]。APX 和 DHAR 其活性的高低直接影响到AsA 和DHA 在AsA-DHA 库的含量[24]。本试验研究发现,不同浓度外源NO 对3 种仁用杏APX、GPX 和DHAR 活性的变化主要表现两种变化趋势,‘优一’花器官APX、GPX 和DHAR 活性随外源NO 浓度的增大呈现先上升后下降的变化趋势,‘龙王帽’花器官APX、GPX 活性与‘优一’变化趋势一致;‘围选1 号’花器官内APX、GPX和DHAR 活性随外源NO 浓度的增大而增大,‘龙王帽’花器官DHAR 活性与‘围选1 号’变化趋势一致,说明低温胁迫下,喷施适宜浓度范围的外源NO 可以提高3 个仁用杏品种花器官中APX、GPX和DHAR 活性,提高H2O2清除效率,保障了AsAGSH 循环系统的正常运转,从而缓解低温胁迫对仁用杏花器官造成的伤害。这与吴锦程[25]等在枇杷(Eriobotrya japonicaLindl.)、麻云霞[26]等在酸枣(Zizyphus jujubaMill.)幼苗上的研究结果一致。
3.2 结论
综上所述,低温胁迫下施用不同浓度的外源NO通过提高3 种仁用杏花器官AsA、GSH、AsA+DHA和GSH+GSSG 含量,提高AsA/DHA、GSH/GSSG,降 低DHA 和GSSG 含 量,并 增 大APX、GPX 和DHAR 活性,加快了仁用杏花器官AsA-GSH 循环速率,活性氧清除能力增强,抑制了H2O2的累积,降低了膜脂过氧化作用,从而提高其抵抗低温逆境的能力。本研究结果表明,‘优一’和‘龙王帽’在0.4 mmol/L SNP 处理时对花器官低温伤害的缓解作用最佳,而‘围选1 号’则在0.5 mmol/L SNP处理时对花器官低温伤害的缓解作用最佳,可为仁用杏产业的生产发展提供理论依据。
