低氧脂滴诱导相关蛋白在肝细胞癌中的表达情况及临床意义
2023-06-26刘金玮巴林超张劲夫范正军
刘金玮 巴林超 张劲夫 范正军
肝细胞癌(hepatocellular carcinoma ,HCC)是原发性肝癌中最常见的肿瘤类型,约占80%~90%,具有较高的发病率和死亡率,预后较差,全球每年因HCC导致的癌症性死亡人数在所有类型的肿瘤中居第3位[1],5年生存率<5%。目前,对于肝癌的治疗方法包括部分肝切除术、射频消融、肝动脉化疗栓塞、免疫靶向药物治疗等。近年来肝癌的治疗有所突破,但肝癌的治疗效果及预后并未取得满意的结果[2]。寻找有效的HCC预后分子并转化为临床和医疗成果至关重要。低氧脂滴诱导相关蛋白(hypoxia-induced lipid droplet-associated protein,HILPDA)又被称为缺氧诱导基因,其过表达导致肝细胞发生脂肪变性,促进肝硬化进程[3],而肝硬化是肝癌发生、发展的重要生物学过程。本研究通过生物信息学分析方法探讨HILPDA在HCC中的表达情况及其与预后之间的关系。
对象与方法
一、资料获取和筛选
从TCGA数据库(The Cancer Genome Altas, https://www.cancer.gov/about-nci/organization/ccg/research/structural-genomics/tcga)中下载HCC的项目的高通量RNA测序(RNA-sep)和病人的临床数据。TCGA共收录HCC样本424例,其中包含肿瘤组织样本374例和癌旁组织样本50例。根据要求筛选符合条件的样本:(1)基因样本量表达不为0;(2)临床信息完整。筛选后符合要求的病例373例。本研究使用R语言对以上数据进行生存分析。从TIMER数据库下载HILPDA的泛癌图。收集我院32例HCC组织及对应癌旁组织,所有均获得病人及家属同意,并获得郑州大学第一附属医院伦理委员会批准。
二、分析方法
1.HILDPA mRNA 在HCC和相应癌旁组织的表达:使用perl语言对下载筛选后的TCGA数据进行初步整理,整理R语言可读取的矩阵文件,利用R语言软件的“limma”包对提取的HILPDA基因表达量在癌旁组织和肿瘤样本的表达进行差异表达分析。使用箱线图显示HILPDA基因在癌旁组织和肿瘤样本中的不同表达水平。
2.HILPDA mRNA表达与HCC病人临床因素及预后之间的关系:TCGA数据库中下载HCC病人的临床相关资料。利用R包“survival”和“survminer”进行生存分析。根据373例肿瘤样品的HILPDA基因表达水平中位数值将HCC样本分为高、低表达组,并采用Kaplan-Meier生存曲线比较高、低表达组之间的生存差异。
3.HILPDA mRNA表达与HCC病人临床特征的相关性分析:收集HCC病人的性别、年龄、病理学分级、TNM分期等临床特征,删除临床数据不完整的样本,保留373例临床数据进行后续分析。采用χ2检验比较HILPDA基因表达水平在不同临床特征上的差异,采用单因素Cox回归计算所研究变量的风险比率(hazard ratio,HR),采用多因素Cox回归探索HILPDA mRNA 表达水平作为预后因素的独立性。
4.HCC病人预后模型的建立:采用多因素Cox回归分析和赤池信息准则(AIC)方法确定最佳预后模型。此外,通过R包rms构建列线图(Nomogram)预后预测模型。根据风险评分的中位数将病人分为高风险组和低风险组。高危组与低危组总生存期(OS)差异采用Kaplan-Meier法,双侧Log-rank检验。构建受试者工作特征(ROC)曲线,评价预后模型强度的预测精度。
5.HILPDA表达水平与HCC中免疫细胞浸润丰度的相关性分析:应用R中GSV A包中的ssGSEA(single-sample Gene Set Enrichment Analysis)方法,通过整合已发表的免疫基因列表中的基因表达水平来量化免疫细胞类型的相对肿瘤浸润水平[4]。采用Wilcoxon秩和检验和Pearson相关性分析评估免疫细胞浸润与不同HILPDA mRNA表达组之间的关系。
6.RT-PCR方法检测HCC组织中的表达:应用RNA提取液提取HCC组织及癌旁组织中总RNA,融于无酶水中。使用分光光度仪进行RNA浓度及纯度测定,当A260/A280处于1.8~2.0时,于-80 ℃超低温冰箱备用。使用逆转录试剂盒合成cDNA。引物根据Gen Bank数据HILPDA参考序列设计,HILPDA引物上游5'-TGATGGAGTCCCTAGAGGGCTTA-3'、下游5'-TCTGGATGGATGGTCTGGAAG-3',应用Universal Blue SYBR-Green qPCR Master Mix试剂盒,每个反应体系中加入Universal Blue SYBR Green qPCR Master Mix 10 μl,上下游引物各0.4 μl,cDNA 2 μl,灭菌水9.2 μl,共20 μl反应体系。采用两步扩增法,共进行40个循环。以GAPDH作为内参,根据2-ΔΔCT相对定量法计算目的基因mRNA的相对表达量。
三、统计学方法
采用Wilcoxon秩和检验和Wilcoxon符号秩检验分析HILPDA在非配对样本和配对样本中的表达情况。使用pROC包生成ROC曲线,评估HILPDA表达的诊断性能。采用Kruskal-Wallis检验、Wilcoxon符号检验、Chi-Squared检验分析临床病理特征与HILPDA表达的关系。生存曲线采用Kaplan-Meier法绘制,Log-rank检验评估组间差异。使用Cox比例风险模型进行单因素和多因素分析来估计死亡风险。P<0.05(双侧)为差异有统计学意义。采用R(3.6.1版本)和SPSS(24.0版本)进行统计分析。
结果
1.差异表达和泛癌分析:与癌旁正常组织相比,HCC肿瘤组织中HILPDA高表达(P<0.001,图1A)。配对标本中,HCC肿瘤组织中HILPDA mRNA表达高于相邻癌Pangaea癌旁组织(P<0.001)(图1B)。ROC曲线显示,HILPDA mRNA的表达量对HCC具有诊断价(AUC值为0.740, 95% CI:0.653-0.826)(图1C)。为了进一步评估人类癌症中HILPDA mRNA的表达,本研究利用TCGA的癌症RNA-seq数据检测了HILPDA mRNA的表达。肿瘤组织与癌旁正常组织间HILPDA mRNA的差异表达见图1D。与癌旁正常组织相比,TCGA数据库中几乎所有肿瘤类型中HILPDA mRNA表达均显著过表达,见图1D。

A:TCGA数据库中配对肝癌癌组织中HILPDA mRNA水平上调;B:TCGA数据库中非配对HCC癌组织中HILPDA mRNA水平上调;C:判断HILPDA具有良好诊断HCC价值的ROC曲线;D:HILPDA在TCGA数据库中不同肿瘤组织表达水平差异(P<0.01);E:在不同肝癌肿瘤大小HILPDA mRNA水平上调(P<0.001);F:HILPDA mRNA水平在HCC是否发生淋巴结转移具有差异(P<0.05);G:HILPDA mRNA水平在HCC是否发生远处器官转移无差异(P=0.32);H:HILPDA mRNA水平在不同病理分级的肝癌组织样本中有差异(P<0.001);I:HILPDA mRNA水平在不同血清AFP水平的肝癌组织样本中有差异(P<0.01)
2.HILPDAmRNA与HCC病人临床特征和预后的关系:HILPDA mRNA表达与肿瘤直径、是否发生淋巴结转移、病理分级和甲胎蛋白表达水平密切相关(图1E~I),而与是否发生器官转移(图1G)无关。本研究共有252例男性和121例女性病人,中位年龄为62岁(54~68岁)。将HCC中HILPDA mRNA的表达水平根据中位数分为低表达组和高表达组。Kaplan-Meier生存分析显示,TCGA-HCC数据集中HILPDA高表达病人的OS低于低表达组(HR=3.05,95%CI:2.10~4.22,P<0.001;图2A)。多因素Cox分析显示,HILPDA mRNA表达是HCC病人OS的独立预后因素(HR=1.254,95%CI:1.052~1.494,P<0.05)。此外,TNM分期(HR=1.593,95%CI:1.282~1.980,P<0.001)也是OS的独立预后因素(表1)。HILPDA mRNA高表达病人的无进展生存期(PFS)较低表达组更差(HR=1.670,95%CI:1.25~2.24,P=0.001)(图2B)。根据Kalan-Meier法中P值最小的方法,HILPDA mRNA表达截断值为2.099。生存分析显示,高HILPDA表达的HCC病人OS和PFS(HR=3.05,95%CI:2.10~4.42,P<0.001)较差(图2A、B)。
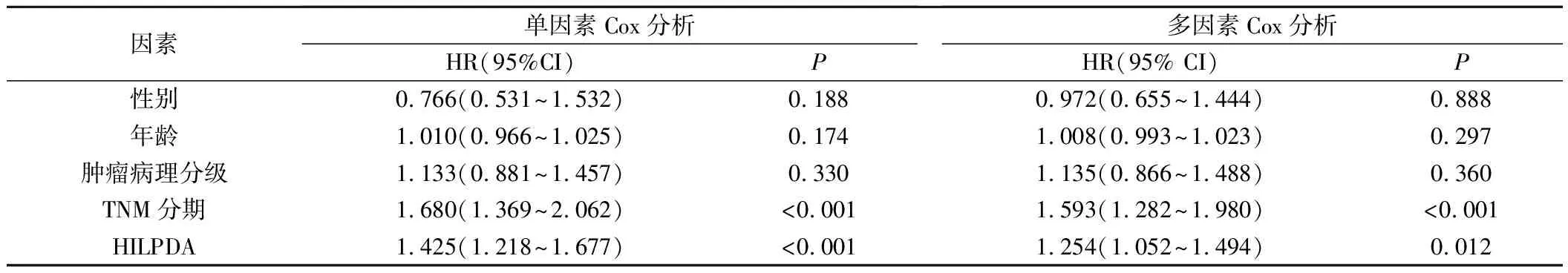
表1 HILPDA表达水平与HCC病人总生存期的单因素Cox和多因素Cox分析

A:来自TCGA数据的OS生存曲线;B:来自TCGA数据的PFI生存曲线;C:Nomogram标准曲线;D:整合了来自TCGA数据库的HCC的HILPDA和其他预后因素的Nomogram图
3.HCC预后模型的建立:通过前面的研究证实了HILPDA mRNA的高表达是HCC预后的独立危险因素。为了验证这一点,我们从TCGA数据中拟合LIHC mRNA表达和其他临床病理参数,建立了OS的预测模型。我们构建了OS的Nomogram信息图谱,整合了HILPDA与其他预后因素,包括、T分型、M分型、病理分期等(图2C)。Nomogram图示越高,预后因子越差。校准曲线评估了LIHC的Nomogram性能。通过纳入HILPDA mRNA表达水平及其他临床因素构建起独立的预后模型,能够更加简单、有效、准确的评估肝癌病人的总生存情况。
4.临床组织标本的验证:应用RT-PCR方法检测HCC组织及对应癌旁组织HILPDA的表达,结果显示,HCC组织中HILPDA表达显著高于癌旁组织(P<0.01)。见图3。

图3 HCC中HILPDA的表达
5.HILPDA表达与免疫细胞浸润的关系:考虑到GO和GSEA富集分析均发现HILPDA可能参与肿瘤免疫应答,我们进一步应用ssGSEA分析HILPDAmRNA表达与免疫细胞浸润水平的关系。免疫细胞浸润与HILPDA mRNA表达的相关性,见图4A。结果显示,HMMR mRNA表达Th2细胞(R=0.358,P<0.001,图4D)和Macrophages呈正相关(R=0.277,P<0.001,图4F)。ssGSEA也显示HILPDA表达与 T细胞(R=0.029,P=0.579,图4A)、B细胞(R=0.016,P=0.725,图4B)、Th1细胞(R=0.081,P=0.117,图4B)和NK细胞无关(R=0.001,P=0.988,图4E)。

A:HILPDA表达与T细胞浸润无相关性;B:HILPDA表达与B细胞浸润无相关性;C:HILPDA表达与Th1细胞浸润不相关;D:HILPDA表达与Th2细胞浸润呈显著正相关;E:HILPDA表达与NK细胞浸润无相关性;F:HILPDA表达与Macrophages细胞浸润呈显著正相关
讨论
HILPDA是在缺氧的情况下形成的一种蛋白,也被认为是一个肿瘤抗原,在细胞类型癌中的发生、发展过程中起到了诱导作用,而HCC作为细胞癌中的其中一个类型[5-6]。相关研究表明,HILPDA mRNA 在富含脂质的细胞类型中过表达,包括结直肠癌和肾透明细胞癌[6],在肿瘤的发生、发展中发挥重要作用,甚至参与了肿瘤对血管的侵犯和远处转移[7]。众所周知,HCC的肝硬化背景引起的门静脉高压会导致肝脏血流减少而使肝细胞处于相对缺氧的状态,这种情况会可能导致HILPDA表达上调,并且这种反应也与增加的甘油三酯和脂滴积累相关,可调节富含脂质的肿瘤正向调控,从而促进肿瘤细胞的生长、增殖等[8]。
本研究表明,HCC中缺氧诱导的脂滴相关蛋白高表达,通过收集HCC组织及对应癌旁组织标本应用RT-PCR检测HILPDA的表达并进行差异分析也验证了这一点,这一结果在神经内分泌瘤、胃癌、肾细胞癌和膀胱癌等多种癌症中的高表达情况一致[9]。TCGA数据库中大多数的肿瘤HILPDA显著表达,表明HILPDA有望成为这些癌症的诊断生物标志物。通过ROC曲线我们找到HILPDA mRNA的AUC值为0.740,表明根据HILPDA的表达有助于区别HCC病人与普通病人。在肝癌的研究分析表明,HILPDA的基因表达水平与肝癌的生物学特性及临床预后密切相关。Nishimura等[10]研究表明,根据HILPDA的表达可作为早期卵巢透明细胞癌的预测因子和反应化疗的生物标志物。通过分析临床病例特征的关系还发现,HILPDA的表达情况与肿瘤直径、淋巴结转移、病理学分期和血清甲胎蛋白水平相关,这些结果提示,HILPDA基因的表达可能会促进肝癌的进展。
分析HILPDA的表达和预后的关系显示,在HCC中高表达HILPDA与预后不良相关。通过对TCGA中HCC数据生存分析显示,HILPDA mRNA高表达的病人OS和PFS生存较差,而多因素分析也证实了HILPDA mRNA也是OS和PFS的独立预后因素。大量研究表明,HILPDA可能是胰腺癌、神经胶质肿瘤、肾细胞癌、肺细胞癌等肿瘤的不良预后生物标志物[11-14]。考虑到HILPDA有望成为一个预后指标,根据HILPDA的表达情况和相关的临床数据构建了Nomogram预测模型。Nomogram图可精准的预测3~5年的OS,诺波图也可以帮助筛查高危病人,并确定为HCC的病人制定更加积极的治疗方案作为警醒作用。
作为Wnt信号通路的因子及HIF1特异性下游靶基因,HILPDA可参与调控肿瘤细胞增殖、血管生成、能量代谢等过程[12,15]。通过基因集富集分析发现HILPDA表达与Th1细胞、Th2细胞和Macrophage浸润呈正相关,而与T细胞、B细胞和NK细胞浸润不相关,提示HILPDA可能有助于参与HCC的免疫逃逸机制。肿瘤相关巨噬细胞可参与HCC免疫应答的调控机制以及产生一些细胞因子[16],由于HILPDA是一种天然的免疫肿瘤抗原,它的高表达有助于肿瘤免疫微环境的浸润,并与肿瘤免疫抑制的状态相关[17],这提示HILPDA可能是肝癌治疗的一个新的靶点,考虑到HILPDA会导致恶性肿瘤的进展,使用HILPDA蛋白可能是治疗HCC的一个新的治疗方法。
研究发现,HILPDA高表达是HCC的不良预后的一个因素。本研究提高了我们对HILPDA与HCC关系的认识,但也存在局限性。首先,缺乏体内实验经验,结果无法得到验证。由于研究设计的局限性,可能遗漏了与HILPDA相关的其他关键信号通路。
综上所述,HCC中HILPDA mRNA表达过高,且高HILPDA mRNA与较差的OS和PFS有关。富集分析提示,HILPDA可能通过调节肿瘤细胞的免疫微环境,并通过促进Th2、Macrophages细胞浸润抑制适应性免疫而成为致瘤因子。本研究证明HILPDA是一种潜在的诊断和预后的生物标志物,也是一种潜在的免疫治疗靶点。
