乳腺癌改良根治术后放疗所致的放射性肺炎危险因素分析
2023-06-25王鑫徐枫姜阳王志超林洋高佳
王鑫 徐枫 姜阳 王志超 林洋 高佳
【摘要】 目的:研究乳腺癌改良根治术(MRM)后放疗所致的放射性肺炎(RP)影响因素。方法:选取2017年2月-2020年2月佳木斯市妇幼保健院收治的241例乳腺癌患者。按照是否发生RP将患者分为肺炎组37例及无肺炎组204例,分析两组临床资料及放疗剂量学参数的差异。采用logistic回歸分析MRM后放疗所致RP的影响因素。结果:肺炎组贫血及化疗人数占比均高于无肺炎组(P<0.05)。两组年龄、绝经、临床分期、放疗前内分泌治疗、放疗模式及放疗技术比较,差异均无统计学意义(P>0.05)。肺炎组计划靶体积1(PTV1)、计划靶体积2(PTV2)、接受5 Gy照射的肺体积占全肺体积的百分比(V5)、接受10 Gy照射的肺体积占全肺体积的百分比(V10)、接受20 Gy照射的肺体积占全肺体积的百分比(V20)及全肺平均耐受剂量(MLD)均高于无肺炎组(P<0.05)。logistic回归分析显示贫血及V5均是MRM后放疗发生RP的独立危险因素(P<0.05)。结论:MRM后放疗所致放射性肺炎影响因素包括贫血及V5。
【关键词】 乳腺癌改良根治术 放疗 放射性肺炎
Analysis of Risk Factors of Radiation Pneumonia Caused by Radiotherapy after Modified Radical Mastectomy for Breast Cancer/WANG Xin, XU Feng, JIANG Yang, WANG Zhichao, LIN Yang, GAO Jia. //Medical Innovation of China, 2023, 20(10): -147
[Abstract] Objective: To study and analyze the influencing factors of radiation pneumonia (RP) caused by modified radical mastectomy (MRM) radiotherapy for breast cancer. Method: A total of 241 breast cancer patients admitted to Jiamusi Maternal and Child Health Hospital from February 2017 to February 2020 were selected, according to RP or not, the patients were divided into pneumonia group (37 cases) and non-pneumonia group (204 cases). The differences of clinical data and radiotherapy dosimetry parameters between the two groups were analyzed. logistic regression was used to analyze the influencing factors of RP caused by radiotherapy after MRM. Result: The proportion of patients with anemia and chemotherapy in the pneumonia group were higher than those in the non-pneumonia group (P<0.05). There were no significant differences in age, menopause, clinical stage, pre-radiotherapy endocrine therapy, radiotherapy mode and radiotherapy technique between the two groups (P>0.05). In the pneumonia group, planned target volume 1 (PTV1), planned target volume 2 (PTV2), percentage of lung volume irradiated by 5 Gy in total lung volume (V5), percentage of lung volume irradiated by 10 Gy in total lung volume (V10), percentage of lung volume irradiated by 20 Gy in total lung volume (V20), and mean whole lung tolerated dose (MLD) were higher than those in non-pneumonia group (P<0.05). logistic regression analysis showed that anemia and V5 were independent risk factors for RP after MRM radiotherapy (P<0.05). Conclusion: The influencing factors of RP caused by MRM radiotherapy for breast cancer include anemia and V5.
[Key words] Modified radical mastectomy Radiation therapy Radiation pneumonia
First-author's address: Jiamusi Maternal and Child Health Hospital, Heilongjiang Province, Jiamusi 154002, China
doi:10.3969/j.issn.1674-4985.2023.10.034
乳腺癌作为特发于女性的生殖系统恶性病变之一,受婚育年龄不断推迟及人类生活方式日益转变等因素的影响,其发病率有明显的逐年升高趋势,对女性生命安全造成极大威胁[1-2]。另有相关调查资料表明,乳腺癌发病率在女性恶性肿瘤中占比最高,且死亡率亦位居前列[3]。随着近年来医疗水平的日益提高,乳腺癌改良根治术(MRM)开始在临床上得到广泛应用,有利于延长患者的生存时间,且放疗是有效的补充治疗方案,可改善患者预后[4]。放射性肺炎(RP)属于乳腺癌常见的一种并发症,可能对患者的预后产生不利影响[5]。鉴于此,本文通过研究MRM后放疗所致RP的影响因素,以期为临床干预提供参考依据,现报道如下。
1 资料与方法
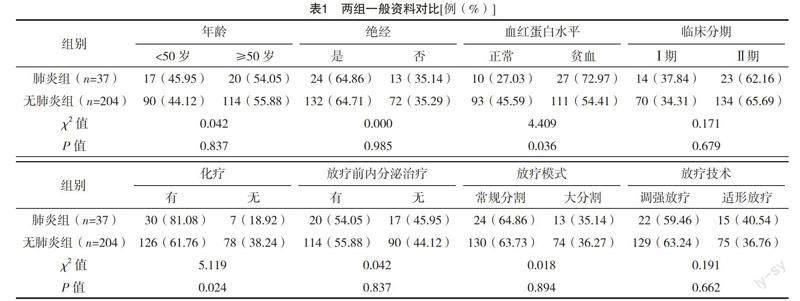
1.1 一般资料 选取2017年2月-2020年2月佳木斯市妇幼保健院收治的241例乳腺癌患者。纳入标准:(1)所有受试者均经组织病理学确诊;(2)经影像学评估结果显示为Ⅰ、Ⅱ期;(3)均行MRM治疗,且存在术后放射治疗指征,且均接受规范放疗;(4)均为成年人;(5)美国东部肿瘤协作组(ECOG)评分为0、1分。排除标准:(1)术后切缘阳性;(2)因故未按照计划完成放疗;(3)既往有无法控制的呼吸系统疾病;(4)长期接受糖皮质激素治疗;(5)入组前半年有急性肺炎等呼吸系统疾病;(6)正参与其他研究。年龄33~79岁,平均(52.39±10.26)岁;绝经156例,非绝经85例;血红蛋白水平正常103例,贫血138例;临床分期:Ⅰ期84例,Ⅱ期157例;化疗156例,非化疗85例;放疗前内分泌治疗134例,无放疗前内分泌治疗107例;放疗模式:常规分割154例,大分割87例;放疗技术:调强放疗151例,适形放疗90例。入组人员均已签同意书,医院内部评审委员会批准。
1.2 方法 (1)基线资料评价:以问卷的方式收集所有受试者的基线资料。内容涵盖以下8项:年龄、绝经状态、血红蛋白水平(贫血标准:血红蛋白水平<110 g/L;正常标准:血红蛋白水平≥110 g/L)、临床分期、化疗与否、放疗前内分泌治疗、放疗模式、放疗技术。(2)分组方式:将所有受试者按照是否发生RP分为肺炎组(37例)及无肺炎组(204例)。其中RP判定标准参照文献[6]《腫瘤放射治疗学》中相关标准:放射治疗过程中出现干咳或呼吸困难,将≥1级的放射性肺损伤统计为RP。(3)放射参数:包括计划靶体积1(PTV1)、计划靶体积2(PTV2)、接受5 Gy照射的肺体积占全肺体积的百分比(V5)、接受10 Gy照射的肺体积占全肺体积的百分比(V10)、接受20 Gy照射的肺体积占全肺体积的百分比(V20)以及全肺平均耐受剂量(MLD)。
1.3 统计学处理 采用SPSS 24.0软件实现数据处理,计量资料以(x±s)表示,比较采用t检验;计数资料以率(%)表示,比较采用字2检验。采用logistic回归分析MRM后放疗所致RP的影响因素。P<0.05为差异有统计学意义。
2 结果
2.1 两组一般资料对比 肺炎组贫血及化疗人数占比均高于无肺炎组(P<0.05)。两组年龄、绝经、临床分期、放疗前内分泌治疗、放疗模式及放疗技术等情况比较,差异均无统计学意义(P>0.05)。见表1。
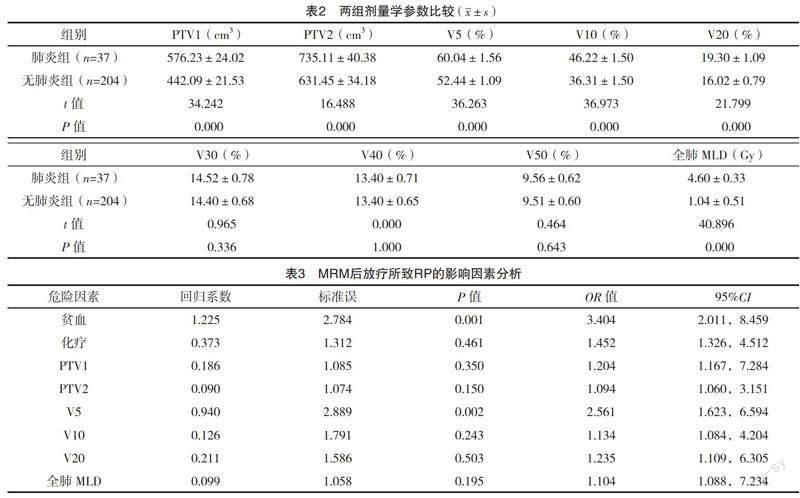
2.2 两组剂量学参数比较 肺炎组PTV1、PTV2、V5、V10、V20及全肺MLD均高于无肺炎组(P<0.05)。两组V30、V40、V50比较,差异均无统计学意义(P>0.05)。见表2。
2.3 MRM后放疗所致RP的影响因素分析 以MRM后放疗所致RP为应变量,赋值如下:RP=1,无RP=0。以血红蛋白水平、化疗及各项剂量学参数为自变量,赋值如下:贫血=1,无贫血=0;化疗=1,无化疗=0;各项剂量学参数均为原值输入。经logistic回归分析可得:贫血及V5均是MRM后联合放疗所致RP的独立危险因素(P<0.05)。见表3。
3 讨论
时至今日,有关乳腺癌的病因和发病机制仍存在不小的争议,目前主要认为可能和遗传、生活方式及基因突变等因素相关。随着近年来乳腺癌早期诊断技术的飞速发展,越来越多的患者开始获得手术治疗的机会,MRM在临床上的应用效果已得到广泛认可,且和放疗联合应用时的效果更为理想[7]。相关研究报道表明,乳腺癌根治术后放疗所致的RP是影响患者预后及生存质量的重要并发症之一,其发生过程相对复杂,涉及多种基因、因子、细胞及信号通路[8-9]。因此,如何有效预防及采取针对性措施干预是目前临床研究的热点和难点。对放疗所致的RP实施有效的评估及管理,有助于改善患者的生存质量,由此可见分析RP的相关影响因素显得尤为重要。
一项关于606例保乳术后放疗的乳腺癌患者回顾性研究显示,RP的发生率在2%左右[10-11]。另有研究报道发现乳腺癌患者放疗后的RP发生率为10.6%[12-14]。而本研究结果显示,241例MRM后放疗患者中发生RP为37例,发生率为15.35%,明显高于上述两项研究结果。导致上述差异发生的主要原因可能和研究纳入对象的基础状态及纳入标准不同有关,本研究主要是将≥1级的放射性肺损伤统计为RP,势必增加了RP的例数。此外,经logistic回归分析显示:贫血及V5均是MRM后放疗所致RP的独立危险因素。这提示了MRM后放疗所致RP的发生可能和贫血及肺叶受照射剂量密切相关。考虑原因,贫血患者相较于血红蛋白水平正常的乳腺癌患者,其体内的乏氧细胞明显增多,可抑制肺组织的携氧能力,进一步引起肺损伤,但关于其具体作用机制尚未彻底阐明,有待进一步研究证实,亦为今后的研究提供了新的方向[15-17]。而随着靶体积的增加,肺部受高剂量照射的风险随之增加,进一步导致放射性肺损伤的发生概率增加[18-19]。然而,文献[20-21]报道差异性放疗技术及放疗计划设计对肺组织的评估及剂量存在明显的差异,且呼吸动度的改变可能影响肺部实际照射剂量,进一步导致结果发生偏颇。
综上所述,MRM后放疗所致RP的发生可能与贫血和V5剂量有关,临床实际工作中,可能通过改善乳腺癌患者的贫血状态和/或于放疗剂量参数的限制中重点关注V5的剂量,进而达到预防RP发生的目的。
参考文献
[1]穆凌光,孟少华,范秀廷,等.乳腺癌改良根治术患者术后复发转移影响单因素及Logistic回归分析[J].中国妇幼保健,2018,33(16):3788-3790.
[2]黄州,王淑莲,唐玉,等.乳腺癌新辅助化疗后改良根治术后放疗开始时间对预后的影响[J].中华放射肿瘤学杂志,2019,28(4):280-285.
[3]许晓峰,李硕,熊伟坚,等.高分辨率CT在乳腺癌放疗后放射性肺炎早期诊断中的应用[J].影像诊断与介入放射学,2013,22(4):255-257.
[4]戴芳芳,崔勇,李冠龙,等.放射性肺炎的发病机制及中西医结合治疗进展[J].现代中西医结合杂志,2018,27(6):678-681.
[5]罗菊锐,陈星星,杨昭志,等.早期乳腺癌保乳术后大分割放疗Ⅱ期临床研究——中期安全性及有效性分析[J].中国癌症杂志,2018,28(10):769-775.
[6]殷蔚伯,余子豪,徐国镇,等.肿瘤放射治疗学[M].北京:中国卸货医科大学出版社,2008.
[7]李侃,杜庆安.乳腺癌改良根治术后调强放疗与常规放疗疗效及对心肺的影响[J].中国医学物理学杂志,2021,38(2):168-171.
[8]张顺康,孙丽云,陈刚,等.乳腺癌改良根治术后放疗患者上肢淋巴水肿与腋淋巴结手术结果的相关性分析[J].中国癌症杂志,2018,28(1):55-61.
[9]岳雁鸿,王瑶,曾燕.保乳术、改良根治术和改良根治术联合放疗治疗三阴性乳腺癌术后局部复发情况比较[J/OL].中华普外科手术学杂志:电子版,2019,13(2):177-179.https://med.wanfangdata.com.cn/Paper/Detail?id=PeriodicalPaper_zhptwksszz201902021&dbid=WF_QK.
[10]李彬,王吉明,马玉平,等.曲妥珠单抗联合化疗序贯放疗对乳腺癌改良根治术患者的临床疗效及早期心脏毒性事件的影响[J].解放军预防医学杂志,2019,37(2):128-130.
[11]张永伟.乳腺癌适形放疗术后放射性肺炎的危险因素分析[J].中国现代医学杂志,2014,24(7):99-102.
[12]俞文方,章健,王笑娟,等.乳腺癌术后放射性肺炎合并肺部感染病原菌及Th17/Treg水平[J].中華医院感染学杂志,2021,31(3):444-448.
[13]骆雯,王勇,唐仕敏,等.不同分割放疗方式对糖尿病患者乳腺癌根治术后放射性肺炎发生的影响[J].现代肿瘤医学,2019,27(16):2879-2882.
[14]李惠平,王俊杰,马力文,等.乳腺癌放、化疗致放射性肺炎与相关因素分析[J].中华放射医学与防护杂志,2004,24(6):507-509.
[15] WERNER E M,EGGERT M C,BOHNET S,et al.Prevalence and characteristics of pneumonitis following irradiation of breast cancer[J].Anticancer Res,2019,39(11):6355-6358.
[16] HO A Y,BALLANGRUD A,LI G,et al.Long-term pulmonary outcomes of a feasibility study of inverse-planned, multibeam intensity modulated radiation therapy in node-positive breast cancer patients receiving regional nodal irradiation[J].Int J Radiat Oncol Biol Phys,2019,103(5):1100-1108.
[17]张豪,林权冰,池周.乳腺癌改良根治术后放疗诱发放射性肺炎的危险因素分析[J].中国妇幼健康研究,2021,32(3):395-400.
[18] TARO M,TAKESHI T,TADASHI N,et al.Clinical evaluation of Onrad,a new low-cost version of tomotherapy that uses only static beams[J].Kurume Med J,2020,65(4):129-136.
[19] MO J C,HUANG J,GU W D,et al.A dosimetric comparison of double-arc volumetric arc therapy, step-shoot intensity modulated radiotherapy and 3D-CRT for left-sided breast cancer radiotherapy after breast-conserving surgery[J].Technol Health Care,2017,25(5):851-858.
[20] YEH T C,CHI M S,CHI K H,et al.Evaluation of abches and volumetric modulated arc therapy under deep inspiration breath-hold technique for patients with left-sided breast cancer: a retrospective observational study[J].Medicine (Baltimore),2019,98(39):17340-17341.
[21]王雪辉,王君,万树芳,等.乳腺癌改良根治术后发生上肢淋巴水肿的相关危险因素及其干预措施分析[J].中国医学创新,2021,18(15):132-135.
(收稿日期:2022-08-01) (本文编辑:张明澜)
