常润茶服用方法对蒽醌类物质溶出的影响及其通便作用的相关性研究
2023-06-23武洁陈彦陶然费文婷王金凤张建军张悦田世民郑立新王林元
武洁 陈彦 陶然 费文婷 王金凤 张建军 张悦 田世民 郑立新 王林元


摘要 目的:以常潤茶为例研究蒽醌类物质的加水量及浸泡次数等服用方法对有效成分溶出及通便作用的影响。方法:利用紫外分光光度法建立总蒽醌的含量测定方法,利用高效液相色谱法建立番泻苷A、番泻苷B、大黄酸的含量测定方法,考察不同浸泡次数、加水量下常润茶水浸液中有效物质的含量变化。利用洛哌丁胺复制便秘模型进行通便作用的验证并探究常润茶对肠动力及黏液分泌的影响,观察不同浸泡次数、加水量对小鼠小肠推进率、首粒排黑便时间、5 h黑便粒数、粪便含水量以及结肠胃动素(MTL)、促胃液素(GAS)、生长抑素(SS)、P物质(SP)的影响。结果:加水量与蒽醌类物质的溶出正相关,加水60~100倍蒽醌类物质溶出差异不大;浸泡1次可将大部分蒽醌类物质溶出,从第2次浸泡开始,总蒽醌、番泻苷A、番泻苷B、大黄酸的含量均明显减小。动物实验结果显示加水倍数为40倍、60倍、100倍时,常润茶均可有通便作用,未出现腹泻等不良反应,60倍、100倍水量通便作用显著。加水100倍,反复冲泡多次通便作用不优于浸泡1次。结论:本实验为产品的精准应用提供实验依据,对于规范蒽醌类产品具有积极意义。
关键词 常润茶;通便;蒽醌;高效液相色谱法;紫外分光光度法;番泻苷A;番泻苷B;大黄酸
Effect of Taking Methods of Besunyen Detox Tea on Dissolution of Anthraquinones and Laxation
WU Jie1,CHEN Yan1,TAO Ran1,FEI Wenting1,WANG Jinfeng1,ZHANG Jianjun2,ZHANG Yue3,Tian Shimin3,4,ZHENG Lixin3,4,WANG Linyuan1
(1 School of Chinese Materia Medica,Beijing University of Chinese Medicine,Beijing 100029,China; 2 School of Traditional Chinese Medicine,Beijing University of Chinese Medicine,Beijing 100029,China; 3 Chinese Academy of Inspection and Quarantine Comprehensive Test Center,Beijing 100123,China; 4 CAIQTEST(Beijing) Co.,Ltd.,Beijing 100176,China)
Abstract Objective:To observe the effect of taking methods of Besunyen Detox Tea(water addition and soaking times) on dissolution of anthraquinones and laxation.Methods:The content determination method of total anthraquinone was established by ultraviolet spectrophotometry(UV),and that of sennoside A,sennoside B and rhein was established by high-performance liquid chromatography(HPLC),to investigate the content variation of effective substances in Besunyen Detox Tea under different soaking times and water addition.The constipation model was constructed by loperamide to verify the laxative effect of Besunyen Detox Tea and explore its effect on intestinal motility and mucus secretion.The influence of different soaking times and water addition on propulsion rate of mouse small intestine,first melena time,melena times within 5 h,fecal water content,and colon motilin(MTL),gastrin(GAS),somatostatin(SS) and substance(SP) was also investigated.Results:Water addition was proportional to the dissolution of anthraquinones,and there was little difference in the dissolution of anthraquinones when the water addition was 60~100 times.Most anthraquinones were dissolved by soaking once,and from the second soaking,the contents of total anthraquinone,sennoside A,sennoside B and rhein were decreased significantly.The animal experiments revealed that when the water addition was 40 times,60 times and 100 times,Besunyen Detox Tea produced a laxative effect,and no adverse reactions such as diarrhea occurred.The laxative effect of Besunyen Detox Tea added with water of 60 times and 100 times was obvious.Moreover,water addition of 100 times and repeated brewing failed to be better than soaking once in laxative effect.Conclusion:This experiment provided a basis for precise application of the product and had positive significance for the standardization of anthraquinone products.
Keywords Besunyen Detox Tea; Laxation; Anthraquinone; High-performance liquid chromatography(HPLC); Ultraviolet spectrophotometry(UV); Sennoside A; Sennoside B; Rhein
中图分类号:R256.35文献标识码:Adoi:10.3969/j.issn.1673-7202.2023.01.005
便秘是临床常见肠道疾病,蒽醌类中药如番泻叶、芦荟、决明子等由于其作用强、起效快被广泛应用。临床研究与现代药理学研究表明,长期使用蒽醌类中药可能会造成消化系统、泌尿系统、免疫系统、呼吸系统、生殖系统的毒性,引起结直肠黑变病、药物性肝损伤、药物性肾损伤等不良反应,蒽醌类物质的安全性也引起了关注和争议。
蒽醌类物质既是发挥通便功能的有效成分,也是引起争议的潜在毒性成分[1]。基于此,本研究以含有番泻叶、决明子等药味的常润茶为例,建立常润茶水浸液中蒽醌类总成分及番泻苷A、番泻苷B及大黄酸单一成分含量测定方法,将药学实验与动物实验相结合优化服用方式,探讨中药复方蒽醌类成分与通便作用及机制的关联,为含蒽醌类中药复方的精准应用提供实验。
1 材料与方法
1.1 材料
1.1.1 动物 无特定病原体(Specific Pathogen Free,SPF)级4~6周龄健康雄性昆明小鼠,体质量20~22 g,采购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2021-0011,饲养于中国检验检疫科学研究院综合检测中心SPF级动物房,实验期间小鼠自由饮水,动物房室温为20~22 ℃,相对湿度60%~70%,12 h灯照、黑暗模拟昼夜交替。实验符合相关伦理要求(伦理审批号:2021-FD-003)。
1.1.2 药物 常润茶(北京澳特舒尔保健品研究公司,批号:01200703);洛哌丁胺胶囊(西安杨森制药有限公司,批号:LFJ8473)。
1.1.3 试剂与仪器 番泻苷A对照品(质量分数≥98%)(批号:J09J12T136760)、番泻苷B对照品(质量分数≥98%)(批号:Y21A11Y121808)、大黄酸对照品(质量分数≥98%)(批号:T06J10F92311)、1,8-二羟基蒽醌(质量分数≥97%)(批号:M21GB149395),以上均采购自上海源叶生物科技有限公司;小鼠胃动素酶联免疫吸附试验试剂盒(批号:20220301-20682A)、小鼠生长抑素酶联免疫吸附试验试剂盒(批号:20220301-20618A)、小鼠P物质酶联免疫吸附试验试剂盒(批号:20220301-20732A)、小鼠促胃液素酶联免疫吸附试验试剂盒(批号:20220301-20684A),以上试剂盒均采购自上海酶联生物科技有限公司;总蛋白定量测试盒(南京建成生物工程研究所,批号:20210301-95871C);Waters高效液相色谱仪(Waters公司,美国,型号:Waters E2695型),紫外-可见分光光度计(北京普析通用仪器有限责任公司,型号:T6新世纪型),电热鼓风干燥箱(天津市泰斯特仪器有限公司,型号:101-1AB型),电热恒温水浴锅(天津市泰斯特仪器有限公司,型号:SYG-A2-6型),电子天平(慈溪市华徐衡器实业有限公司,型号:SB5002型),精密电子天平(上海浦春计量仪器有限公司,型号:BSA224S型)等。
1.2 方法
1.2.1 总蒽醌的含量测定
1.2.1.1 对照品溶液的制备 1,8-二羟基蒽醌标准溶液配制:精密称取1,8-二羟基蒽醌标准品5.00 mg(精确至0.01 mg),置25 mL容量瓶中,用甲醇溶解并稀释至刻度,摇匀,制成0.2 mg/mL的溶液。
1.2.1.2 供试品溶液的制备 称取常润茶内容物1.0 g,置空白包装袋中,加水100 mL,于90 ℃水浴锅上浸提15 min,提取液置水浴锅上蒸干,加入甲醇-盐酸(10∶1)混合溶液25 mL,称重,在80 ℃水浴中加热回流30 min,放冷,甲醇补足失重,摇匀,滤过,弃去初滤液,精密量取续滤液15 mL至分液漏斗中,加水25 mL,用二氯甲烷萃取3次(50 mL、40 mL、30 mL),合并提取液,用水洗涤3次,每次40 mL,洗至中性,弃去水洗液,二氯甲烷层移至蒸发皿中水浴蒸干,残渣加甲醇溶解并转移至10 mL容量瓶中,甲醇定容至刻度,摇匀。
1.2.1.3 显色与测定 精密量取供试品溶液2 mL,置于25 mL容量瓶中,加混合碱溶液稀释并定容至刻度,混匀,作为待测液。该溶液于暗处放置30 min显色,显色结束后用0.45 μm微孔滤过滤,以混合碱溶液作空白对照,测定吸光度并计算总蒽醌含量。
1.2.2 番泻苷A、番泻苷B及大黄酸的含量测定
1.2.2.1 色谱条件 色谱柱为Diamonsil-C18(250 mm×4.6 mm,5 μm);流动相为甲醇(A)-0.1%磷酸水溶液(B),梯度洗脱程序:0~5 min,40%A;5~25 min,40%~45%A;25~32 min,45%~80%A;32~47 min,80%~100%A;体积流量1.0 mL/min;柱温35 ℃;进样量10 μL。检测波长为254 nm。
1.2.2.2 溶液制备 1)供试品溶液配制:取常润茶内容物,混合均匀后精密稱重1.0 g,置于空白包装袋中,加水100 mL置90 ℃水浴锅中浸提15 min,浓缩,转移至10 mL容量瓶中,加水稀释并定容,摇匀,即得。2)混合对照品溶液配制:精密称取大黄酸对照品5.13 mg,置于50 mL容量瓶中,加0.1%NaHCO3水溶液溶解并定容至刻度,即得大黄酸对照品溶液。另精密称取番泻苷A 9.21 mg、番泻苷B 6.19 mg,置于10 mL容量瓶中,精密移取4 mL大黄酸对照品溶液,0.1%NaHCO3水溶液溶解并稀释至刻度,作为混合对照品溶液。3)阴性对照品溶液配制:按照常润茶处方比例称取除番泻叶、决明子之外的其他药材,依照常润茶制备工艺及供试品溶液的制备方法,制成阴性对照品溶液。
1.2.3 不同浸泡水量对常润茶水浸液中蒽醌类物质溶出的影响 取出同一批次的常润茶样品,拆开包装将其混匀后等分,从每一份中精密称取1.0 g,重新封入干净的茶包。分别用10 mL、20 mL、40 mL、60 mL、80 mL、100 mL纯净水于90 ℃水浴加热15 min,提取1次,分别得10倍、20倍、40倍、60倍、80倍、100倍浸泡水量的常润茶水浸液,同一加水量平行操作2份,继续按照上述方法制备供试品溶液,测定水浸液中总蒽醌、番泻苷A、番泻苷B及大黄酸的含量。
1.2.4 不同浸泡次数对常润茶水浸液中蒽醌类物质溶出的影响 取出同一批次的常润茶样品,拆开包装后将其混匀后等分,从每一份中精密称取1.0 g,重新封入干净的茶包。用100 mL纯净水于90 ℃水浴加热15 min,分别提取1次、2次、3次、4次,得不同浸泡次数的常润茶水浸液,同一浸泡次数平行操作2份,继续按照上述方法制备供试品溶液,测定水浸液中总蒽醌、番泻苷A、番泻苷B及大黃酸的含量。
1.2.5 动物实验研究
1.2.5.1 药物配制 不同浸泡水量常润茶受试物的制备:取1 g样品于常压条件下,分别加水40 mL、60 mL、100 mL于95 ℃水浸泡15 min,提取1次,配制成浓度为0.008 3 g/mL的药液(常润茶规格为2.5 g/袋,2袋/d,以人体推荐10倍用量为小鼠等效剂量,人体质量以60 kg计,小鼠日服用量为0.083 3 g/kg体质量),分别为40倍、60倍、100倍浸泡水量的常润茶受试液,4 ℃冷藏,备用。不同浸泡次数常润茶受试物的制备:取1 g样品于常压条件下,加100 mL水(100倍浸泡水量)浸泡15 min,分别提取1次、2次、4次,将提取液合并,蒸发浓缩至一定体积,配制成浓度为0.008 3 g/mL的药液,即得不同浸泡次数的常润茶受试液,4 ℃冷藏,备用。洛哌丁胺混悬液的制备:将洛哌丁胺胶囊溶于水,超声加热使其混合均匀,分别配制成浓度为0.4 mg/mL、0.7 mg/mL的混悬液。4 ℃冷藏,用前摇匀。
1.2.5.2 分组与模型制备 雄性昆明小鼠112只,适应性喂养5 d后随机分为7组,即空白组、便秘模型组(模型组)、常润茶40倍水量组(常40组)、常润茶60倍水量组(常60组)、常润茶100倍水量浸泡1次组(常100组)、常润茶浸泡2次组(常2次组)、常润茶浸泡4次组(常4次组),每组16只。造模方法:末次灌胃后每组随机选择8只小鼠禁食不禁水20 h,除空白组外各组一次性灌胃洛哌丁胺混悬液7 mg/kg,观察小鼠首粒排黑便时间和5 h黑便粒数,剩余小鼠禁食不禁水16 h,除空白组外各组一次性灌胃洛哌丁胺混悬液4 mg/kg,空白组给蒸馏水,测定小鼠小肠推进率及结肠胃肠激素相关指标。灌胃体积为0.01 mL/g。
1.2.5.3 给药方法 各给药雄性昆明小鼠每天上午灌胃常润茶水浸液,以常润茶40倍水量(常40组)、常润茶60倍水量(常60组)、常润茶100倍水量浸泡1次(常100组)、常润茶浸泡2次(常2次组)、常润茶浸泡4次进行给药,空白组和模型组小鼠每天灌胃等体积蒸馏水,灌胃体积为0.01 mL/g,连续给药7 d。
1.2.5.4 检测指标与方法 1)一般状态观察及小鼠体质量:每天观察各组小鼠皮毛色泽、自主活动及精神状态,分别在给药第0天、第4天、第7天上午记录各组小鼠体质量的变化。2)首粒排黑便时间、5 h黑便粒数:灌胃洛哌丁胺0.5 h后,空白组和模型组小鼠用墨汁灌胃,常润茶各剂量小鼠给予含受试样品的墨汁,从灌胃墨汁开始记录每只动物首粒排黑便时间、5 h内排黑便粒数,动物均单笼饲养,正常饮水进食。3)小肠推进率:灌胃洛哌丁胺后0.5 h后,各剂量小鼠分别给予含相应受试样品的墨汁,空白组和模型组用墨汁灌胃。25 min后摘眼球取血后立即脱颈椎处死动物,测定小肠推进率。小肠推进率(%)=墨汁推进长度(cm)/小肠总长度(cm)×100%。4)粪便含水量:于给药第7天上午灌胃后将每组小鼠单独置于饲养笼中,禁食禁水20 min,避开被水或者小鼠尿液浸泡的粪便,选取新鲜粪便置于离心管中,称取粪便湿重并记录,放入恒温鼓风干燥箱中烘干,迅速取出样品称取干重,计算粪便含水量。粪便含水量(g)=(粪便湿重-粪便干重)/粪便湿重。5)结肠胃肠激素指标检测:小鼠脱颈处死后,在结肠处取1~3 cm长的肠组织,立即液氮冻存。按组织∶生理盐水=1∶9比例冰上匀浆,以3 000 r/min,离心半径6 cm,低温离心15 min,取上清液。采用酶联免疫吸附试验法检测胃动素(Motilin,MTL)、促胃液素(Gastrin,GAS)、生长抑素(Somatostatin,SS)、P物质(Substance P,SP)。
1.2.5.5 统计学方法 采用SPSS 20.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,进行正态分布及方差齐性检验。数据呈正态分布,组间比较用单因素方差分析,两两比较方差齐性采用最小显著性差异(LSD)法进行统计分析;方差不齐性采用Dunnett′s T3进行统计分析。以P<0.05为差异有统计学意义。
2 分析与结果
2.1 总蒽醌的含量测定
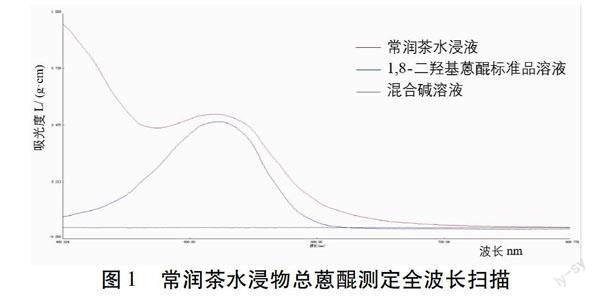
2.1.1 测定波长的选择 按照“1.2.1.2”项下方法制备样品并按照“1.2.1.3”项下方法显色,在400~800 nm波长范围内对供试品和对照品显色后的溶液进行扫描。见图1。标品溶液在(524±2)nm范围有最大吸收波长,供试品溶液在522 nm处有最大吸收波长,混合碱液在400~800 nm范围无干扰,最终选择522 nm为检测波长。
2.1.2 方法学考察 分别精密吸取1,8-二羟基蒽醌标准品溶液0.00 mL、0.20 mL、0.40 mL、0.80 mL、1.20 mL、1.6 mL、2.0 mL、2.4 mL于25 mL容量瓶中,制备供试品并测定吸光度。以浓度为纵坐标,吸光度为横坐标,绘制标准曲线。回归方程为Y=0.018 4X,r=0.999 2,在0~0.016 mg/mL范围内线性关系良好。
制备供试品并显色,分别于0 min、10 min、20 min、30 min、40 min、50 min、60 min、90 min进行测定吸光度,相对标准偏差(Relative Standard Deviation,RSD)为2.81%,提示供试品在90 min内显色稳定性良好。取对照品溶液,连续6次测定吸光度,RSD为0.21%,说明该检测仪器精密度良好。称取样品6份,每份约1 g,制备供试品并计算总蒽醌含量。总蒽醌平均含量为1.48 mg/g,6份样品含量所得RSD为2.61%,说明该方法重复性良好。取常润茶样品9份,称量每份样品500 mg,分别以1∶0.5、1∶1、1∶1.5比例加入对照品溶液并制备供试品,计算总蒽醌含量,结果显示总蒽醌整体加样回收率范围在96.22%~102.06%之间,RSD小于3%。
2.2 番泻苷A、番泻苷B及大黄酸的含量测定 分别精密吸取“1.2.2.2”项下3种溶液各10 μL,按照“1.2.2.1”项下色谱条件测定。番泻苷A、番泻苷B、大黄酸分离度良好,在3种成分对应色谱峰附近没有其他物质色谱峰的干扰,说明该方法专属性良好。见图2。
精密量取对照品溶液各0.1 mL、0.3 mL、0.5 mL、1.0 mL、1.5 mL,分别置于2 mL容量瓶中,加0.1%NaHCO3水溶液定容。分别以番泻苷A、番泻苷B、大黄酸进样量为横坐标,峰面积为纵坐标,进行线性回归分析,番泻苷A的回归方程分别为Y=684 483 X(r=0.999 4),在0.460 5~9.210 0 μg范围内线性关系良好。番泻苷B的回归方程为Y=1 430 954 X(r=0.999 6),在0.309 5~6.190 0 μg范围内线性关系良好。大黄酸的回归方程为Y=2 003 984 X(r=0.999 7),在0.020 52~0.410 40 μg范围内线性关系良好。
精密称量样品约1.0 g,分别于0 h、2 h、4 h、8 h、12 h、24 h、48 h测定,番泻苷A峰面积的RSD为1.56%,番泻苷B峰面积的RSD为1.78%,大黄酸峰面积的RSD为0.76%,供试品在48 h内稳定性良好。精密吸取对照品溶液10 μL,连续进样6次,6次所得番泻苷A峰面积的RSD为0.46%,番泻苷B峰面积的RSD为0.48%,大黄酸峰面积的RSD为0.43%,该检测仪器精密度良好。称量样品约1.0 g,制备样品6份并进行测定,番泻苷A平均含量为4.41 mg/g,6份样品含量的RSD为2.98%,番泻苷B平均含量为2.49 mg/g,6份样品含量的RSD为2.70%,大黄酸平均含量为0.23 mg/g,6份样品含量的RSD为2.84%。结果表明该方法重复性良好。取常润茶样品9份,精密称量每份样品500 mg,分别以1∶0.5、1∶1、1∶1.5比例加入对照品溶液适量,制备样品并进行检测,番泻苷A加样回收率范围在96.28~101.96%之间,RSD小于3%,番泻苷B加样回收率范围在96.70~102.13%之间,RSD小于3%,大黄酸加样回收率范围在98.13~103.42%之间,RSD小于3%。
2.3 不同浸泡水量对常润茶中蒽醌类物质溶出的影响 含量测定结果显示,加水量与蒽醌类物质的溶出正相关,随着加水量的增加,总蒽醌、番泻苷A、番泻苷B、大黄酸含量逐渐升高,加水量为40倍时,总蒽醌及番泻苷A、B的含量曲线趋于平缓,加水量为60倍时,大黄酸的含量曲线趋于平缓。
2.4 不同浸泡次数对常润茶水浸液中蒽醌类物质溶出的影响 含量测定结果显示,浸泡1次可将大部分蒽醌类物质溶出,从第2次浸泡开始,总蒽醌、番泻苷A、番泻苷B、大黄酸的含量均显著减小。
2.3 动物实验
2.3.1 一般状态观察及小鼠体质量 实验过程中小鼠未出现腹泻的情况。各组之间小鼠皮毛色泽、精神状态差异无统计学意义(P>0.05)。实验第1天,各组小鼠体质量差异无统计学意义(均P>0.05)。实验第7天,与空白组比较,模型组小鼠体质量差异无统计学意义(P>0.05),与模型组比较,常2次组和常4次组体质量显著降低(P<0.05,P<0.05)。见图5。
2.3.2 首粒排黑便时间、5 h黑便粒数 与空白组比较,模型组小鼠首粒排黑便时间显著增加(P<0.001),5 h黑便粒数显著降低(P<0.001)。与模型组比较,各常润茶给药组小鼠首粒排黑便时间显著降低(P<0.05,P<0.05,P<0.01,P<0.01,P<0.01);5 h黑便粒数显著增加(P<0.01,P<0.001,P<0.001,P<0.001,P<0.001,P<0.01)。与常100组比较,常40组、常60组、常4次组5 h黑便粒数显著降低(P<0.01,P<0.05,P<0.01)。见图6。
2.3.3 小肠推进率 与空白组比较,模型组小鼠炭末推进距离,小肠推进率显著降低(P<0.001,P<0.001)。与模型组比较,各常润茶给药组小鼠炭末推进距离均显著升高(P<0.001,P<0.001,P<0.001,P<0.001,P<0.001);与模型组比较,除常40组外,其余各常润茶给药组小鼠炭末推进率显著升高(P<0.05,P<0.001,P<0.001,P<0.01)。见图7。
2.3.4 粪便含水量 与空白组比较,模型组小鼠第7天时粪便含水量降低但差异无统计学意义(P>0.05)。与模型组比较,除常40组外其余组小鼠粪便含水量均显著升高(P<0.05,P<0.01,P<0.001,P<0.001)。與常100组比较,常4次组小鼠粪便含水量显著升高(P<0.01)。见图8。
2.3.5 结肠胃肠激素指标检测 与空白组比较,模型组小鼠结肠MTL、GAS、SP显著降低(P<0.05,P<0.001,P<0.001),SS显著升高(P<0.001)。与模型组比较,除常40组外,各常润茶给药组MTL水平显著升高(P<0.05,P<0.05,P<0.05,P<0.05);除常4次组外,各常润茶给药组GAS水平显著升高(P<0.05,P<0.01,P<0.01,P<0.01);各
常润茶给药组SP水平显著升高(P<0.01,P<0.001,P<0.001,P<0.001,P<0.001);各常润茶给药组SS水平显著降低(P<0.01,P<0.01,P<0.001,P<0.001,P<0.001)。与常100组比较,常4次组SP水平显著降低(P<0.05);常2次、常4次组SS水平显著降低(P<0.05,P<0.01)。见图9。
3 讨论
3.1 指标成分的选择及含量测定方法的建立 常润茶组方君药番泻叶、臣药决明子可泻热行滞,是常润茶发挥润肠通便作用的主要中药,蒽醌类物质是番泻叶和决明子主要成分也是其泻下的活性成分[2-3]。蒽醌以结合型及游离型2种形式存在,常润茶中结合型蒽醌主要为番泻苷A、番泻苷B、大黄酸-8-葡萄糖苷、芦荟大黄素-8-葡萄糖苷等,游离蒽醌以大黄素型蒽醌为主,包括大黄酸、大黄素、芦荟大黄素、大黄酚、大黄素甲醚、橙黄决明素等。番泻苷A、B一般分子量较大,结构中的葡萄糖可以保护苷元不被胃肠水解和破坏,进入结肠后经肠道菌群转化为大黄酸蒽酮,发挥泻下功效[4-6]。大黄酸生物利用度高,较为稳定,经肠道菌群同样转化为大黄酸蒽酮发挥泻下功效[7],研究表明大黄酸可显著改善便秘小鼠的肠道传输功能,降低便秘小鼠结肠黏膜AQP3的表达,缓解便秘[8-10]。本研究选择番泻苷A、番泻苷B及大黄酸作为指标成分[11-13],经过方法学考察,专属性强、准确度高,适用于常润茶水浸出液中蒽醌类物质的含量测定。
3.2 浸泡水量及浸泡次数对常润茶水浸液中蒽醌类物质溶出的影响 根据每日用量设置加水倍数为10倍、20倍、40倍、60倍、80倍、100倍。含量测定结果显示,加水量与蒽醌类物质的溶出正相关,加水倍量为60倍时,蒽醌类物质的含量曲线趋于平缓。因此在实际服用过程中,每袋常润茶(2.5 g/袋)用150~250 mL热水浸泡,蒽醌类物质溶出较稳定。设置浸泡次数为1次、2次、3次、4次,研究浸泡次数对蒽醌类物质溶出的影响。含量测定结果显示,浸泡一次可将大部分蒽醌类物质溶出,第2次、第3次、第4次蒽醌类物质的含量均明显降低,因此在实际服用过程中,浸泡1次即可。
3.3 便秘模型的建立及常润茶通便作用验证 洛哌丁胺是动物便秘模型建立中应用最多也较为稳定的造模药物[14],本研究选择洛哌丁胺为造模药。便秘是以排便次数减少、粪便干硬、排便费力等为主要表现的消化系统常见疾病,排便情况的观察和胃肠传输速率是对便秘动物模型最直观、最常用的评价方法。与空白组比较,模型组小鼠小肠推进率及5 h黑便粒数显著降低,首粒排黑便时间显著延长,可判定便秘模型建立成功。
与模型组比较,各常润茶给药组小鼠小肠推进率及5 h黑便粒数显著升高,首粒排黑便时间显著缩短,初步判断常润茶可润肠通便。其中常100组小鼠5 h黑便粒数显著高于常40组、常4次组,与模型组比较,常40组炭末推进率差异无统计学意义。由此可知,浸泡水量与常润茶通便作用正相关,浸泡水量为60~100倍时通便作用显著。常润茶反复冲泡通便作用不优于浸泡1次,故沒有必要多次浸泡。
3.4 不同浸泡次数及水量常润茶对便秘小鼠肠道动力与黏液的影响 便秘的发生与肠系神经系统及胃肠激素关系密切[15-16],其中GAS、MTL、SP属于兴奋性神经递质,各常润茶给药组小鼠GAS、MTL、SP含量升高,胃排空速率增加,结肠蠕动能力加快,GAS与SP为脑肠肽,作用于结肠平滑肌的同时可通过神经递质调节促进胃酸分泌,减少胃肠道对水分的吸收,增加粪便含水量,缩短粪便在肠道内停留时间,促进排便。SS属于抑制性胃肠激素,给药小鼠SS含量降低,也可有效抑制肠道蠕动、增加肠液及多肽类激素分泌、加快肠道血流量,促进排便。常润茶可通过调节胃肠激素,促进肠液分泌,增加粪便含水量,产生排便作用。
番泻叶可改变肠道蠕动功能,研究表明低浓度番泻叶泻下作用温和,长期应用对大鼠体质量无影响[17],随着浸泡水量增加,常润茶中蒽醌类物质溶出增加,常润茶通便功能增强,小鼠体质量未出现显著变化。而高浓度番泻叶泻下作用峻猛,可显著减缓体质量增长,出现腹泻等症状,可能与肠道SS水平降低及小肠黏膜活性变化有关[18],同时临床不良反应报道提示,蒽醌类中药叠加使用,升高了蒽醌类制剂的安全风险,常润茶中番泻叶与决明子协同发挥作用,随着浸泡次数的增加,小鼠体质量比较于空白组显著降低,粪便含水量显著升高,泻下功能降低,考虑可能与SS水平显著降低,肠道内水分大量流失有关。
4 总结
蒽醌类物质的不良反应大多与其长期大剂量使用有关,有效物质溶出受到加水量及浸泡次数的影响。本研究以问题为导向建立了常润茶水浸液中主要功效成分总蒽醌比色法以及番泻苷A、番泻苷B及大黄酸的含量测定方法,并考察了不同浸泡次数及水量对其溶出的影响,明确了常润茶通便的物质基础。常润茶规格为2.5 g/袋,从有效成分溶出的角度确定2袋/d,建议浸泡水量为150~250 mL(60~100倍),浸泡1次服用即可,无须反复冲泡。本研究进一步结合动物实验探究浸泡次数及水量与其通便作用的量效关系,从有效性方面证实了通过体外测定有效成分含量确定的常润茶服用方法,并深入研究了其通便作用机制,表明常润茶可调节MTL促进肠道蠕动,增加胃肠传输功能,调节GAS、SP、SS促进肠液分泌,增加粪便含水量。此外蒽醌类物质协同作用致使肠道水分大量流失,提示反复冲泡可能引起小鼠体质量降低。
本研究综合应用药学及药理学方法对蒽醌类物质的溶出及其通便作用进行考察,为含蒽醌类成分的中药复方精准应用提供实验依据。
利益冲突声明:无。
参考文献
[1]王林元,王淳,张建军,等.辨证保健理论体系的构建[J].中华中医药杂志,2022,37(9):4993-5000.
[2]胡军.番泻叶颗粒的研制及其促模型小鼠胃肠动力作用机制的研究[D].重庆:西南大学,2018.
[3]董玉洁,蒋沅岐,刘毅,等.决明子的化学成分、药理作用及质量标志物预测分析[J].中草药,2021,52(9):2719-2732.
[4]李满香.番泻中番泻苷提取分离工艺及其活性研究[D].贵阳:贵州大学,2019.
[5]刘飞.两基原中药决明子质量等同性与安全性研究[D].成都:成都中医药大学,2017.
[6]陶明宝,张乐,刘飞,等.含蒽醌类成分中药的安全性研究进展[J].中药药理与临床,2016,32(6):238-243.
[7]张宇航,徐佳元,曹丹,等.肠道微生物菌群对大黄蒽醌类化合物代谢研究进展[J].中华中医药学刊,2021,39(10):203-211.
[8]卢少欢,龙晓英,胡燕等.番泻苷的研究进展[J].广东药学院学报,2014,30(1):118-122.
[9]姜洪波,孙莉莉,刘伯语,等.大黄酸对便秘小鼠肠道传输功能和结肠肌电及结肠黏膜水通道蛋白3表达的影响[J].中国老年学杂志,2017,37(17):4169-4172.
[10]张丽娅,李刚,王永兵.中药干预慢传输型便秘肠道水通道蛋白表达及其作用机制的研究进展[J].中成药,2021,43(1):163-167.
[11]陈倩倩,史红专,郭巧生,等.不同变异类型药用大黄筛选及其产量和内在品质比较[J].中草药,2022,53(6):1862-1867.
[12]李静,张青,肖春霞,等.HPLC波长切换法同时测定排毒养颜胶囊中10种成分[J].中草药,2018,49(20):4824-4830.
[13]郭珍.紫外光谱在天然产物结构鉴定中的应用[J].光谱实验室,2006,23(3):594-597.
[14]王萍,方晓艳,苗明三.基于数据挖掘的便秘动物模型应用分析[J].中国比较医学杂志,2021,31(7):49-54.
[15]王芳,李海华,马远新,等.泻黄散加味配合排便训练治疗脾胃积热型小儿便秘的疗效观察[J].中国中西医结合消化杂志,2022,30(1):1-5.
[16]刘芳,魏先鹏,唐学贵.枳实导滞丸加减治疗慢传输型便秘热积秘证的临床观察[J].中国实验方剂学杂志,2020,26(2):92-97.
[17]管志伟,赵琼,赵中和,等.番泻叶致幼龄大鼠腹泻模型量-时-效关系研究[J].时珍国医国药,2021,32(8):1806-1809.
[18]徐琦,劉又嘉,邓艳玲,等.番泻叶对腹泻小鼠肠道乳糖酶活性的影响[J].湖南中医杂志,2016,32(8):189-191.
(2022-11-15收稿 本文编辑:吴珊)
基金项目:国家重点研发计划(2018YFC1706803)作者简介:武洁(1999.07—),女,硕士,研究方向:中药开发与产业化应用,E-mail:wj18811382122@163.com通信作者:王林元(1961.10—),男,硕士,教授,研究方向:中药开发与产业化应用,E-mail:wanglinyuan110@vip.163.com;郑立新(1980.08—),女,硕士,高级工程师,研究方向:毒理学及保健食品功能,E-mail:594782086@qq.com
